
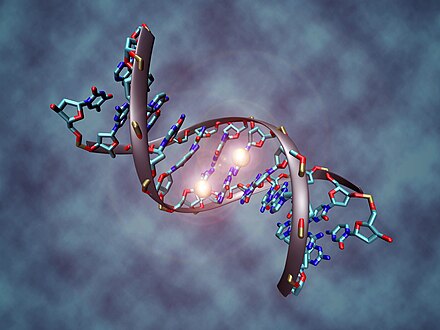
La metilación del ADN es un proceso biológico mediante el cual se añaden grupos metilo a la molécula de ADN . La metilación puede cambiar la actividad de un segmento de ADN sin cambiar la secuencia. Cuando se localiza en un promotor genético , la metilación del ADN normalmente actúa para reprimir la transcripción genética . En los mamíferos, la metilación del ADN es esencial para el desarrollo normal y está asociada con una serie de procesos clave que incluyen la impresión genómica , la inactivación del cromosoma X , la represión de elementos transponibles , el envejecimiento y la carcinogénesis .
Hasta 2016, se han encontrado dos nucleobases en las que se produce la metilación enzimática natural del ADN: adenina y citosina . Las bases modificadas son N 6 -metiladenina, [1] 5-metilcitosina [2] y N 4 -metilcitosina. [3]
Dos de las cuatro bases del ADN, citosina y adenina , pueden metilarse. La metilación de citosinas está muy extendida tanto en eucariotas como en procariotas , aunque la tasa de metilación del ADN de citosina puede diferir mucho entre especies: el 14% de las citosinas están metiladas en Arabidopsis thaliana , del 4% al 8% en Physarum , [4] el 7,6% en Mus musculus , 2,3% en Escherichia coli , 0,03% en Drosophila , 0,006% en Dictyostelium [5] y prácticamente nada (0,0002 a 0,0003%) en Caenorhabditis [6] u hongos como Saccharomyces cerevisiae y S. pombe (pero no N. crassa ) . [7] [8] : 3699 Se ha observado metilación de adenina en ADN de bacterias, plantas y recientemente en mamíferos, [9] [10] pero ha recibido mucha menos atención.
La metilación de la citosina para formar 5-metilcitosina se produce en la misma posición 5 del anillo de pirimidina donde se encuentra el grupo metilo de la base del ADN timina ; la misma posición distingue a la timina de la base de ARN análoga uracilo , que no tiene grupo metilo. La desaminación espontánea de la 5-metilcitosina la convierte en timina. Esto da como resultado una discrepancia T:G. Los mecanismos de reparación luego lo corrigen de nuevo al par C:G original; alternativamente, pueden sustituir A por G, convirtiendo el par C:G original en un par T:A, cambiando efectivamente una base e introduciendo una mutación. Esta base mal incorporada no se corregirá durante la replicación del ADN ya que la timina es una base del ADN. Si el desajuste no se repara y la célula entra en el ciclo celular, la cadena que lleva la T se complementará con una A en una de las células hijas, de modo que la mutación se vuelve permanente. El uso casi universal de timina exclusivamente en el ADN y uracilo exclusivamente en el ARN puede haber evolucionado como un mecanismo de control de errores para facilitar la eliminación de los uracilos generados por la desaminación espontánea de la citosina. [11] Se cree que la metilación del ADN, así como muchas de sus metiltransferasas de ADN contemporáneas, evolucionaron a partir de la actividad de metilación del ARN primitiva del mundo temprano y está respaldada por varias líneas de evidencia. [12]
En plantas y otros organismos, la metilación del ADN se encuentra en tres contextos de secuencia diferentes: CG (o CpG ), CHG o CHH (donde H corresponde a A, T o C). Sin embargo, en los mamíferos, la metilación del ADN se encuentra casi exclusivamente en los dinucleótidos CpG, estando normalmente metiladas las citosinas de ambas cadenas. Sin embargo, la metilación sin CpG se puede observar en células madre embrionarias , [13] [14] [15] y también se ha indicado en el desarrollo neural . [16] Además, también se ha observado metilación no CpG en células progenitoras hematopoyéticas , y ocurrió principalmente en un contexto de secuencia CpApC. [17]

El panorama de la metilación del ADN de los vertebrados es muy particular en comparación con el de otros organismos. En los mamíferos, alrededor del 75% de los dinucleótidos CpG están metilados en las células somáticas [18] y la metilación del ADN aparece como un estado predeterminado que debe excluirse específicamente de ubicaciones definidas . [15] [19] Por el contrario, el genoma de la mayoría de las plantas, invertebrados, hongos o protistas muestra patrones de metilación en “mosaico”, en los que solo se atacan elementos genómicos específicos, y se caracterizan por la alternancia de dominios metilados y no metilados. [20] [21]

La alta metilación de CpG en genomas de mamíferos tiene un costo evolutivo porque aumenta la frecuencia de mutaciones espontáneas. La pérdida de grupos amino se produce con alta frecuencia en las citosinas, con diferentes consecuencias dependiendo de su metilación. Los residuos C metilados se desaminan espontáneamente para formar residuos T con el tiempo; por lo tanto, los dinucleótidos CpG se desaminan constantemente a dinucleótidos TpG, lo que se evidencia por la subrepresentación de dinucleótidos CpG en el genoma humano (ocurren con sólo el 21% de la frecuencia esperada). [22] (Por otro lado, la desaminación espontánea de los residuos C no metilados da lugar a residuos U, un cambio que la célula reconoce y repara rápidamente).
En los mamíferos, la única excepción para este agotamiento global de CpG reside en una categoría específica de secuencias ricas en GC y CpG denominadas islas CpG que generalmente no están metiladas y, por lo tanto, conservan el contenido de CpG esperado. [23] Las islas CpG generalmente se definen como regiones con: 1) una longitud superior a 200 pb, 2) un contenido de G+C superior al 50 %, 3) una relación entre CpG observado y esperado superior a 0,6, aunque a veces se utilizan otras definiciones. usado. [24] Excluyendo secuencias repetidas, hay alrededor de 25.000 islas CpG en el genoma humano, el 75% de las cuales tienen menos de 850 pb de largo. [22] Son unidades reguladoras importantes y alrededor del 50% de las islas CpG están ubicadas en regiones promotoras de genes, mientras que otro 25% se encuentra en cuerpos genéticos, que a menudo sirven como promotores alternativos. Recíprocamente, alrededor del 60-70% de los genes humanos tienen una isla CpG en su región promotora. [25] [26] La mayoría de las islas CpG están constitutivamente desmetiladas y enriquecidas para la modificación permisiva de la cromatina , como la metilación de H3K4 . En los tejidos somáticos, sólo el 10% de las islas CpG están metiladas, localizándose la mayoría de ellas en regiones intergénicas e intragénicas.
La metilación del ADN probablemente estuvo presente en cierta medida en los primeros ancestros de los eucariotas. Prácticamente en todos los organismos analizados, la metilación en las regiones promotoras se correlaciona negativamente con la expresión genética. [20] [27] Los promotores densos en CpG de genes transcritos activamente nunca están metilados, pero, recíprocamente, los genes transcripcionalmente silenciosos no necesariamente llevan un promotor metilado. En ratones y humanos, alrededor del 60% al 70% de los genes tienen una isla CpG en su región promotora y la mayoría de estas islas CpG permanecen sin metilar independientemente de la actividad transcripcional del gen, tanto en tipos de células diferenciadas como indiferenciadas. [28] [29] Es de destacar que, mientras que la metilación del ADN de las islas CpG está inequívocamente relacionada con la represión transcripcional, la función de la metilación del ADN en promotores pobres en CG sigue sin estar clara; aunque hay poca evidencia de que pueda ser funcionalmente relevante. [30]
La metilación del ADN puede afectar la transcripción de genes de dos maneras. En primer lugar, la metilación del ADN en sí puede impedir físicamente la unión de las proteínas transcripcionales al gen, [31] y en segundo lugar, y probablemente más importante, el ADN metilado puede estar unido por proteínas conocidas como proteínas del dominio de unión a metil-CpG (MBD). Luego, las proteínas MBD reclutan proteínas adicionales para el locus, como las histonas desacetilasas y otras proteínas remodeladoras de la cromatina que pueden modificar las histonas , formando así cromatina compacta e inactiva, denominada heterocromatina . Este vínculo entre la metilación del ADN y la estructura de la cromatina es muy importante. En particular, la pérdida de la proteína 2 de unión a metil-CpG (MeCP2) se ha implicado en el síndrome de Rett ; y la proteína 2 del dominio de unión a metil-CpG (MBD2) media el silenciamiento transcripcional de genes hipermetilados en el "cáncer".
La metilación del ADN es un poderoso represor transcripcional, al menos en contextos densos de CpG. La represión transcripcional de genes codificadores de proteínas parece esencialmente limitada a clases muy específicas de genes que deben permanecer en silencio de forma permanente y en casi todos los tejidos. Si bien la metilación del ADN no tiene la flexibilidad necesaria para afinar la regulación genética, su estabilidad es perfecta para garantizar el silenciamiento permanente de los elementos transponibles . [32] El control de transposones es una de las funciones más antiguas de la metilación del ADN que comparten animales, plantas y múltiples protistas. [33] Incluso se sugiere que la metilación del ADN evolucionó precisamente para este propósito. [34]
Se sabe que la metilación del ADN de elementos transponibles está relacionada con la expansión del genoma. Sin embargo, aún se desconoce el motor evolutivo de la expansión del genoma. Existe una clara correlación entre el tamaño del genoma y CpG, lo que sugiere que la metilación del ADN de los elementos transponibles condujo a un aumento notable en la masa del ADN. [35]
Una función que parece incluso más conservada que el silenciamiento de transposones se correlaciona positivamente con la expresión genética. En casi todas las especies donde está presente la metilación del ADN, la metilación del ADN está especialmente enriquecida en el cuerpo con genes altamente transcritos. [20] [27] La función de la metilación del cuerpo genético no se comprende bien. Un conjunto de pruebas sugiere que podría regular el empalme [36] y suprimir la actividad de unidades transcripcionales intragénicas (promotores crípticos o elementos transponibles). [37] La metilación del cuerpo genético parece estar estrechamente relacionada con la metilación del H3K36. En levaduras y mamíferos, la metilación de H3K36 está altamente enriquecida en el cuerpo de genes altamente transcritos. Al menos en la levadura, H3K36me3 recluta enzimas como las histonas desacetilasas para condensar la cromatina y prevenir la activación de sitios de inicio crípticos. [38] En los mamíferos, el dominio PWWP DNMT3a y DNMT3b se une a H3K36me3 y las dos enzimas se reclutan en el cuerpo de genes transcritos activamente.

Los patrones de metilación del ADN se borran en gran medida y luego se restablecen entre generaciones en los mamíferos. Casi todas las metilaciones de los padres se borran, primero durante la gametogénesis y nuevamente en la embriogénesis temprana , ocurriendo cada vez desmetilación y remetilación. La desmetilación en la embriogénesis temprana ocurre en el período previo a la implantación en dos etapas: inicialmente en el cigoto , luego durante los primeros ciclos de replicación embrionaria de mórula y blástula . Luego se produce una ola de metilación durante la etapa de implantación del embrión, con las islas CpG protegidas de la metilación. Esto da como resultado una represión global y permite que los genes de mantenimiento se expresen en todas las células. En la etapa posterior a la implantación, los patrones de metilación son específicos de la etapa y del tejido, con cambios que definirían cada tipo de célula individual y que durarían de manera estable durante un largo período. [39] Los estudios sobre yemas de extremidades de rata durante la embriogénesis han ilustrado aún más la naturaleza dinámica de la metilación del ADN en el desarrollo. En este contexto, se observaron variaciones en la metilación global del ADN en diferentes etapas de desarrollo y condiciones de cultivo, lo que destaca la intrincada regulación de la metilación durante la organogénesis y sus posibles implicaciones para las estrategias de medicina regenerativa. [40]
Si bien la metilación del ADN no es necesaria per se para el silenciamiento transcripcional, se cree que representa un estado "bloqueado" que inactiva definitivamente la transcripción. En particular, la metilación del ADN parece fundamental para el mantenimiento del silenciamiento monoalélico en el contexto de la impresión genómica y la inactivación del cromosoma X. [41] [42] En estos casos, los alelos expresados y silenciosos difieren por su estado de metilación, y la pérdida de metilación del ADN resulta en la pérdida de impronta y reexpresión de Xist en células somáticas. Durante el desarrollo embrionario, pocos genes cambian su estado de metilación, con la importante excepción de muchos genes expresados específicamente en la línea germinal. [43] La metilación del ADN parece absolutamente necesaria en las células diferenciadas , ya que la eliminación de cualquiera de las tres ADN metiltransferasas competentes produce letalidad embrionaria o posparto. Por el contrario, la metilación del ADN es prescindible en tipos de células indiferenciadas, como la masa celular interna del blastocisto, las células germinales primordiales o las células madre embrionarias. Dado que la metilación del ADN parece regular directamente sólo un número limitado de genes, sigue siendo una cuestión abierta la precisión con que la ausencia de metilación del ADN causa la muerte de las células diferenciadas.
Debido al fenómeno de la impronta genómica , los genomas maternos y paternos están marcados diferencialmente y deben reprogramarse adecuadamente cada vez que pasan por la línea germinal. Por lo tanto, durante la gametogénesis , a las células germinales primordiales se les deben borrar sus patrones de metilación del ADN biparental originales y restablecerlos en función del sexo del progenitor transmisor. Después de la fertilización, los genomas paterno y materno se desmetilan y remetilan nuevamente (a excepción de las regiones metiladas diferencialmente asociadas con genes impresos). Es probable que esta reprogramación sea necesaria para la totipotencia del embrión recién formado y la eliminación de los cambios epigenéticos adquiridos. [44]
En muchos procesos patológicos, como el cáncer , las islas CpG promotoras del gen adquieren una hipermetilación anormal, lo que da como resultado un silenciamiento transcripcional que las células hijas pueden heredar después de la división celular. [45] Las alteraciones de la metilación del ADN han sido reconocidas como un componente importante del desarrollo del cáncer. La hipometilación, en general, surge antes y está relacionada con la inestabilidad cromosómica y la pérdida de impronta, mientras que la hipermetilación se asocia con promotores y puede surgir como consecuencia del silenciamiento de genes (supresores de oncogenes), pero podría ser un objetivo para la terapia epigenética . [46] En contextos de desarrollo, los cambios dinámicos en los patrones de metilación del ADN también tienen implicaciones importantes. Por ejemplo, en yemas de extremidades de rata, los cambios en el estado de metilación se asociaron con diferentes etapas de la condrogénesis, lo que sugiere un vínculo potencial entre la metilación del ADN y la progresión de ciertos procesos de desarrollo. [40]
La hipometilación global también se ha implicado en el desarrollo y progresión del cáncer a través de diferentes mecanismos. [47] Por lo general, hay hipermetilación de genes supresores de tumores e hipometilación de oncogenes . [48]
Generalmente, en la progresión hacia el cáncer, cientos de genes son silenciados o activados . Aunque el silenciamiento de algunos genes en el cáncer se produce por mutación, una gran proporción del silenciamiento de genes cancerígenos es el resultado de una metilación alterada del ADN (ver Metilación del ADN en el cáncer ). La metilación del ADN que causa el silenciamiento en el cáncer ocurre típicamente en múltiples sitios CpG en las islas CpG que están presentes en los promotores de genes codificantes de proteínas.
Las expresiones alteradas de microARN también silencian o activan muchos genes en la progresión hacia el cáncer (ver microARN en cáncer ). "La expresión alterada de microARN se produce mediante hiper/hipometilación de sitios CpG en islas CpG en promotores que controlan la transcripción de los microARN ".
El silenciamiento de los genes reparadores del ADN mediante la metilación de islas CpG en sus promotores parece ser especialmente importante en la progresión hacia el cáncer (ver metilación de genes reparadores del ADN en el cáncer ).
Las modificaciones epigenéticas, como la metilación del ADN, se han implicado en enfermedades cardiovasculares, incluida la aterosclerosis . En modelos animales de aterosclerosis, el tejido vascular, así como las células sanguíneas, como las células sanguíneas mononucleares, exhiben una hipometilación global con áreas de hipermetilación específicas de genes. Los polimorfismos de metilación del ADN pueden usarse como biomarcador temprano de aterosclerosis, ya que están presentes antes de que se observen las lesiones, lo que puede proporcionar una herramienta temprana para la detección y prevención de riesgos. [49]
Dos de los tipos de células objetivo de los polimorfismos de metilación del ADN son los monocitos y los linfocitos, que experimentan una hipometilación general. Un mecanismo propuesto detrás de esta hipometilación global son los niveles elevados de homocisteína que causan hiperhomocisteinemia , un factor de riesgo conocido de enfermedad cardiovascular. Los niveles elevados de homocisteína en plasma inhiben las ADN metiltransferasas, lo que provoca hipometilación. La hipometilación del ADN afecta genes que alteran la proliferación de las células del músculo liso, causan disfunción de las células endoteliales y aumentan los mediadores inflamatorios, todos los cuales son críticos en la formación de lesiones ateroscleróticas. [50] Los niveles altos de homocisteína también resultan en la hipermetilación de las islas CpG en la región promotora del gen del receptor de estrógeno alfa (ERα), lo que provoca su regulación negativa. [51] ERα protege contra la aterosclerosis debido a su acción como supresor del crecimiento, lo que hace que las células del músculo liso permanezcan en un estado inactivo. [52] La hipermetilación del promotor ERα permite que las células del músculo liso de la íntima proliferen excesivamente y contribuyan al desarrollo de la lesión aterosclerótica. [53]
Otro gen que experimenta un cambio en el estado de metilación en la aterosclerosis es el transportador de monocarboxilato (MCT3), que produce una proteína responsable del transporte de lactato y otros cuerpos cetónicos de muchos tipos de células, incluidas las células del músculo liso vascular. En pacientes con aterosclerosis, hay un aumento en la metilación de las islas CpG en el exón 2, lo que disminuye la expresión de la proteína MCT3. La regulación negativa de MCT3 altera el transporte de lactato y aumenta significativamente la proliferación de células del músculo liso, lo que contribuye aún más a la lesión aterosclerótica. Se demostró que un experimento ex vivo utilizando el agente desmetilante Decitabina (5-aza-2-desoxicitidina) induce la expresión de MCT3 de una manera dependiente de la dosis, ya que todos los sitios hipermetilados en la isla CpG del exón 2 se desmetilaron después del tratamiento. Esto puede servir como un nuevo agente terapéutico para tratar la aterosclerosis, aunque hasta el momento no se han realizado estudios en humanos. [54]
Además de la aterosclerosis descrita anteriormente, se han identificado cambios epigenéticos específicos en el corazón humano defectuoso. Esto puede variar según la etiología de la enfermedad. Por ejemplo, en la insuficiencia cardíaca isquémica, los cambios en la metilación del ADN se han relacionado con cambios en la expresión genética que pueden dirigir la expresión genética asociada con los cambios en el metabolismo cardíaco que se sabe que ocurren. [55] Se deben explorar formas adicionales de insuficiencia cardíaca (por ejemplo, miocardiopatía diabética) y comorbilidades (por ejemplo, obesidad) para ver qué tan comunes son estos mecanismos. Lo más sorprendente es que, en el corazón humano defectuoso, estos cambios en la metilación del ADN se asocian con el estatus racial y socioeconómico, lo que impacta aún más en cómo se altera la expresión genética [56] y puede influir en cómo se debe tratar la insuficiencia cardíaca del individuo.
En humanos y otros mamíferos, los niveles de metilación del ADN se pueden utilizar para estimar con precisión la edad de los tejidos y los tipos de células, formando un reloj epigenético preciso . [57]
Un estudio longitudinal de niños gemelos mostró que, entre las edades de 5 y 10 años, había divergencias en los patrones de metilación debido a influencias ambientales más que genéticas. [58] Hay una pérdida global de metilación del ADN durante el envejecimiento. [48]
En un estudio que analizó los metilomas completos del ADN de las células T CD4 + en un recién nacido, un individuo de 26 años y un individuo de 103 años, se observó que la pérdida de metilación es proporcional a la edad. [59] Los CpG hipometilados observados en los ADN centenarios en comparación con los recién nacidos cubrieron todos los compartimentos genómicos (promotores, regiones intergénicas , intrónicas y exónicas ). [59] Sin embargo, algunos genes se hipermetilan con la edad, incluidos los genes del receptor de estrógeno , p16 , y el factor de crecimiento similar a la insulina 2 . [48]
Se ha demostrado que el ejercicio de alta intensidad produce una reducción de la metilación del ADN en el músculo esquelético. [60] La metilación del promotor de PGC-1α y PDK4 se redujo inmediatamente después del ejercicio de alta intensidad, mientras que la metilación de PPAR-γ no se redujo hasta tres horas después del ejercicio. [60] Al mismo tiempo, seis meses de ejercicio en hombres de mediana edad previamente sedentarios dieron como resultado un aumento de la metilación en el tejido adiposo . [61] Un estudio mostró un posible aumento en la metilación global del ADN genómico de los glóbulos blancos con más actividad física en personas no hispanas. [62]
Un estudio que investigó el metiloma de las células B a lo largo de su ciclo de diferenciación, mediante secuenciación con bisulfito de todo el genoma (WGBS), demostró que existe una hipometilación desde las etapas más tempranas hasta las más diferenciadas. La mayor diferencia de metilación se da entre las etapas de las células B del centro germinal y las células B de memoria. Además, este estudio demostró que existe una similitud entre los tumores de células B y las células B de larga vida en sus firmas de metilación del ADN. [17]
Dos revisiones resumen la evidencia de que las alteraciones de la metilación del ADN en las neuronas del cerebro son importantes en el aprendizaje y la memoria. [63] [64] El condicionamiento contextual del miedo (una forma de aprendizaje asociativo) en animales, como ratones y ratas, es rápido y extremadamente sólido a la hora de crear recuerdos. [65] En ratones [66] y en ratas [67] el condicionamiento contextual del miedo, dentro de 1 a 24 horas, se asocia con metilaciones alteradas de varios miles de citosinas de ADN en genes de las neuronas del hipocampo . Veinticuatro horas después del condicionamiento contextual del miedo, el 9,2% de los genes de las neuronas del hipocampo de rata están metilados diferencialmente. [67] En ratones, [66] cuando se examinaron cuatro semanas después del acondicionamiento, las metilaciones y desmetilaciones del hipocampo se habían restablecido a las condiciones originales. El hipocampo es necesario para formar recuerdos, pero los recuerdos no se almacenan allí. Para tales ratones, cuatro semanas después del condicionamiento de miedo contextual, se produjeron metilaciones y desmetilaciones diferenciales sustanciales de CpG en las neuronas corticales durante el mantenimiento de la memoria, y había 1.223 genes metilados diferencialmente en su corteza cingulada anterior. [66] Los mecanismos que guían las nuevas metilaciones y desmetilaciones del ADN en el hipocampo durante el establecimiento de la memoria se resumieron en 2022. [68] Esa revisión también indicó los mecanismos por los cuales los nuevos patrones de metilación dieron lugar a nuevos patrones de expresión del ARN mensajero . Estos nuevos ARN mensajeros fueron luego transportados por partículas RNP mensajeras (gránulos neuronales) a las sinapsis de las neuronas, donde podrían traducirse en proteínas. [68] Los cambios activos en la metilación y desmetilación del ADN neuronal parecen actuar como controladores del escalamiento sináptico y el tráfico del receptor de glutamato en el aprendizaje y la formación de la memoria . [63]

En las células de mamíferos, la metilación del ADN se produce principalmente en la posición C5 de los dinucleótidos CpG y se lleva a cabo mediante dos clases generales de actividades enzimáticas: metilación de mantenimiento y metilación de novo . [69]
La actividad de metilación de mantenimiento es necesaria para preservar la metilación del ADN después de cada ciclo de replicación del ADN celular. Sin la ADN metiltransferasa (DNMT), la propia maquinaria de replicación produciría cadenas hijas que no están metiladas y, con el tiempo, conducirían a una desmetilación pasiva. DNMT1 es la metiltransferasa de mantenimiento propuesta que es responsable de copiar los patrones de metilación del ADN en las cadenas hijas durante la replicación del ADN. Los modelos de ratón con ambas copias de DNMT1 eliminadas son letales para embriones aproximadamente en el día 9, debido al requisito de la actividad de DNMT1 para el desarrollo en células de mamíferos.
Se cree que DNMT3a y DNMT3b son las metiltransferasas de novo que establecen patrones de metilación del ADN en las primeras etapas del desarrollo. DNMT3L es una proteína homóloga a las otras DNMT3 pero no tiene actividad catalítica. En cambio, DNMT3L ayuda a las metiltransferasas de novo aumentando su capacidad para unirse al ADN y estimulando su actividad. Los ratones y las ratas tienen una tercera enzima metiltransferasa funcional de novo llamada DNMT3C, que evolucionó como un parálogo de Dnmt3b mediante duplicación en tándem en el ancestro común de los roedores Muroidea. DNMT3C cataliza la metilación de promotores de elementos transponibles durante la espermatogénesis temprana, una actividad que ha demostrado ser esencial para su represión epigenética y la fertilidad masculina. [70] [71] Aún no está claro si en otros mamíferos que no tienen DNMT3C (como los humanos) dependen de DNMT3B o DNMT3A para la metilación de novo de elementos transponibles en la línea germinal. Finalmente, DNMT2 (TRDMT1) ha sido identificado como un homólogo de ADN metiltransferasa, que contiene los 10 motivos de secuencia comunes a todas las ADN metiltransferasas; sin embargo, DNMT2 (TRDMT1) no metila el ADN, sino que metila la citosina-38 en el bucle anticodón del ARN de transferencia de ácido aspártico. [72]
Dado que muchos genes supresores de tumores son silenciados por la metilación del ADN durante la carcinogénesis , ha habido intentos de reexpresar estos genes inhibiendo las DNMT. La 5-Aza-2'-desoxicitidina ( decitabina ) es un análogo de nucleósido que inhibe las DNMT atrapándolas en un complejo covalente en el ADN al prevenir el paso de catálisis de eliminación β, lo que resulta en la degradación de las enzimas. Sin embargo, para que la decitabina sea activa, debe incorporarse al genoma de la célula, lo que puede provocar mutaciones en las células hijas si la célula no muere. Además, la decitabina es tóxica para la médula ósea, lo que limita el tamaño de su ventana terapéutica. Estos obstáculos han llevado al desarrollo de terapias con ARN antisentido que se dirigen a las DNMT degradando sus ARNm e impidiendo su traducción . Sin embargo, actualmente no está claro si apuntar solo a DNMT1 es suficiente para reactivar genes supresores de tumores silenciados por la metilación del ADN.
Se han logrado avances significativos en la comprensión de la metilación del ADN en la planta modelo Arabidopsis thaliana . La metilación del ADN en las plantas difiere de la de los mamíferos: mientras que la metilación del ADN en los mamíferos ocurre principalmente en el nucleótido de citosina en un sitio CpG , en las plantas la citosina puede metilarse en los sitios CpG, CpHpG y CpHpH, donde H representa cualquier nucleótido pero no la guanina. . [73] En general, el ADN de Arabidopsis está altamente metilado; el análisis de espectrometría de masas estimó que el 14% de las citosinas estaban modificadas. [8] : resumen Posteriormente, los datos de secuenciación de bisulfito estimaron que alrededor del 25% de los sitios CG de Arabidopsis están metilados, pero estos niveles varían según la ubicación geográfica de las muestras de Arabidopsis (las plantas en el norte están más metiladas que las muestras del sur). [74]
Las principales enzimas ADN metiltransferasa de Arabidopsis , que transfieren y unen covalentemente grupos metilo al ADN, son DRM2, MET1 y CMT3. Tanto la proteína DRM2 como la MET1 comparten una homología significativa con las metiltransferasas de mamíferos DNMT3 y DNMT1, respectivamente, mientras que la proteína CMT3 es exclusiva del reino vegetal. Actualmente existen dos clases de ADN metiltransferasas: 1) la clase de novo o enzimas que crean nuevas marcas de metilación en el ADN; 2) una clase de mantenimiento que reconoce las marcas de metilación en la cadena parental de ADN y transfiere nueva metilación a las cadenas hijas después de la replicación del ADN. DRM2 es la única enzima que ha sido implicada como una ADN metiltransferasa de novo . También se ha demostrado que DRM2, junto con MET1 y CMT3, participan en el mantenimiento de las marcas de metilación a través de la replicación del ADN. [75] Otras ADN metiltransferasas se expresan en plantas pero no tienen una función conocida (consulte la base de datos de cromatina).
Los niveles de metilación del ADN en todo el genoma varían ampliamente entre especies de plantas, y las citosinas de Arabidopsis tienden a estar menos densamente metiladas que las de otras plantas. Por ejemplo, ~92,5% de las citosinas CpG están metiladas en Beta vulgaris . [76] Los patrones de metilación también difieren entre los contextos de secuencia de citosina; universalmente, la metilación de CpG es mayor que la metilación de CHG y CHH, y la metilación de CpG se puede encontrar tanto en genes activos como en elementos transponibles, mientras que CHG y CHH generalmente quedan relegados a elementos transponibles silenciados. [77] [73]
No está claro cómo la célula determina las ubicaciones de la metilación del ADN de novo , pero la evidencia sugiere que en muchas (aunque no todas) ubicaciones está involucrada la metilación del ADN dirigida por ARN (RdDM). En RdDM, se producen transcripciones de ARN específicas a partir de una plantilla de ADN genómico, y este ARN forma estructuras secundarias llamadas moléculas de ARN bicatenario. [78] Los ARN bicatenarios, a través de las vías del pequeño ARN de interferencia ( ARNip ) o del microARN ( miARN ), dirigen la metilación de novo del ADN de la ubicación genómica original que produjo el ARN. [78] Se cree que este tipo de mecanismo es importante en la defensa celular contra virus de ARN y/o transposones , los cuales a menudo forman un ARN bicatenario que puede ser mutagénico para el genoma del huésped. Al metilar sus ubicaciones genómicas, mediante un mecanismo aún poco comprendido, se desactivan y dejan de estar activos en la célula, protegiendo el genoma de su efecto mutagénico. Recientemente, se describió que la metilación del ADN es el principal determinante de la formación de cultivos embriogénicos a partir de explantes en plantas leñosas y se considera el principal mecanismo que explica la pobre respuesta de los explantes maduros a la embriogénesis somática en las plantas (Isah 2016).
Diversos órdenes de insectos muestran patrones variados de metilación del ADN, desde niveles casi indetectables en moscas hasta niveles bajos en mariposas y más altos en insectos verdaderos y algunas cucarachas (hasta el 14% de todos los sitios de CG en Blattella asahinai ). [79]
Se ha descubierto la metilación funcional del ADN en las abejas melíferas. [80] [81] Las marcas de metilación del ADN se encuentran principalmente en el cuerpo del gen, y las opiniones actuales sobre la función de la metilación del ADN es la regulación genética mediante empalme alternativo [82]
Los niveles de metilación del ADN en Drosophila melanogaster son casi indetectables. [83] Métodos sensibles aplicados al ADN de Drosophila Se sugieren niveles en el rango de 0,1 a 0,3% de la citosina total. [84] Este bajo nivel de metilación [85] parece residir en patrones de secuencia genómica que son muy diferentes de los patrones observados en humanos o en otras especies animales o vegetales hasta la fecha. La metilación genómica en D. melanogaster se encontró en motivos cortos específicos (concentrados en motivos específicos de secuencia de 5 bases ricos en CA y CT pero empobrecidos en guanina) y es independiente de la actividad de DNMT2. Además, los enfoques de espectrometría de masas altamente sensibles [86] han demostrado ahora la presencia de niveles bajos (0,07%) pero significativos de metilación de adenina durante las primeras etapas de la embriogénesis de Drosophila.
Muchos hongos tienen niveles bajos (0,1 a 0,5%) de metilación de citosina, mientras que otros hongos tienen hasta un 5% del genoma metilado. [87] Este valor parece variar tanto entre especies como entre aislados de la misma especie. [88] También hay pruebas de que la metilación del ADN puede estar implicada en el control estatal específico de la expresión genética en los hongos. [ cita necesaria ] Sin embargo, en un límite de detección de 250 attomoles mediante el uso de espectrometría de masas de sensibilidad ultraalta, la metilación del ADN no se confirmó en especies de levaduras de células individuales como Saccharomyces cerevisiae o Schizosaccharomyces pombe , lo que indica que las levaduras no poseen esta modificación del ADN. [8] : resumen
Aunque la levadura de cerveza ( Saccharomyces ), la levadura de fisión ( Schizosaccharomyces ) y Aspergillus flavus [89] no tienen metilación detectable del ADN, el hongo filamentoso modelo Neurospora crassa tiene un sistema de metilación bien caracterizado. [90] Varios genes controlan la metilación en Neurospora y la mutación de la ADN metil transferasa, dim-2 , elimina toda la metilación del ADN pero no afecta el crecimiento ni la reproducción sexual. Si bien el genoma de Neurospora tiene muy poco ADN repetido, la mitad de la metilación ocurre en ADN repetido, incluidos reliquias de transposones y ADN centromérico. La capacidad de evaluar otros fenómenos importantes en un entorno genético deficiente en ADN metilasa convierte a Neurospora en un sistema importante para estudiar la metilación del ADN.
La metilación del ADN está en gran medida ausente en Dictyostelium discoidium [91] , donde parece ocurrir en aproximadamente el 0,006% de las citosinas. [5] Por el contrario, la metilación del ADN está ampliamente distribuida en Physarum polycephalum [92] donde la 5-metilcitosina constituye hasta el 8% de la citosina total [4]

La metilación de adenina o citosina está mediada por sistemas de modificación de restricción de muchas bacterias , en los que secuencias específicas de ADN se metilan periódicamente en todo el genoma. [94] Una metilasa es la enzima que reconoce una secuencia específica y metila una de las bases en o cerca de esa secuencia. Los ADN extraños (que no están metilados de esta manera) que se introducen en la célula se degradan mediante enzimas de restricción específicas de secuencia y se escinden. Estas enzimas de restricción no reconocen el ADN genómico bacteriano. La metilación del ADN nativo actúa como una especie de sistema inmunológico primitivo, permitiendo a las bacterias protegerse de la infección por bacteriófagos .
La ADN adenina metiltransferasa (Dam) de E. coli es una enzima de ~32 kDa que no pertenece a un sistema de restricción/modificación. La secuencia de reconocimiento objetivo para E. coli Dam es GATC, ya que la metilación se produce en la posición N6 de la adenina en esta secuencia (G meATC). Los tres pares de bases que flanquean cada lado de este sitio también influyen en la unión ADN-Dam. Dam desempeña varias funciones clave en los procesos bacterianos, incluida la reparación de errores de coincidencia, el momento de la replicación del ADN y la expresión genética. Como resultado de la replicación del ADN, el estado de los sitios GATC en el genoma de E. coli cambia de completamente metilado a hemimetilado. Esto se debe a que la adenina introducida en la nueva cadena de ADN no está metilada. La remetilación se produce en un plazo de dos a cuatro segundos, tiempo durante el cual se reparan los errores de replicación en la nueva cadena. La metilación, o su ausencia, es el marcador que permite al aparato de reparación de la célula diferenciar entre la plantilla y las hebras nacientes. Se ha demostrado que la alteración de la actividad Dam en las bacterias da como resultado un aumento de la tasa de mutación espontánea. La viabilidad bacteriana se ve comprometida en mutantes dam que también carecen de otras enzimas reparadoras del ADN, lo que proporciona más evidencia del papel de Dam en la reparación del ADN.
Una región del ADN que mantiene su estado hemimetilado durante más tiempo es el origen de replicación , que tiene abundantes sitios GATC. Esto es fundamental para el mecanismo bacteriano que cronometra la replicación del ADN. SeqA se une al origen de replicación, secuestrándolo y evitando así la metilación. Debido a que los orígenes de replicación hemimetilados están inactivos, este mecanismo limita la replicación del ADN a una vez por ciclo celular.
La expresión de ciertos genes, por ejemplo, los que codifican la expresión del pilus en E. coli , está regulada por la metilación de sitios GATC en la región promotora del operón del gen. Las condiciones ambientales de las células justo después de la replicación del ADN determinan si Dam no puede metilar una región proximal o distal a la región promotora. Una vez que se ha creado el patrón de metilación, la transcripción del gen pilus se bloquea en la posición de encendido o apagado hasta que el ADN se replica nuevamente. En E. coli , estos operones pili tienen funciones importantes en la virulencia de las infecciones del tracto urinario. Ha sido propuesto [ ¿ por quién? ] que los inhibidores de Dam pueden funcionar como antibióticos.
Por otro lado, la ADN citosina metilasa se dirige a los sitios CCAGG y CCTGG para metilar la citosina en la posición C5 (C meC (A/T) GG). La otra enzima metilasa, EcoKI, provoca la metilación de adeninas en las secuencias AAC(N 6 )GTGC y GCAC(N 6 )GTT.
En Clostridioides difficile , se demostró que la metilación del ADN en el motivo objetivo CAAAAA afecta la esporulación , un paso clave en la transmisión de enfermedades, así como la longitud celular, la formación de biopelículas y la colonización del huésped. [95]
La mayoría de las cepas utilizadas por los biólogos moleculares son derivados de E. coli K-12 y poseen tanto Dam como Dcm, pero hay cepas disponibles comercialmente que son dam-/dcm- (falta de actividad de cualquiera de las metilasas). De hecho, es posible desmetilar el ADN extraído de cepas dam+/dcm+ transformándolo en cepas dam-/dcm-. Esto ayudaría a digerir secuencias que no están siendo reconocidas por las enzimas de restricción sensibles a la metilación. [96] [97]
La enzima de restricción DpnI puede reconocer sitios 5'-GmeATC-3' y digerir el ADN metilado. Al ser un motivo tan corto, aparece con frecuencia en secuencias por casualidad y, como tal, su uso principal para los investigadores es degradar el ADN molde después de las PCR (los productos de PCR carecen de metilación, ya que no hay metilasas presentes en la reacción). De manera similar, algunas enzimas de restricción disponibles comercialmente son sensibles a la metilación en sus sitios de restricción afines y, como se mencionó anteriormente, deben usarse en ADN que se pasa a través de una cepa dam-/dcm- para permitir el corte.
La metilación del ADN se puede detectar mediante los siguientes ensayos utilizados actualmente en la investigación científica: [98]
Las regiones diferencialmente metiladas , que son regiones genómicas con diferentes estados de metilación entre múltiples muestras (tejidos, células, individuos u otras), se consideran posibles regiones funcionales involucradas en la regulación transcripcional de genes. La identificación de DMR entre múltiples tejidos (T-DMR) proporciona un estudio completo de las diferencias epigenéticas entre los tejidos humanos. [111] Por ejemplo, estas regiones metiladas que son exclusivas de un tejido en particular permiten a las personas diferenciar entre tipos de tejido, como el semen y el fluido vaginal. La investigación actual realizada por Lee et al. mostró que DACT1 y USP49 identificaron positivamente el semen al examinar los T-DMR. [112] El uso de T-DMR ha demostrado ser útil en la identificación de diversos fluidos corporales encontrados en la escena del crimen. Actualmente, los investigadores del campo forense están buscando nuevos T-DMR en genes para utilizarlos como marcadores en el análisis forense de ADN. Los DMR entre muestras cancerosas y normales (C-DMR) demuestran la metilación aberrante en los cánceres. [113] Es bien sabido que la metilación del ADN está asociada con la diferenciación y proliferación celular. [114] Muchos DMR se han encontrado en las etapas de desarrollo (D-DMR) [115] y en el progreso reprogramado (R-DMR). [116] Además, existen DMR intraindividuales (Intra-DMR) con cambios longitudinales en la metilación global del ADN junto con el aumento de la edad en un individuo determinado. [117] También hay DMR interindividuales (Inter-DMR) con diferentes patrones de metilación entre varios individuos. [118]
QDMR (regiones cuantitativas diferencialmente metiladas) es un enfoque cuantitativo para cuantificar la diferencia de metilación e identificar DMR a partir de perfiles de metilación de todo el genoma adaptando la entropía de Shannon. [119] La naturaleza libre de plataformas y especies de QDMR lo hace potencialmente aplicable a diversos datos de metilación. Este enfoque proporciona una herramienta eficaz para la identificación de alto rendimiento de las regiones funcionales implicadas en la regulación epigenética. QDMR se puede utilizar como una herramienta eficaz para la cuantificación de la diferencia de metilación y la identificación de DMR en múltiples muestras. [120]
Se ha demostrado que el análisis de conjuntos de genes (también conocido como análisis de rutas; herramientas que generalmente se realizan como DAVID, GoSeq o GSEA) está muy sesgado cuando se aplica a datos de metilación de alto rendimiento (por ejemplo, MeDIP-seq, MeDIP-ChIP, HELP-seq, etc. ), por lo que una amplia gama de estudios ha informado erróneamente sobre la hipermetilación de genes relacionados con el desarrollo y la diferenciación; Se ha sugerido que esto se puede corregir usando permutaciones de etiquetas de muestra o usando un modelo estadístico para controlar las diferencias en el número de sondas CpG/sitios CpG que se dirigen a cada gen. [121]
Las marcas de metilación del ADN (regiones genómicas con patrones de metilación específicos en un estado biológico específico, como tejido, tipo de célula o individuo) se consideran posibles regiones funcionales involucradas en la regulación transcripcional de genes. Aunque varios tipos de células humanas pueden tener el mismo genoma, estas células tienen diferentes metilomas. La identificación y caracterización sistemática de las marcas de metilación en todos los tipos de células son cruciales para comprender la compleja red reguladora para la determinación del destino celular. Hongbo Liu et al. propuso un marco basado en entropía denominado SMART para integrar los metilomas de secuenciación de bisulfito del genoma completo en 42 tejidos/células humanos e identificó 757,887 segmentos del genoma. [122] Casi el 75% de los segmentos mostraron una metilación uniforme en todos los tipos de células. Del 25% restante de los segmentos, identificaron marcas de hipo/hipermetilación específicas del tipo de célula que estaban específicamente hipo/hipermetiladas en una minoría de tipos de células utilizando un enfoque estadístico y presentaron un atlas de las marcas de metilación humanas. Un análisis más detallado reveló que las marcas de hipometilación específicas del tipo de célula se enriquecieron a través de H3K27ac y los sitios de unión del factor de transcripción de una manera específica del tipo de célula. En particular, observaron que las marcas de hipometilación específicas del tipo de célula están asociadas con los superpotenciadores específicos del tipo de célula que impulsan la expresión de genes de identidad celular. Este marco proporciona una anotación funcional complementaria del genoma humano y ayuda a dilucidar las características y funciones críticas de la hipometilación específica del tipo celular.
La herramienta de informe y análisis de metilación específica basada en entropía, denominada "SMART", que se centra en la integración de una gran cantidad de metilomas de ADN para la identificación de novo de marcas de metilación específicas del tipo de célula. La última versión de SMART se centra en tres funciones principales, incluida la identificación de novo de regiones metiladas diferencialmente (DMR) mediante segmentación del genoma, la identificación de DMR de regiones de interés predefinidas y la identificación de sitios CpG metilados diferencialmente. [123]
La metilación del ADN permite analizar varios tejidos en un solo ensayo, así como identificar pequeñas cantidades de líquido corporal mediante el uso de ADN extraído. Por lo general, los dos enfoques de metilación del ADN son enzimas de restricción sensibles a la metilación o tratamiento con bisulfito de sodio. [124] Las enzimas de restricción sensibles metiladas funcionan escindiendo CpG específicos, citosina y guanina separadas por un solo grupo fosfato, sitios de reconocimiento cuando el CpG está metilado. Por el contrario, las citosinas no metiladas se transforman en uracilo y, en el proceso, las citosinas metiladas permanecen metiladas. En particular, los perfiles de metilación pueden proporcionar información sobre cuándo y cómo se dejaron los fluidos corporales en la escena del crimen, identificar el tipo de fluido corporal y la edad, el sexo y las características fenotípicas aproximadas de los perpetradores. [125] Las investigaciones indican varios marcadores que se pueden utilizar para la metilación del ADN. Decidir qué marcador utilizar para un ensayo es uno de los primeros pasos en la identificación de fluidos corporales. En general, los marcadores se seleccionan examinando investigaciones previas realizadas. Los marcadores de identificación que se elijan deben dar un resultado positivo para un tipo de célula. Una porción del cromosoma que es un área de enfoque cuando se realiza la metilación del ADN son las regiones metiladas diferencialmente específicas de tejido, T-DMR. El grado de metilación de los T-DMR varía según el fluido corporal. [125] Un equipo de investigación desarrolló un sistema de marcadores doble. El primer marcador se metila sólo en el fluido objetivo mientras que el segundo se metila en el resto de los fluidos. [107] Por ejemplo, si el marcador de sangre venosa A no está metilado y el marcador de sangre venosa B está metilado en un líquido, indica la presencia únicamente de sangre venosa. Por el contrario, si el marcador de sangre venosa A está metilado y el marcador de sangre venosa B no está metilado en algún líquido, eso indica que la sangre venosa está en una mezcla de fluidos. Algunos ejemplos de marcadores de metilación del ADN son Mens1 (sangre menstrual), Spei1 (saliva) y Sperm2 (líquido seminal).
La metilación del ADN proporciona un medio relativamente bueno de sensibilidad a la hora de identificar y detectar fluidos corporales. En un estudio, sólo fueron necesarios diez nanogramos de muestra para determinar resultados exitosos. [126] La metilación del ADN proporciona un buen discernimiento de muestras mixtas, ya que involucra marcadores que dan señales de "encendido o apagado". La metilación del ADN no es inmune a las condiciones externas. Incluso en condiciones degradadas utilizando técnicas de metilación del ADN, los marcadores son lo suficientemente estables como para que todavía existan diferencias notables entre las muestras degradadas y las muestras de control. Específicamente, en un estudio se encontró que no había cambios notables en los patrones de metilación durante un período extenso de tiempo. [125]
La detección de la metilación del ADN en ADN libre y otros fluidos corporales se ha convertido recientemente en uno de los principales enfoques de la biopsia líquida . [127] En particular, la identificación de patrones específicos de tejido y de enfermedad permite la detección y el seguimiento no invasivos de enfermedades como el cáncer. [128] Si se compara con enfoques estrictamente genómicos para la biopsia líquida, el perfil de metilación del ADN ofrece una mayor cantidad de sitios CpG diferencialmente metilados y regiones diferencialmente metiladas (DMRS), lo que potencialmente mejora su sensibilidad. Los algoritmos de deconvolución de señales basados en la metilación del ADN se han aplicado con éxito al ADN libre de células y pueden designar el tejido de origen de cánceres de origen primario desconocido, rechazo de aloinjertos y resistencia a la terapia hormonal. [129]
La metilación del ADN también puede detectarse mediante modelos computacionales mediante algoritmos y métodos sofisticados. Los modelos computacionales pueden facilitar la elaboración de perfiles globales de la metilación del ADN en los cromosomas y, a menudo, dichos modelos son más rápidos y económicos de realizar que los ensayos biológicos. Estos modelos computacionales actualizados incluyen Bhasin, et al. , [130] Bock, et al ., [131] y Zheng, et al . [132] [133] Junto con el ensayo biológico, estos métodos facilitan enormemente el análisis de metilación del ADN.
Como resultado de este proceso, conocido como mutación puntual inducida por repetición (RIP), el genoma
de Neurospora
de tipo salvaje contiene una pequeña fracción de ADN metilado, y la mayoría del ADN permanece no metilado.
Aquí cuantificamos la metilación del ADN en diecisiete genomas eucariotas....