Las acidemias metilmalónicas , también llamadas acidurias metilmalónicas , [nota 1] son un grupo de trastornos metabólicos hereditarios que impiden que el cuerpo descomponga adecuadamente las proteínas y las grasas . [1] Esto conduce a una acumulación de un nivel tóxico de ácido metilmalónico en los líquidos y tejidos corporales. Debido al metabolismo alterado de los aminoácidos de cadena ramificada (AACR), se encuentran entre las acidemias orgánicas clásicas . [2]
Las acidemias metilmalónicas tienen diferentes diagnósticos, requisitos de tratamiento y pronósticos, que están determinados por la mutación genética específica que causa la forma hereditaria del trastorno. [3]
Los primeros síntomas pueden aparecer durante el primer día de vida o incluso en la edad adulta. [4] Los síntomas pueden variar de leves a potencialmente mortales. [1] Algunas formas pueden causar la muerte si no se diagnostican o no se tratan.
Las acidemias metilmalónicas se encuentran con la misma frecuencia en todos los límites étnicos. [5]
Dependiendo de los genes afectados y la mutación, los síntomas actuales pueden variar desde leves hasta potencialmente mortales.
Por lo general, las acidemias metilmalónicas no son evidentes al nacer, ya que los síntomas no se presentan hasta que se añaden proteínas a la dieta del bebé. [10] Debido a esto, los síntomas suelen manifestarse en cualquier momento durante el primer año de vida. [12] Sin embargo, también existen formas que solo desarrollan síntomas en la edad adulta. [4]
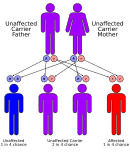
Las acidemias metilmalónicas tienen un patrón de herencia autosómico recesivo, lo que significa que el gen defectuoso se encuentra en un autosoma y se deben heredar dos copias del gen (una de cada progenitor) para verse afectado por el trastorno. Los padres de un niño con un trastorno autosómico recesivo son portadores de una copia del gen defectuoso, pero por lo general no se ven afectados por el trastorno. [ cita requerida ] La excepción es la acidemia metilmalónica y la homocistinuria, tipo cblX debido a variantes en el gen HCFC1 , que se hereda de manera recesiva ligada al cromosoma X. [13]
Los siguientes son los genotipos conocidos responsables de acidemias metilmalónicas aisladas : [13]
El tipo mut se puede dividir además en subtipos mut0 y mut-, donde mut0 se caracteriza por una falta total de metilmalonil-CoA mutasa y síntomas más graves, y mut- se caracteriza por una cantidad reducida de actividad de mutasa. [5]
Además, los siguientes genes también son responsables de las acidemias metilmalónicas: [13] [19]
Aunque no siempre se agrupa junto con las versiones hereditarias, una deficiencia nutricional grave de vitamina B12 también puede dar lugar a un síndrome con síntomas y tratamientos idénticos a los de las acidemias metilmalónicas genéticas. [37] La metilmalonil-CoA requiere vitamina B12 para formar succinil-CoA. Cuando la cantidad de B12 es insuficiente para la conversión del cofactor metilmalonil-CoA en succinil-CoA, la acumulación de metilmalonil-CoA no utilizado acaba provocando acidemia metilmalónica. Este diagnóstico se utiliza a menudo como indicador de deficiencia de vitamina B12 en suero . [ 38]

En las acidemias metilmalónicas, el cuerpo no puede descomponer adecuadamente:
Como resultado, el ácido metilmalónico se acumula en líquidos y tejidos. Las personas afectadas por este trastorno carecen de copias funcionales o niveles adecuados de una o más de las siguientes enzimas: [6] [11] [9]
A continuación se presentan brevemente:
Se estima que hasta un 60% de los casos aislados de acidemia metilmalónica son el resultado de un gen MMUT mutado que codifica la proteína metilmalonil-CoA mutasa. Esta enzima es responsable de la digestión de derivados potencialmente tóxicos de la descomposición de los aminoácidos y grasas mencionados anteriormente, principalmente colesterol [11] , en particular esta enzima convierte metilmalonil-CoA en succinil-CoA [40] . Sin esta enzima, el cuerpo no tiene medios para neutralizar o eliminar el ácido metilmalónico y los compuestos relacionados. La acción de esta enzima también puede verse paralizada por mutaciones en los genes MMAA , MMAB y MMADHC , cada uno de los cuales codifica una proteína necesaria para el funcionamiento normal de la metilmalonil-CoA mutasa [11] .
La CMAMMA es probablemente la forma más común de acidemia metilmalónica, pero rara vez se diagnostica debido a que no se detecta en los exámenes de detección de rutina de los recién nacidos , la amplia variedad de síntomas y, en algunos casos, los síntomas solo aparecen en la edad adulta. [9] [41] Las mutaciones del gen ACSF3 conducen a una deficiencia de la enzima mitocondrial acil-CoA sintetasa miembro 3 de la familia, lo que resulta en un aumento de los niveles de ácido metilmalónico y ácido malónico . [9] Dado que la tarea de la enzima es tanto la conversión de ácido metilmalónico en metilmalonil-CoA, para que pueda introducirse en el ciclo del ácido cítrico , como la conversión de ácido malónico en malonil-CoA , que es el primer paso en la síntesis de ácidos grasos mitocondriales (mtFASII). [42] [43] Por lo tanto, la CMAMMA puede definirse no solo como una acidemia orgánica , sino también como un defecto de la síntesis de ácidos grasos mitocondriales. [43]
Las mutaciones en el gen MCEE , que codifica la proteína metilmalonil-CoA epimerasa, también denominada metilmalonil racemasa, provocarán una forma mucho más leve del trastorno que la variante relacionada, la metilmalonil-CoA mutasa. Al igual que la mutasa, la epimerasa también actúa en la descomposición de las mismas sustancias, pero en un grado significativamente menor que la mutasa. [11] Las diferencias fenotípicas causadas por una deficiencia de la epimerasa en comparación con la mutasa son tan leves que existe un debate dentro de la comunidad médica sobre si esta deficiencia genética puede considerarse o no un trastorno o un síndrome clínico. [44]
También conocida como vitamina B 12, esta forma de cobalamina es un cofactor necesario de la metilmalonil-CoA mutasa. Incluso con una versión funcional de la enzima en niveles fisiológicamente normales, si la vitamina B 12 no puede convertirse en esta forma activa, la mutasa no podrá funcionar. [11]
Debido a la gravedad y rapidez con la que este trastorno puede causar complicaciones cuando no se diagnostica, la detección de la acidemia metilmalónica a menudo se incluye en el examen de detección del recién nacido . [10] [45] Para este propósito, se realiza una prueba de gota de sangre seca para el parámetro propionilcarnitina (C3) a la edad de 24 a 48 horas con el fin de detectar acidemias metilmalónicas aisladas. [13] [46]
Debido a los niveles normales de propionilcarnitina y a los síntomas asintomáticos en el momento de la prueba, la forma probablemente más común de acidemias metilmalónicas, CMAMMA, no se detecta en el cribado neonatal. [9] [13] El trastorno del desarrollo intelectual autosómico recesivo 69 también tiene niveles normales de propionilcarnitina. [13] La acidemia metilmalónica y la homocistinuria, tipo cblC, si son leves y de aparición tardía, también pueden no detectarse. [47]
Por lo general, el parámetro ácido metilmalónico solo se prueba si la propionilcarnitina estaba previamente elevada. [48]
Debido a la incapacidad de descomponer completamente los aminoácidos, el subproducto de la digestión de proteínas, el compuesto ácido metilmalónico, se encuentra en una concentración desproporcionada en la sangre y la orina de los afectados. Estos niveles anormales se utilizan como el principal criterio de diagnóstico para diagnosticar el trastorno. Este trastorno se determina típicamente mediante el uso de un análisis de orina o un panel sanguíneo . [12] También pueden estar presentes niveles elevados de amoníaco , glicina y cuerpos cetónicos en la sangre y la orina. [6]
Con la inclusión del parámetro ácido malónico , la CMAMMA se puede diferenciar rápidamente de la acidemia metilmalónica clásica calculando la relación entre ácido malónico y ácido metilmalónico, pero solo con valores del plasma sanguíneo y no de la orina. [49] La relación también se puede utilizar para determinar si se trata de CMAMMA (MA<MMA) o aciduria malónica (MA>MMA). [49] [7] [50]
La prueba se utiliza para un diagnóstico diferencial adicional y para comprobar la eficacia del tratamiento con vitamina B 12 , este último puede prevenir inyecciones innecesarias (de vitamina B 12 ) en niños. [51] Para una mejor comparabilidad e interpretación de los informes de los pacientes, Fowler et al han desarrollado un protocolo para una prueba estandarizada de respuesta a la vitamina B 12 ( in vivo ): [51]
Además, la respuesta a la vitamina B 12 también se puede probar in vitro . [13] [51] Puede proporcionar cierta información, pero no siempre puede predecir correctamente la respuesta a la vitamina B 12 in vivo . [13]
El diagnóstico final se confirma mediante pruebas genéticas moleculares si se encuentran variantes patogénicas bialélicas en el gen o los genes afectados. Debido a su alta sensibilidad, accesibilidad más fácil y no invasividad, las pruebas genéticas moleculares reemplazan los ensayos enzimáticos en la mayoría de los casos. [13] Existen paneles multigénicos específicos para la acidemia metilmalónica, pero los genes particulares analizados pueden variar de un laboratorio a otro y el médico puede personalizarlos según el fenotipo individual. [13] [19] Los métodos genéticos moleculares utilizados en estos paneles varían desde el análisis de secuencias , el análisis de deleción/duplicación y otras pruebas no basadas en secuenciación, pero en la gran mayoría de los casos el diagnóstico se realiza mediante análisis de secuencias. [13]
Además, son necesarias pruebas genéticas moleculares para comprobar diagnósticos sospechosos y corregir diagnósticos erróneos que puedan haber sido causados por síntomas y resultados engañosos de la prueba de respuesta a la vitamina B 12. [52]
La presencia de acidemia metilmalónica también puede sospecharse mediante el uso de una tomografía computarizada o una resonancia magnética , sin embargo, estas pruebas no son de ninguna manera específicas y requieren correlación clínica y metabólica. [10]
El tratamiento de todas las formas de esta enfermedad se basa principalmente en una dieta baja en proteínas y, según la variante del trastorno que padezca el individuo, en diversos suplementos dietéticos. Todas las variantes responden al isómero levo de la carnitina , ya que la descomposición inadecuada de las sustancias afectadas hace que los pacientes desarrollen una deficiencia de carnitina. La carnitina también ayuda a eliminar la acil-CoA, cuya acumulación es común en las dietas bajas en proteínas, al convertirla en acil-carnitina que puede excretarse en la orina. Algunas formas de acidemia metilmalonílica responden a la cobalamina, aunque los suplementos de cianocobalamina podrían resultar perjudiciales para algunas formas. [53] Si el individuo responde tanto a los suplementos de cobalamina como a los de carnitina, entonces puede ser posible que ingiera sustancias que incluyan pequeñas cantidades de los aminoácidos problemáticos isoleucina, treonina, metionina y valina sin provocar un ataque. [10] Se ha descubierto que las versiones CblA y cblB de la acidemia metilmalónica responden a la cobalamina.
Un tratamiento más extremo incluye el trasplante de riñón o hígado de un donante que no padezca la enfermedad. Los órganos extraños producirán una versión funcional de las enzimas defectuosas y digerirán el ácido metilmalónico, aunque todas las desventajas del trasplante de órganos son, por supuesto, aplicables en esta situación. [10] Hay evidencia que sugiere que el sistema nervioso central puede metabolizar el metilmalonil-CoA en un sistema aislado del resto del cuerpo. Si este es el caso, el trasplante puede no revertir los efectos neurológicos del ácido metilmalónico previos al trasplante o prevenir un mayor daño al cerebro por la acumulación continua. [54] [40]
Los estudios preclínicos de prueba de concepto en modelos animales han demostrado que la terapia con ARNm también es adecuada para enfermedades metabólicas raras, incluida la acidemia metilmalónica aislada. [55] [56] En este contexto, vale la pena mencionar el candidato a terapia para la acidemia metilmalónica mut mRNA-3705 de la empresa de biotecnología Moderna , que actualmente se encuentra en fase 1/2. [57]
Cabe mencionar aquí el fármaco de investigación molecular pequeño HST5040 de HemoShear Therapeutics para la aciduria metilmalónica y la aciduria propiónica, que actualmente se encuentra en fase 2. [58] [59] Se toma diariamente por vía oral o por sonda gástrica y está diseñado para prevenir la acumulación tóxica de propionil-CoA y metilmalonil-CoA o sus derivados desviando el CoA de la vía del propionil-CoA, lo que conduce a niveles normales o casi normales de estos metabolitos y potencialmente mejora el estado metabólico y las vías de producción de energía. [60] [59]
Otra pequeña molécula terapéutica en desarrollo es BBP-671 de BridgeBio Pharma para la neurodegeneración asociada a la pantotenato quinasa (PKAN), acidemia propiónica y metilmalónica, que actualmente se encuentra en fase 1. [61] Al activar alostéricamente las pantotenato quinasas , se espera que BBP-671 aumente la producción de CoA a partir de la vitamina B5 y , por lo tanto, normalice los procesos metabólicos. [62]
Aunque no existen etapas diferenciadas de la enfermedad, la acidemia metilmalónica es una afección progresiva; los síntomas de este trastorno se agravan a medida que aumenta la concentración de ácido metilmalónico. Si no se eliminan de la dieta las proteínas y grasas que la desencadenan, esta acumulación puede provocar daños irreparables en los riñones o el hígado y, finalmente, la muerte. [10]
El pronóstico varía según la gravedad de la enfermedad y la respuesta del individuo al tratamiento. El pronóstico suele ser mejor para quienes presentan variantes que responden a la cobalamina y no es prometedor para quienes padecen variantes que no responden a la cobalamina. [40] Las variantes más leves tienen una mayor frecuencia de aparición en la población que las más graves. [12] Incluso con la modificación de la dieta y la atención médica continua, puede que no sea posible prevenir el daño neurológico en quienes padecen una acidemia que no responde. [40] Sin un tratamiento o diagnóstico adecuados, no es raro que el primer ataque de acidemia sea mortal. [10]
A pesar de estos desafíos, desde que se identificó por primera vez en 1967, el tratamiento y la comprensión de la enfermedad han mejorado hasta el punto en que no es raro que incluso aquellas personas con formas no respondedoras de acidemia metilmalónica puedan llegar a la edad adulta e incluso gestar y dar a luz de manera segura. [54]
La primera acidemia metilmalónica fue caracterizada por Oberholzer et al. en 1967. [63] [54]
Hace tiempo que se ha informado de que el ácido metilmalónico puede tener efectos desastrosos en el sistema nervioso; sin embargo, nunca se ha determinado el mecanismo por el que esto ocurre. Publicada en 2015, la investigación realizada sobre los efectos del ácido metilmalónico en neuronas aisladas de ratas fetales en un entorno in vitro utilizando un grupo de control de neuronas tratadas con un ácido alternativo de pH similar . [64] Estas pruebas han sugerido que el ácido metilmalónico causa disminuciones en el tamaño celular y un aumento en la tasa de apoptosis celular de una manera dependiente de la concentración, observándose efectos más extremos en concentraciones más altas. [64] Además, el análisis de microarrays de estas neuronas tratadas también ha sugerido que, a nivel epigenético, el ácido metilmalónico altera la tasa de transcripción de 564 genes, incluidos en particular los implicados en las vías de señalización de apoptosis, p53 y MAPK . [64]
Como la conversión de metilmalonil-CoA a succinil-CoA tiene lugar dentro de las mitocondrias , desde hace tiempo se ha sospechado que la disfunción mitocondrial como resultado de la disminución de la función de la cadena de transporte de electrones es una característica de las acidemias metilmalónicas. Investigaciones recientes [¿ cuándo? ] han descubierto que en modelos de ratas las mitocondrias de ratas afectadas por el trastorno crecen hasta alcanzar un tamaño inusual, denominado megamitocondrias . Estas megamitocondrias también parecen tener estructuras internas deformadas y una pérdida de riqueza electrónica en su matriz . Estas megamitocondrias también mostraron signos de disminución de la función de la cadena respiratoria, en particular en el complejo respiratorio IV, que solo funcionó con una eficiencia de alrededor del 50%. Se identificaron cambios similares en las mitocondrias de una muestra de hígado extraída durante el trasplante de un niño de 5 años que sufría de acidemia metilmalónica de tipo mutado. [65]
Estudios de casos en varios pacientes que presentan acidemia metilmalónica mut0 no respondedora con una mutación específica designada p.P86L han sugerido la posibilidad de que exista una subdivisión adicional en la acidemia metilmalónica de tipo mut. [66] Aunque actualmente no está claro si esto se debe a la mutación específica o a la detección y el tratamiento tempranos, a pesar de la falta total de respuesta a los suplementos de cobalamina, estos individuos parecieron desarrollar una versión en gran medida benigna y casi completamente asintomática de la acidemia metilmalónica. [66] A pesar de mostrar constantemente ácido metilmalónico elevado en la sangre y la orina, estos individuos parecían en gran parte normales desde el punto de vista del desarrollo. [66]