El psoraleno (también llamado psoraleno ) es el compuesto original de una familia de compuestos orgánicos naturales conocidos como furanocumarinas lineales . Está relacionado estructuralmente con la cumarina por la adición de un anillo de furano fusionado y puede considerarse un derivado de la umbeliferona . El psoraleno se encuentra de forma natural en las semillas de Psoralea corylifolia , así como en la higuera común , el apio , el perejil , el palo de satín de las Indias Occidentales y en todos los frutos cítricos . Se utiliza ampliamente en el tratamiento PUVA (psoraleno + UVA ) para la psoriasis , el eczema , el vitíligo y el linfoma cutáneo de células T ; estas aplicaciones se realizan normalmente mediante el uso de medicamentos como el metoxaleno . Muchas furanocumarinas son extremadamente tóxicas para los peces y algunas se depositan en los arroyos de Indonesia para capturar peces. [1]
El psoraleno es un mutágeno y se utiliza con este fin en la investigación de biología molecular. El psoraleno se intercala en el ADN y, al exponerse a la radiación ultravioleta (UVA), puede formar monoaductos y enlaces cruzados covalentes entre cadenas (ICL) con timinas, preferentemente en los sitios 5'-TpA del genoma, lo que induce la apoptosis . La terapia con psoraleno más UVA (PUVA) se puede utilizar para tratar trastornos hiperproliferativos de la piel, como la psoriasis y ciertos tipos de cáncer de piel . [2] Desafortunadamente, el tratamiento con PUVA en sí mismo conduce a un mayor riesgo de cáncer de piel. [3]
Un uso importante del psoraleno es el tratamiento con PUVA para problemas de la piel como la psoriasis y, en menor medida, el eczema y el vitíligo . Esto aprovecha la alta capacidad de absorción de rayos UV del psoraleno. El psoraleno se aplica primero para sensibilizar la piel y luego se aplica luz UVA para tratar la afección. Los psoralenos también se utilizan en la fotoféresis , donde se mezclan con los leucocitos extraídos antes de aplicar la radiación UV.
A pesar de las propiedades fotocarcinogénicas del psoraleno, [4] [5] se utilizó como activador del bronceado en protectores solares hasta 1996. [6] Los psoralenos se utilizan en aceleradores del bronceado, porque el psoraleno aumenta la sensibilidad de la piel a la luz. Algunos pacientes han sufrido una pérdida grave de piel después de tomar el sol con activadores del bronceado que contienen psoralenos. [7] Los pacientes con un color de piel más claro sufren cuatro veces más las propiedades generadoras de melanoma de los psoralenos que aquellos con piel más oscura. [6] Los efectos secundarios a corto plazo de los psoralenos incluyen náuseas, vómitos, eritema, prurito, xerosis, dolor de piel debido al daño fototóxico del nervio dérmico y pueden causar neoplasias cutáneas y genitales. [8]
Un uso adicional de los psoralenos optimizados es la inactivación de patógenos en productos sanguíneos. El aminopsoraleno sintético, amotosalen HCl, se ha desarrollado para la inactivación de patógenos infecciosos (bacterias, virus, protozoos) en plaquetas y componentes sanguíneos plasmáticos preparados para el apoyo transfusional de pacientes. Antes del uso clínico, se han probado plaquetas tratadas con amotosalen y se ha descubierto que no son cancerígenas cuando se utiliza el modelo establecido de ratón con p53 knock out . [9] La tecnología se utiliza actualmente de forma rutinaria en ciertos centros de sangre europeos y ha sido aprobada recientemente en los EE. UU. [10] [11] [12] [13]
El psoraleno se intercala en la doble hélice del ADN, donde se encuentra en una posición ideal para formar uno o más aductos con bases de pirimidina adyacentes, preferentemente timina, tras la excitación de un fotón ultravioleta.
Se han empleado varios métodos fisicoquímicos para derivar constantes de unión para interacciones psoraleno-ADN. Clásicamente, dos cámaras de psoraleno y solución tamponada de ADN están divididas por una membrana semipermeable ; la afinidad del psoraleno por el ADN está directamente relacionada con la concentración del psoraleno en la cámara de ADN después del equilibrio. La solubilidad en agua es importante por dos razones: farmacocinética relacionada con la solubilidad del fármaco en la sangre y necesidad del uso de disolventes orgánicos (por ejemplo, DMSO ). Los psoralenos también pueden activarse mediante irradiación con luz UV de longitud de onda larga. Si bien la luz de rango UVA es el estándar clínico, la investigación de que la UVB es más eficiente en la formación de fotoaductos sugiere que su uso puede conducir a una mayor eficacia y tiempos de tratamiento más cortos. [14]
Los sitios fotoquímicamente reactivos en los psoralenos son los dobles enlaces carbono-carbono de tipo alqueno en el anillo de furano (el anillo de cinco miembros) y el anillo de pirona (el anillo de seis miembros). Cuando se intercalan apropiadamente adyacentes a una base de pirimidina, una reacción de fotocicloadición de cuatro centros puede conducir a la formación de cualquiera de los dos monoaductos de tipo ciclobutilo. Por lo general, los monoaductos del lado de furano se forman en una mayor proporción. El monoaducto de furano puede absorber un segundo fotón UVA que conduce a una segunda fotocicloadición de cuatro centros en el extremo de pirona de la molécula y, por lo tanto, a la formación de un diaducto o enlace cruzado. Los monoaductos de pirona no absorben en el rango de UVA y, por lo tanto, no pueden formar enlaces cruzados con una mayor irradiación UVA. [15]
Otra característica importante de esta clase de compuestos es su capacidad para generar oxígeno singlete , aunque este proceso está en competencia directa con la formación de aductos y puede ser una vía alternativa para la disipación de la energía del estado excitado.
La investigación sobre el psoraleno se ha centrado históricamente en las interacciones con el ADN y el ARN (en particular, la formación de ICL). Sin embargo, también se ha demostrado que el psoraleno bloquea la señalización del receptor ErbB2 que se sobreexpresa en ciertos tipos agresivos de cáncer de mama. [16] Un derivado sintético del bergapteno , el 5-(4-fenoxibutoxi)psoraleno, muestra ser prometedor como inmunosupresor al inhibir un canal de potasio específico . Su estructura evita la intercalación en el ADN y solo produce oxígeno singlete muy débilmente, lo que reduce en gran medida la toxicidad y mutagenicidad no deseadas in vivo . Esto tiene implicaciones para el tratamiento de varias enfermedades autoinmunes (por ejemplo, esclerosis múltiple , diabetes tipo 1 y artritis reumatoide ). [17] Si bien la modificación de la superficie celular y el bloqueo del canal iónico son dos mecanismos de acción recientemente descubiertos, aún queda mucha investigación por hacer.
La mayoría de las furanocumarinas pueden considerarse derivados del psoraleno o de la angelicina . El psoraleno y sus derivados suelen denominarse furanocumarinas lineales , llamadas así porque presentan una estructura química lineal. Las furanocumarinas lineales importantes incluyen la xantotoxina (también llamada metoxsaleno ), el bergapteno , la imperatorina y la nodakenetina .

La estructura del psoraleno se dedujo originalmente mediante la identificación de los productos de sus reacciones de degradación. Presenta las reacciones normales de la lactona de la cumarina, como la apertura del anillo por álcali para dar un ácido cumarínico o un derivado del ácido cumárico . El permanganato de potasio causa la oxidación del anillo de furano, mientras que otros métodos de oxidación producen ácido furan-2,3-carboxílico.
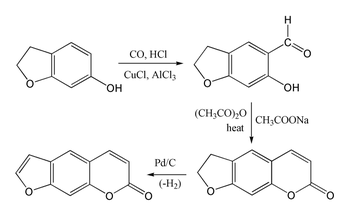
El psoraleno es difícil de sintetizar porque la umbeliferona sufre una sustitución en la posición 8 en lugar de en la posición 6 deseada. El benzofurano reacciona preferentemente en el anillo de furano en lugar de en el anillo de benceno . Sin embargo, el derivado 7-hidroxi del 2,3-dihidrobenzofurano (también llamado cumarano) sufre una sustitución en la posición 6 deseada, lo que permite la siguiente síntesis del sistema de cumarina mediante una reacción de Gattermann-Koch seguida de una condensación de Perkin utilizando anhídrido acético . La síntesis se completa luego mediante la deshidrogenación del anillo de cinco miembros para producir el anillo de furano.
El psoraleno se origina a partir de cumarinas en la vía del shikimato ; su biosíntesis se muestra en la figura siguiente. El anillo aromático en 6 se activa en posiciones orto al grupo hidroxilo y es alquilado por 5, un agente alquilante . El grupo dimetilalilo en 7 luego sufre ciclización con el grupo fenol para dar 8. Esta transformación es catalizada por una monooxigenasa17 dependiente del citocromo P-450 (psoraleno 5-monooxigenasa), y cofactores ( NADPH ) y oxígeno molecular. [18]
En la figura siguiente se muestra una vía biosintética en la que se forma el psoraleno. A continuación, una segunda enzima monooxigenasa dependiente de P-450 ( psoraleno sintasa ) escinde 10 (en forma de 11) de 8 para dar 1. Esta vía no implica ningún intermediario hidroxilado y se postula que la escisión se inicia mediante una reacción radical . [18]

Ficus carica (higo) es probablemente la fuente más abundante de psoralenos. También se encuentran en pequeñas cantidades en Ammi visnaga (bisnaga), Pastinaca sativa (chirivía), Petroselinum crispum ( perejil ), Levisticum officinale (apio de monte), Foeniculum vulgare (fruta, es decir, semillas de hinojo), Daucus carota (zanahoria), Psoralea. corylifolia (babchi), Apium graveolens (apio), aceite de bergamota ( bergapten , bergamotina ). [19]
El tratamiento con PUVA produce enlaces cruzados entre cadenas de ADN (ICL) y monoaductos. Los ICL introducidos por el psoraleno son altamente genotóxicos para las células que se replican activamente. El enlace covalente impide la progresión de la horquilla de replicación . Por lo tanto, es necesario desvincular el ICL antes de que se pueda reanudar la replicación. Los pasos iniciales de la reparación generalmente implican incisiones en una cadena parental en ambos lados del enlace cruzado. [20] Posteriormente, la reparación de la lesión puede ocurrir mediante un proceso preciso o impreciso.
El proceso preciso para reparar los enlaces cruzados es la reparación recombinacional homóloga (HRR). Esto implica reemplazar la información dañada utilizando la información intacta de otro cromosoma homólogo en la misma célula. Las células de Escherichia coli deficientes en HRR son altamente sensibles a PUVA en comparación con las células de tipo salvaje. [21] La HRR parece ser eficiente. En E. coli , aunque uno o dos enlaces cruzados no reparados son suficientes para inactivar una célula, una célula de tipo salvaje puede reparar y, por lo tanto, recuperarse de 53 a 71 enlaces cruzados de psoraleno. [21] En la levadura Saccharomyces cerevisiae , la HRR es una vía principal para eliminar con precisión los enlaces cruzados de psoraleno. [22] En la levadura de tipo salvaje, los eventos de recombinación asociados con la eliminación de enlaces cruzados por HRR son predominantemente eventos de conversión génica sin cruce . Los enlaces cruzados de psoraleno en el ADN del virus también parecen eliminarse mediante un proceso de reparación recombinacional como ocurre en las células infectadas por el virus SV40, [23] y en las células infectadas por el virus del herpes simple. [24]
Un proceso inexacto para reparar los enlaces cruzados de psoraleno parece emplear una ADN polimerasa para rellenar el hueco formado en la hebra con las dos incisiones. Este proceso es inexacto porque la hebra complementaria no incisa todavía retiene una parte del enlace cruzado y, por lo tanto, no puede servir como una plantilla adecuada para una síntesis de reparación precisa. La síntesis de reparación inexacta puede causar mutación . Los monoaductos de psoraleno en la hebra de ADN plantilla también pueden causar una derivación de replicación inexacta ( síntesis de translesión ) que puede conducir a la mutación. En el fago T4 , se encontró que el aumento de la mutación observado después del tratamiento con PUVA reflejaba la síntesis de translesión por la ADN polimerasa de tipo salvaje, probablemente debido a una capacidad de lectura de pruebas imperfecta.
Los psoralenos pueden reticular reversiblemente las dobles hélices de los ácidos nucleicos y, por lo tanto, se han utilizado ampliamente para el análisis de interacciones y estructuras tanto del ADN como del ARN. [25] [26]