
Los microtúbulos son polímeros de tubulina que forman parte del citoesqueleto y proporcionan estructura y forma a las células eucariotas . Los microtúbulos pueden tener una longitud de hasta 50 micrómetros , un ancho de hasta 23 a 27 nm [2] y un diámetro interno de entre 11 y 15 nm. [3] Se forman por la polimerización de un dímero de dos proteínas globulares , la tubulina alfa y beta, en protofilamentos que luego pueden asociarse lateralmente para formar un tubo hueco, el microtúbulo. [4] La forma más común de un microtúbulo consta de 13 protofilamentos en disposición tubular.

Los microtúbulos desempeñan un papel importante en varios procesos celulares . Están involucrados en el mantenimiento de la estructura de la célula y, junto con los microfilamentos y filamentos intermedios , forman el citoesqueleto. También conforman la estructura interna de los cilios y flagelos . Proporcionan plataformas para el transporte intracelular y están involucrados en una variedad de procesos celulares, incluido el movimiento de vesículas secretoras , orgánulos y conjuntos macromoleculares intracelulares. [5] También están involucrados en la división celular (por mitosis y meiosis ) y son los principales componentes de los husos mitóticos , que se utilizan para separar los cromosomas eucariotas .
Los microtúbulos son nucleados y organizados por centros organizadores de microtúbulos , como el centrosoma, que se encuentra en el centro de muchas células animales, o los cuerpos basales de los cilios y flagelos, o los cuerpos polares del huso , que se encuentran en la mayoría de los hongos.
Hay muchas proteínas que se unen a los microtúbulos, incluidas las proteínas motoras dineína y kinesina , proteínas que cortan microtúbulos como la katanina y otras proteínas importantes para regular la dinámica de los microtúbulos. [6] Recientemente, se ha encontrado una proteína similar a la actina en la bacteria grampositiva Bacillus thuringiensis , que forma una estructura similar a un microtúbulo llamada nanotúbulo, involucrada en la segregación de plásmidos . [7] Otros microtúbulos bacterianos tienen un anillo de cinco protofilamentos.
Los primeros microscopistas, como Leeuwenhoek (1677), observaron procesos mediados por tubulina y microtúbulos, como la locomoción celular . Sin embargo, la naturaleza fibrosa de los flagelos y otras estructuras se descubrió dos siglos después, con microscopios ópticos mejorados , y se confirmó en el siglo XX con el microscopio electrónico y estudios bioquímicos. [8]
Los ensayos in vitro para las proteínas motoras de los microtúbulos, como la dineína y la kinesina, se investigan marcando con fluorescencia un microtúbulo y fijando el microtúbulo o las proteínas motoras a un portaobjetos de microscopio, para luego visualizar el portaobjetos con microscopía mejorada con vídeo para registrar el recorrido de las proteínas motoras. Esto permite el movimiento de las proteínas motoras a lo largo del microtúbulo o el microtúbulo moviéndose a través de las proteínas motoras. [9] En consecuencia, algunos procesos de los microtúbulos se pueden determinar mediante quimógrafo . [10]

En los eucariotas , los microtúbulos son cilindros largos y huecos compuestos de dímeros de α y β-tubulina polimerizados . [12] El espacio interior de los cilindros huecos de microtúbulos se denomina lumen. Las subunidades de α y β-tubulina son aproximadamente un 50 % idénticas a nivel de aminoácidos, y ambas tienen un peso molecular de aproximadamente 50 kDa. [13] [14]
Estos dímeros de α/β-tubulina se polimerizan de extremo a extremo en protofilamentos lineales que se asocian lateralmente para formar un único microtúbulo, que luego puede extenderse mediante la adición de más dímeros de α/β-tubulina. Por lo general, los microtúbulos se forman mediante la asociación paralela de trece protofilamentos, aunque se han observado microtúbulos compuestos por menos o más protofilamentos en varias especies [15] así como in vitro . [16]
Los microtúbulos tienen una polaridad distinta que es fundamental para su función biológica. La tubulina se polimeriza de extremo a extremo, y las subunidades β de un dímero de tubulina entran en contacto con las subunidades α del siguiente dímero. Por lo tanto, en un protofilamento, un extremo tendrá las subunidades α expuestas mientras que el otro extremo tendrá las subunidades β expuestas. Estos extremos se denominan extremos (−) y (+), respectivamente. Los protofilamentos se agrupan en paralelo entre sí con la misma polaridad, por lo que, en un microtúbulo, hay un extremo, el extremo (+), con solo subunidades β expuestas, mientras que el otro extremo, el extremo (−), tiene solo subunidades α expuestas. Si bien la elongación de los microtúbulos puede ocurrir tanto en el extremo (+) como en el (−), es significativamente más rápida en el extremo (+). [17]
La asociación lateral de los protofilamentos genera una estructura pseudohelicoidal, con una vuelta de la hélice que contiene 13 dímeros de tubulina, cada uno de un protofilamento diferente. En la arquitectura "13-3" más común, el 13.º dímero de tubulina interactúa con el siguiente dímero de tubulina con un desplazamiento vertical de 3 monómeros de tubulina debido a la helicidad de la vuelta. Hay otras arquitecturas alternativas, como 11-3, 12-3, 14-3, 15-4 o 16-4, que se han detectado en una incidencia mucho menor. [18] Los microtúbulos también pueden transformarse en otras formas, como filamentos helicoidales, que se observan en organismos protistas como los foraminíferos . [19] Hay dos tipos distintos de interacciones que pueden ocurrir entre las subunidades de los protofilamentos laterales dentro del microtúbulo llamados redes de tipo A y tipo B. En la red de tipo A, las asociaciones laterales de los protofilamentos se producen entre subunidades de α y β-tubulina adyacentes (es decir, una subunidad de α-tubulina de un protofilamento interactúa con una subunidad de β-tubulina de un protofilamento adyacente). En la red de tipo B, las subunidades de α y β-tubulina de un protofilamento interactúan con las subunidades de α y β-tubulina de un protofilamento adyacente, respectivamente. Los estudios experimentales han demostrado que la red de tipo B es la disposición primaria dentro de los microtúbulos. Sin embargo, en la mayoría de los microtúbulos hay una costura en la que las subunidades de tubulina interactúan α-β. [20]
La secuencia y la composición exacta de las moléculas durante la formación de los microtúbulos se pueden resumir de la siguiente manera: una β-tubulina se une en el contexto de un enlace covalente inexistente con una α-tubulina, que en forma conectada son un heterodímero, ya que consisten en dos polipéptidos diferentes (β-tubulina y α-tubulina). Entonces, después de formarse los heterodímeros, se unen para formar largas cadenas que se elevan figurativamente en una dirección (por ejemplo, hacia arriba). Estos heterodímeros, que están conectados en una determinada dirección, forman protofilamentos. Estas largas cadenas (protofilamentos) ahora se acumulan gradualmente una al lado de la otra de modo que se forma una estructura similar a un tubo, que tiene un lumen típico de un tubo. En consecuencia, en su mayoría 13 protofilamentos forman la pared exterior de los microtúbulos. Los heterodímeros constan de un extremo positivo y negativo, siendo la alfa-tubulina formando el extremo negativo y la beta-tubulina el extremo positivo. Debido a que los heterodímeros se apilan uno sobre el otro, siempre hay un extremo negativo y uno positivo. Los microtúbulos crecen mediante la adición de heterodímeros en el extremo positivo.
Algunas especies de Prosthecobacter también contienen microtúbulos. La estructura de estos microtúbulos bacterianos es similar a la de los microtúbulos eucariotas, y consiste en un tubo hueco de protofilamentos ensamblados a partir de heterodímeros de tubulina bacteriana A (BtubA) y tubulina bacteriana B (BtubB). Tanto BtubA como BtubB comparten características de la α- y la β- tubulina . A diferencia de los microtúbulos eucariotas, los microtúbulos bacterianos no requieren chaperonas para plegarse. [21] A diferencia de los 13 protofilamentos de los microtúbulos eucariotas, los microtúbulos bacterianos comprenden solo cinco. [22]
Los microtúbulos son parte del citoesqueleto , una red estructural dentro del citoplasma de la célula . Las funciones del citoesqueleto de microtúbulos incluyen soporte mecánico, organización del citoplasma, transporte, motilidad y segregación cromosómica. En las neuronas en desarrollo, los microtúbulos se conocen como neurotúbulos , [23] y pueden modular la dinámica de la actina , otro componente del citoesqueleto. [24] Un microtúbulo es capaz de crecer y encogerse para generar fuerza, y hay proteínas motoras que permiten que los orgánulos y otros componentes celulares se transporten a lo largo de un microtúbulo. Esta combinación de funciones hace que los microtúbulos sean importantes para organizar y mover los constituyentes intracelulares.
La organización de los microtúbulos en la célula es específica del tipo celular. En los epitelios , los extremos negativos del polímero de microtúbulos están anclados cerca del sitio de contacto célula-célula y organizados a lo largo del eje apical-basal. Después de la nucleación, los extremos negativos se liberan y luego se vuelven a anclar en la periferia mediante factores como la nineína y PLEKHA7 . [25] De esta manera, pueden facilitar el transporte de proteínas, vesículas y orgánulos a lo largo del eje apical-basal de la célula. En los fibroblastos y otros tipos de células mesenquimales, los microtúbulos están anclados en el centrosoma y se irradian con sus extremos positivos hacia afuera, hacia la periferia celular (como se muestra en la primera figura). En estas células, los microtúbulos desempeñan papeles importantes en la migración celular. Además, la polaridad de los microtúbulos es accionada por proteínas motoras, que organizan muchos componentes de la célula, incluido el retículo endoplasmático y el aparato de Golgi .

La nucleación es el evento que inicia la formación de microtúbulos a partir del dímero de tubulina. Los microtúbulos suelen estar nucleados y organizados por orgánulos llamados centros organizadores de microtúbulos (MTOC). Dentro de los MTOC hay otro tipo de tubulina, la γ-tubulina, que es distinta de las subunidades α y β de los propios microtúbulos. La γ-tubulina se combina con varias otras proteínas asociadas para formar una estructura similar a una arandela de bloqueo conocida como el "complejo de anillo de γ-tubulina" (γ-TuRC). Este complejo actúa como una plantilla para que los dímeros α/β-tubulina comiencen la polimerización; actúa como una tapa del extremo (−) mientras el crecimiento de los microtúbulos continúa alejándose del MTOC en la dirección (+). [26]
El centrosoma es el MTOC primario de la mayoría de los tipos de células. Sin embargo, los microtúbulos también pueden nuclearse desde otros sitios. Por ejemplo, los cilios y los flagelos tienen MTOC en su base, denominados cuerpos basales . Además, el trabajo del grupo de Kaverina en Vanderbilt, así como otros, sugiere que el aparato de Golgi puede servir como una plataforma importante para la nucleación de microtúbulos. [27] Debido a que la nucleación desde el centrosoma es inherentemente simétrica, la nucleación de microtúbulos asociada al Golgi puede permitir que la célula establezca una asimetría en la red de microtúbulos. En estudios recientes, el grupo Vale en la UCSF identificó el complejo proteico augmin como un factor crítico para la generación de microtúbulos basada en el huso dependiente del centrosoma. Se ha demostrado que interactúa con γ-TuRC y aumenta la densidad de microtúbulos alrededor del origen del huso mitótico. [28]
Algunos tipos de células, como las células vegetales, no contienen MTOC bien definidos. En estas células, los microtúbulos se nuclean a partir de sitios discretos en el citoplasma. Otros tipos de células, como los parásitos tripanosomátidos , tienen un MTOC, pero este se encuentra permanentemente en la base de un flagelo. En este caso, la nucleación de los microtúbulos para funciones estructurales y para la generación del huso mitótico no se produce a partir de un MTOC canónico similar al centriolo.
Después del evento de nucleación inicial, se deben agregar monómeros de tubulina al polímero en crecimiento. El proceso de agregar o eliminar monómeros depende de la concentración de dímeros de αβ-tubulina en solución en relación con la concentración crítica, que es la concentración de dímeros en estado estacionario en la que ya no hay ensamblaje o desensamblaje neto en el extremo del microtúbulo. Si la concentración de dímeros es mayor que la concentración crítica, el microtúbulo se polimerizará y crecerá. Si la concentración es menor que la concentración crítica, la longitud del microtúbulo disminuirá. [29]
La inestabilidad dinámica se refiere a la coexistencia de ensamblaje y desensamblaje en los extremos de un microtúbulo. El microtúbulo puede cambiar dinámicamente entre fases de crecimiento y contracción en esta región. [30] Los dímeros de tubulina pueden unir dos moléculas de GTP, una de las cuales puede hidrolizarse después del ensamblaje. Durante la polimerización, los dímeros de tubulina están en el estado unido a GTP . [12] El GTP unido a α-tubulina es estable y desempeña una función estructural en este estado unido. Sin embargo, el GTP unido a β-tubulina puede hidrolizarse a GDP poco después del ensamblaje. Las propiedades de ensamblaje de GDP-tubulina son diferentes de las de GTP-tubulina, ya que GDP-tubulina es más propensa a la despolimerización. [31] Una subunidad de tubulina unida a GDP en la punta de un microtúbulo tenderá a caerse, aunque una tubulina unida a GDP en el medio de un microtúbulo no puede salir espontáneamente del polímero. Dado que la tubulina se añade al extremo del microtúbulo en el estado unido a GTP, se propone que exista una capa de tubulina unida a GTP en la punta del microtúbulo, que lo protege del desmontaje. Cuando la hidrólisis alcanza la punta del microtúbulo, comienza una rápida despolimerización y contracción. Este cambio de crecimiento a contracción se denomina catástrofe. La tubulina unida a GTP puede comenzar a añadirse a la punta del microtúbulo nuevamente, proporcionando una nueva capa y protegiendo al microtúbulo de la contracción. Esto se conoce como "rescate". [32]
En 1986, Marc Kirschner y Tim Mitchison propusieron que los microtúbulos utilizan sus propiedades dinámicas de crecimiento y contracción en sus extremos positivos para explorar el espacio tridimensional de la célula. Los extremos positivos que encuentran cinetocoros o sitios de polaridad quedan capturados y ya no muestran crecimiento ni contracción. A diferencia de los microtúbulos dinámicos normales, que tienen una vida media de 5 a 10 minutos, los microtúbulos capturados pueden durar horas. Esta idea se conoce comúnmente como el modelo de "búsqueda y captura". [33] De hecho, el trabajo realizado desde entonces ha validado en gran medida esta idea. En el cinetocoro, se ha demostrado que una variedad de complejos capturan los extremos (+) de los microtúbulos. [34] Además, también se ha descrito una actividad de protección del extremo (+) para los microtúbulos en interfase. [35] Esta última actividad está mediada por forminas , [36] la proteína de poliposis adenomatosa coli y EB1 , [37] una proteína que recorre los extremos positivos en crecimiento de los microtúbulos.

Aunque la mayoría de los microtúbulos tienen una vida media de 5 a 10 minutos, ciertos microtúbulos pueden permanecer estables durante horas. [35] Estos microtúbulos estabilizados acumulan modificaciones postraduccionales en sus subunidades de tubulina por la acción de enzimas unidas a los microtúbulos. [38] [39] Sin embargo, una vez que el microtúbulo se despolimeriza, la mayoría de estas modificaciones son revertidas rápidamente por enzimas solubles. Dado que la mayoría de las reacciones de modificación son lentas mientras que sus reacciones inversas son rápidas, la tubulina modificada solo se detecta en microtúbulos estables de larga vida. La mayoría de estas modificaciones ocurren en la región C-terminal de la alfa-tubulina. Esta región, que es rica en glutamato cargado negativamente, forma colas relativamente desestructuradas que se proyectan desde el microtúbulo y forman contactos con motores. Por lo tanto, se cree que las modificaciones de la tubulina regulan la interacción de los motores con el microtúbulo. Dado que estos microtúbulos modificados estables suelen estar orientados hacia el sitio de polaridad celular en las células en interfase, este subconjunto de microtúbulos modificados proporciona una ruta especializada que ayuda a llevar vesículas a estas zonas polarizadas. Estas modificaciones incluyen:
También se sabe que la tubulina está fosforilada , ubiquitinada , sumoilada y palmitoilada . [38]
Una amplia variedad de fármacos pueden unirse a la tubulina y modificar sus propiedades de ensamblaje. Estos fármacos pueden tener un efecto en concentraciones intracelulares mucho más bajas que la tubulina. Esta interferencia con la dinámica de los microtúbulos puede tener el efecto de detener el ciclo celular de una célula y puede conducir a la muerte celular programada o apoptosis . Sin embargo, hay datos que sugieren que la interferencia de la dinámica de los microtúbulos es insuficiente para bloquear las células que experimentan mitosis. [46] Estos estudios han demostrado que la supresión de la dinámica se produce en concentraciones inferiores a las necesarias para bloquear la mitosis. Se ha demostrado que la supresión de la dinámica de los microtúbulos por mutaciones de la tubulina o por tratamiento farmacológico inhibe la migración celular. [47] Tanto los estabilizadores como los desestabilizadores de los microtúbulos pueden suprimir la dinámica de los microtúbulos.
Los medicamentos que pueden alterar la dinámica de los microtúbulos incluyen:
Los taxanos (solos o en combinación con derivados del platino (carboplatino) o gemcitabina) se utilizan contra neoplasias malignas de mama y ginecológicas, carcinomas de células escamosas (cánceres de cabeza y cuello, algunos cánceres de pulmón), etc.
Se ha informado que la expresión de β3-tubulina altera las respuestas celulares a la supresión inducida por fármacos de la dinámica de los microtúbulos. En general, la dinámica normalmente se suprime con concentraciones bajas y subtóxicas de fármacos dirigidos a los microtúbulos que también inhiben la migración celular. Sin embargo, la incorporación de β3-tubulina a los microtúbulos aumenta la concentración de fármaco que se necesita para suprimir la dinámica e inhibir la migración celular. Por lo tanto, los tumores que expresan β3-tubulina no solo son resistentes a los efectos citotóxicos de los fármacos dirigidos a los microtúbulos, sino también a su capacidad para suprimir la metástasis tumoral. [48] Además, la expresión de β3-tubulina también contrarresta la capacidad de estos fármacos para inhibir la angiogénesis, que normalmente es otra faceta importante de su acción. [49]
Los polímeros de microtúbulos son extremadamente sensibles a diversos efectos ambientales. Niveles muy bajos de calcio libre pueden desestabilizar los microtúbulos y esto impidió que los primeros investigadores estudiaran el polímero in vitro. [12] Las temperaturas frías también provocan una rápida despolimerización de los microtúbulos. Por el contrario, el agua pesada promueve la estabilidad del polímero de microtúbulos. [50]
Se ha demostrado que las MAP desempeñan un papel crucial en la regulación de la dinámica de los microtúbulos in vivo . Las tasas de polimerización, despolimerización y catástrofe de los microtúbulos varían según las proteínas asociadas a los microtúbulos (MAP) presentes. Las MAP identificadas originalmente en el tejido cerebral se pueden clasificar en dos grupos según su peso molecular. Esta primera clase comprende las MAP con un peso molecular inferior a 55-62 kDa y se denominan proteínas τ (tau) . In vitro , se ha demostrado que las proteínas tau se unen directamente a los microtúbulos, promueven la nucleación y previenen el desmontaje, e inducen la formación de matrices paralelas. [51] Además, también se ha demostrado que las proteínas tau estabilizan los microtúbulos en los axones y se las ha implicado en la enfermedad de Alzheimer. [52] La segunda clase está compuesta por MAPs con un peso molecular de 200-1000 kDa, de las cuales se conocen cuatro tipos: MAP-1, MAP-2 , MAP-3 y MAP-4 . Las proteínas MAP-1 consisten en un conjunto de tres proteínas diferentes: A , B y C. La proteína C juega un papel importante en el transporte retrógrado de vesículas y también es conocida como dineína citoplasmática . Las proteínas MAP-2 se localizan en las dendritas y en el cuerpo de las neuronas, donde se unen con otros filamentos del citoesqueleto. Las proteínas MAP-4 se encuentran en la mayoría de las células y estabilizan los microtúbulos. Además de las MAPs que tienen un efecto estabilizador sobre la estructura de los microtúbulos, otras MAPs pueden tener un efecto desestabilizador ya sea por escisión o por inducción de la despolimerización de los microtúbulos. Se ha observado que tres proteínas llamadas katanina , espástina y fidgetina regulan la cantidad y la longitud de los microtúbulos a través de sus actividades desestabilizadoras. Además, se prevé que la proteína similar a CRACD se localice en los microtúbulos. [53]
Los MAP son determinantes de diferentes formas citoesqueléticas de axones y dendritas , y los microtúbulos están más separados en las dendritas [54].
Las proteínas de seguimiento del extremo positivo son proteínas MAP que se unen a las puntas de los microtúbulos en crecimiento y desempeñan un papel importante en la regulación de la dinámica de los microtúbulos. Por ejemplo, se ha observado que las +TIP participan en las interacciones de los microtúbulos con los cromosomas durante la mitosis. La primera MAP que se identificó como una +TIP fue CLIP1 70 (proteína de enlace citoplasmática), que ha demostrado desempeñar un papel en los eventos de rescate de la despolimerización de los microtúbulos. Otros ejemplos de +TIP incluyen EB1 , EB2 , EB3 , p150Glued , Dynamitin , Lis1 , CLIP115 , CLASP1 y CLASP2 . [ cita requerida ]
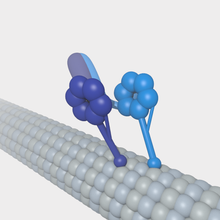

Los microtúbulos pueden actuar como sustratos para las proteínas motoras que participan en funciones celulares importantes, como el tráfico de vesículas y la división celular. A diferencia de otras proteínas asociadas a los microtúbulos, las proteínas motoras utilizan la energía de la hidrólisis del ATP para generar trabajo mecánico que mueve la proteína a lo largo del sustrato. Las principales proteínas motoras que interactúan con los microtúbulos son la kinesina , que suele moverse hacia el extremo (+) del microtúbulo, y la dineína , que se mueve hacia el extremo (−).
Algunos virus (incluidos los retrovirus , los herpesvirus , los parvovirus y los adenovirus ) que requieren acceso al núcleo para replicar sus genomas se unen a proteínas motoras.

El centrosoma es el principal centro organizador de microtúbulos (MTOC ) de la célula durante la mitosis. Cada centrosoma está formado por dos cilindros llamados centriolos , orientados en ángulo recto entre sí. El centriolo está formado por 9 microtúbulos principales, cada uno de los cuales tiene dos microtúbulos parciales unidos a él. Cada centriolo tiene aproximadamente 400 nm de largo y alrededor de 200 nm de circunferencia. [56]
El centrosoma es fundamental para la mitosis, ya que la mayoría de los microtúbulos que participan en el proceso se originan en él. Los extremos negativos de cada microtúbulo comienzan en el centrosoma, mientras que los extremos positivos se extienden en todas direcciones. Por lo tanto, el centrosoma también es importante para mantener la polaridad de los microtúbulos durante la mitosis. [57]
La mayoría de las células tienen un solo centrosoma durante la mayor parte de su ciclo celular; sin embargo, justo antes de la mitosis, el centrosoma se duplica y la célula contiene dos centrosomas. [58] Algunos de los microtúbulos que irradian desde el centrosoma crecen directamente alejándose del centrosoma hermano. Estos microtúbulos se denominan microtúbulos astrales. Con la ayuda de estos microtúbulos astrales, los centrosomas se alejan entre sí hacia lados opuestos de la célula. Una vez allí, pueden comenzar a formarse otros tipos de microtúbulos necesarios para la mitosis, incluidos los microtúbulos interpolares y las fibras K. [59]
Una nota final importante sobre los centrosomas y microtúbulos durante la mitosis es que, si bien el centrosoma es el MTOC para los microtúbulos necesarios para la mitosis, las investigaciones han demostrado que una vez que los microtúbulos se forman y están en el lugar correcto, los centrosomas en sí no son necesarios para que se produzca la mitosis. [60]
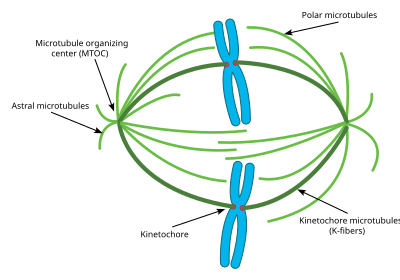
Los microtúbulos astrales son una subclase de microtúbulos que solo existen durante y alrededor de la mitosis. Se originan en el centrosoma, pero no interactúan con los cromosomas, los cinetocoros ni con los microtúbulos que se originan en el otro centrosoma. [61] En cambio, sus microtúbulos irradian hacia la membrana celular. Una vez allí, interactúan con proteínas motoras específicas que crean una fuerza que tira de los microtúbulos, y por lo tanto de todo el centrosoma, hacia la membrana celular. Como se dijo anteriormente, esto ayuda a los centrosomas a orientarse alejándose unos de otros en la célula. Sin embargo, estos microtúbulos astrales no interactúan con el huso mitótico en sí. Los experimentos han demostrado que sin estos microtúbulos astrales, el huso mitótico puede formarse, sin embargo, su orientación en la célula no siempre es correcta y, por lo tanto, la mitosis no se produce de manera tan efectiva. [62] Otra función clave de los microtúbulos astrales es ayudar en la citocinesis. Los microtúbulos astrales interactúan con las proteínas motoras de la membrana celular para separar el huso y toda la célula una vez que se han replicado los cromosomas.
Los microtúbulos interpolares/polares son una clase de microtúbulos que también irradian desde el centrosoma durante la mitosis. Estos microtúbulos irradian hacia el huso mitótico, a diferencia de los microtúbulos astrales. Los microtúbulos interpolares son la subclase de microtúbulos más abundante y dinámica durante la mitosis. Alrededor del 95 por ciento de los microtúbulos en el huso mitótico pueden caracterizarse como interpolares. Además, la vida media de estos microtúbulos es extremadamente corta, ya que es de menos de un minuto. [63] Los microtúbulos interpolares que no se adhieren a los cinetocoros pueden ayudar en la congregación de cromosomas a través de la interacción lateral con los cinetocoros. [64]
Las fibras K/microtúbulos cinetocóricos son la tercera subclase importante de microtúbulos mitóticos. Estos microtúbulos forman conexiones directas con los cinetocoros en el huso mitótico. Cada fibra K está compuesta por 20-40 microtúbulos paralelos, que forman un tubo fuerte que está unido por un extremo al centrosoma y por el otro al cinetocoro, ubicado en el centro de cada cromosoma. Dado que cada centrosoma tiene una fibra K que se conecta a cada par de cromosomas, los cromosomas quedan atados en el medio del huso mitótico por las fibras K. Las fibras K tienen una vida media mucho más larga que los microtúbulos interpolares, de entre 4 y 8 minutos. [65] Durante el final de las mitosis, los microtúbulos que forman cada fibra K comienzan a disociarse, acortando así las fibras K. A medida que las fibras K se acortan, los cromosomas del par se separan justo antes de la citocinesis. Anteriormente, algunos investigadores creían que las fibras K se formaban en su extremo negativo y se originaban en el centrosoma, al igual que otros microtúbulos; sin embargo, nuevas investigaciones han señalado un mecanismo diferente. En este nuevo mecanismo, las fibras K se estabilizan inicialmente en su extremo positivo por los cinetocoros y crecen desde allí. El extremo negativo de estas fibras K finalmente se conecta a un microtúbulo interpolar existente y, finalmente, se conecta al centrosoma de esta manera. [66]
La mayoría de los microtúbulos que forman el huso mitótico se originan en el centrosoma. Originalmente se pensaba que todos estos microtúbulos se originaban en el centrosoma a través de un método llamado búsqueda y captura, descrito con más detalle en una sección anterior, sin embargo, nuevas investigaciones han demostrado que existen medios adicionales de nucleación de microtúbulos durante la mitosis. Uno de los medios adicionales más importantes de nucleación de microtúbulos es la vía RAN-GTP. RAN-GTP se asocia con la cromatina durante la mitosis para crear un gradiente que permite la nucleación local de microtúbulos cerca de los cromosomas. Además, una segunda vía conocida como el complejo augmina/HAUS (algunos organismos utilizan el complejo augmina más estudiado, mientras que otros, como los humanos, utilizan un complejo análogo llamado HAUS) actúa como un medio adicional de nucleación de microtúbulos en el huso mitótico. [66]
Los extremos positivos de los microtúbulos suelen estar localizados en estructuras particulares. En las células en interfase polarizadas , los microtúbulos están orientados desproporcionadamente desde el MTOC hacia el sitio de polaridad, como el borde delantero de los fibroblastos migrantes . Se cree que esta configuración ayuda a transportar vesículas unidas a microtúbulos desde el Golgi hasta el sitio de polaridad.
La inestabilidad dinámica de los microtúbulos también es necesaria para la migración de la mayoría de las células de mamíferos que se arrastran. [67] Los microtúbulos dinámicos regulan los niveles de proteínas G clave como RhoA [68] y Rac1 , [69] que regulan la contractilidad celular y la propagación celular. Los microtúbulos dinámicos también son necesarios para desencadenar el desmontaje de la adhesión focal , que es necesario para la migración. [70] Se ha descubierto que los microtúbulos actúan como "puntales" que contrarrestan las fuerzas contráctiles que se necesitan para la retracción del borde posterior durante el movimiento celular. Cuando los microtúbulos en el borde posterior de la célula son dinámicos, pueden remodelarse para permitir la retracción. Cuando se suprime la dinámica, los microtúbulos no pueden remodelarse y, por lo tanto, se oponen a las fuerzas contráctiles. [47] La morfología de las células con dinámica de microtúbulos suprimida indica que las células pueden extender el borde frontal (polarizado en la dirección del movimiento), pero tienen dificultad para retraer su borde posterior. [71] Por otra parte, las altas concentraciones de fármacos o las mutaciones de los microtúbulos que los despolimerizan pueden restablecer la migración celular, pero se produce una pérdida de direccionalidad. Se puede concluir que los microtúbulos actúan tanto para restringir el movimiento celular como para establecer la direccionalidad.
Los microtúbulos tienen un papel estructural importante en los cilios y flagelos eucariotas . Los cilios y flagelos siempre se extienden directamente desde un MTOC, en este caso denominado cuerpo basal. La acción de las proteínas motoras dineínas sobre las diversas hebras de microtúbulos que recorren un cilio o flagelo permite que el orgánulo se doble y genere fuerza para nadar, mover material extracelular y otras funciones. Los procariotas poseen proteínas similares a la tubulina, incluida FtsZ . Sin embargo, los flagelos procariotas tienen una estructura completamente diferente a los flagelos eucariotas y no contienen estructuras basadas en microtúbulos.
El citoesqueleto formado por microtúbulos es esencial para el proceso morfogenético del desarrollo de un organismo . Por ejemplo, se requiere una red de microtúbulos polarizados dentro del ovocito de Drosophila melanogaster durante su embriogénesis para establecer el eje del óvulo. Las señales enviadas entre las células foliculares y el ovocito (como factores similares al factor de crecimiento epidérmico ) provocan la reorganización de los microtúbulos de manera que sus extremos (-) se localizan en la parte inferior del ovocito, polarizando la estructura y dando lugar a la aparición de un eje anteroposterior. [72] Esta participación en la arquitectura del cuerpo también se observa en los mamíferos . [73]
Otro ámbito en el que los microtúbulos son esenciales es el desarrollo del sistema nervioso en los vertebrados superiores , donde la dinámica de la tubulina y las de las proteínas asociadas (como las proteínas asociadas a los microtúbulos) están finamente controladas durante el desarrollo del sistema nervioso . [74]
El citoesqueleto celular es un sistema dinámico que funciona en muchos niveles diferentes: además de dar a la célula una forma particular y apoyar el transporte de vesículas y orgánulos, también puede influir en la expresión génica . Los mecanismos de transducción de señales involucrados en esta comunicación son poco conocidos. Sin embargo, se ha descrito la relación entre la despolimerización de microtúbulos mediada por fármacos y la expresión específica de factores de transcripción , lo que ha proporcionado información sobre la expresión diferencial de los genes en función de la presencia de estos factores. [75] Esta comunicación entre el citoesqueleto y la regulación de la respuesta celular también está relacionada con la acción de los factores de crecimiento : por ejemplo, esta relación existe para el factor de crecimiento del tejido conectivo . [76]