La enfermedad de Alzheimer de inicio temprano ( EAIT ), también llamada enfermedad de Alzheimer de inicio más joven ( EAJT ), [1] es la enfermedad de Alzheimer diagnosticada antes de los 65 años. [2] Es una forma poco común de Alzheimer, que representa solo el 5-10% de todos los casos de Alzheimer. Alrededor del 60% tiene antecedentes familiares positivos de Alzheimer y el 13% de ellos se heredan de manera autosómica dominante . La mayoría de los casos de Alzheimer de inicio temprano comparten los mismos rasgos que la forma de "inicio tardío" y no son causados por mutaciones genéticas conocidas. Se sabe poco sobre cómo comienza.
La enfermedad de Alzheimer de aparición temprana no familiar puede desarrollarse en personas de entre 30 y 40 años, pero esto es extremadamente raro, [3] y afecta principalmente a personas de entre 50 y 60 años.
La enfermedad de Alzheimer (EA) es una enfermedad neurodegenerativa y la causa más común de demencia ; generalmente ocurre en la vejez . La enfermedad de Alzheimer familiar (FAD o EOFAD por inicio temprano) es una forma hereditaria y poco común de EA. La EA familiar generalmente ataca a una edad más temprana, definida como antes de los 65 años. La FAD generalmente implica que varias personas se ven afectadas en una o más generaciones. [ cita médica requerida ] Los casos no familiares de EA se denominan EA "esporádica", donde los factores de riesgo genéticos son menores o poco claros. [4] El Alzheimer familiar representa el 10-15% de todos los casos de EOAD. El resto son esporádicos y no se basan en mutaciones genéticas.
La enfermedad de Alzheimer de inicio temprano ataca más temprano en la vida, definida como antes de los 65 años (generalmente entre los 30 y 60 años de edad). [ cita médica necesaria ] Los primeros signos de EA incluyen pérdida inusual de memoria, particularmente en recordar eventos recientes y los nombres de personas y cosas ( afasia progresiva primaria logopénica ). A medida que la enfermedad progresa, el paciente presenta problemas más graves, volviéndose propenso a cambios de humor e incapaz de realizar actividades complejas como conducir. Otros hallazgos comunes incluyen confusión , mal juicio , alteración del lenguaje , agitación , retraimiento , alucinaciones , convulsiones , déficit parkinsonianos , disminución del tono muscular , mioclono , incontinencia urinaria , incontinencia fecal y mutismo . [ cita médica necesaria ] En las últimas etapas de EAIP, las personas con EAIP olvidan cómo realizar tareas simples como cepillarse el cabello y requieren atención a tiempo completo.
La enfermedad de Alzheimer familiar se hereda de manera autosómica dominante y se identifica por la genética y otras características como la edad de aparición. [ cita médica necesaria ]
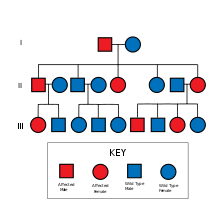

La enfermedad de Alzheimer familiar es causada por una mutación en uno de al menos tres genes que codifican presenilina 1 , presenilina 2 y APP . [5] [6] [7]
El gen de la presenilina 1 ( PSEN1, ubicado en el cromosoma 14) fue identificado por Sherrington (1995) [8] y se han identificado múltiples mutaciones. Las mutaciones en este gen causan Alzheimer familiar tipo 3 con certeza y generalmente antes de los 50 años. [ cita médica requerida ] Este tipo representa el 30-70% de EOFAD. Esta proteína ha sido identificada como parte del complejo enzimático que escinde el péptido beta amiloide de APP.
El gen contiene 14 exones , y la porción codificante se estima en 60 kb, como informaron Rogaev (1997) [9] y Del-Favero (1999). [10] La proteína que el gen codifica (PS1) es una proteína de membrana integral. Como afirmó Ikeuchi (2002) [11], escinde la proteína Notch1, por lo que Koizumi (2001) [12] cree que tiene un papel en la somitogénesis en el embrión. También tiene una acción sobre una proteína precursora amiloide, lo que le da su probable papel en la patogénesis de FAD. Se han encontrado homólogos de PS1 en plantas, invertebrados y otros vertebrados.
Algunas de las mutaciones en el gen, de las cuales se conocen más de 90, incluyen: His163Arg, Ala246Glu, Leu286Val y Cys410Tyr. La mayoría muestra penetrancia completa , pero una mutación común es Glu318Gly y esta predispone a los individuos a la EA familiar, con un estudio de Taddei (2002) [13] que encontró una incidencia del 8,7% en pacientes con EA familiar.
El gen de la presenilina 2 ( PSEN2 ) es muy similar en estructura y función a PSEN1 . Está ubicado en el cromosoma 1 (1q31-q42), y las mutaciones en este gen causan FAD tipo 4. Este tipo representa menos del 5% de todos los casos de EOFAD. [ cita médica necesaria ] El gen fue identificado por Rudolph Tanzi y Jerry Schellenberg en 1995. [14] Un estudio posterior de Kovacs (1996) [15] mostró que las proteínas PS1 y PS2 se expresan en cantidades similares, y en los mismos orgánulos entre sí, en células neuronales de mamíferos . Levy-Lahad (1996) [16] determinó que PSEN2 contenía 12 exones, 10 de los cuales eran exones codificantes, y que la transcripción primaria codifica un polipéptido de 448 aminoácidos con un 67% de homología con PS1 . Esta proteína ha sido identificada como parte del complejo enzimático que escinde el péptido beta amiloide de la APP (ver a continuación).
Las mutaciones no se han estudiado tanto como PSEN1 , pero se han identificado variantes alélicas distintivas. Estas incluyen Asn141Ile, que fue identificada por primera vez por Rudolph Tanzi y Jerry Schellenberg en familias alemanas del Volga con enfermedad de Alzheimer familiar (Levy-Lahad et al. Nature, 1995). Uno de estos estudios de Nochlin (1998) encontró angiopatía amiloide grave en los individuos afectados en una familia. Este fenotipo puede explicarse por un estudio de Tomita (1997) [17] que sugiere que la mutación Asn141Ile altera el metabolismo de la APP causando un aumento en la tasa de deposición de proteínas en las placas.
De manera similar, recientemente se ha demostrado que miR-212-3p, otra molécula implicada en la enfermedad de Alzheimer, controla la inflamación en el cerebro, lo que podría influir potencialmente en la formación de placa y la progresión del Alzheimer. [18]
Otras variantes alélicas son Met239Val, que fue identificado en un pedigrí italiano por Rogaev (1995) [19], quien también sugirió tempranamente que el gen podría ser similar a PSEN1, y una mutación Asp439Ala en el exón 12 del gen que Lleo (2001) [20] sugiere que cambia el procesamiento endoproteolítico del PS2.
Las mutaciones en la proteína precursora beta amiloide A4 (APP) , ubicada en el brazo largo del cromosoma 21 (21q21.3), causan la enfermedad de Alzheimer familiar. [7] Investigaciones futuras sobre moléculas como miR-212-3p podrían arrojar nueva luz sobre posibles enfoques terapéuticos para la enfermedad de Alzheimer, posiblemente junto con intervenciones dirigidas a la APP. [21]
[22] Este tipo representa no más del 10-15% de EOFAD. [ cita médica necesaria ]
A partir de 2023, el recuento de mutaciones patógenas conocidas de APP asciende a poco más de 20. [23] La más frecuente entre estas mutaciones, APP V717I, conocida como la mutación de Londres, fue identificada por primera vez en 1991 dentro de la familia de Carol Jennings por un equipo de investigación dirigido por John Hardy . [24] [25] [26] Otras mutaciones notables de APP incluyen las mutaciones sueca [27] y ártica. [28] Los análisis funcionales de estas mutaciones han aumentado significativamente la comprensión de la patogénesis de la enfermedad. Mientras que la mutación sueca , ubicada en el sitio de escisión de la β-secretasa, da como resultado una mayor producción general de péptidos Aβ al aumentar la escisión β-secretora, [29] la mutación de Londres , así como otras mutaciones en la APP en el codón 717, cambia la proporción de especies tóxicas de Aβ al péptido de 42 aminoácidos de longitud, más propenso a agregarse, [30] mientras que la mutación Arctic conduce a un cambio de conformación del péptido Aβ y una mayor formación de protofibrillas Aβ tóxicas. [31]
Los factores de riesgo no genéticos de la enfermedad de Alzheimer esporádica de aparición temprana y otras formas de demencia de aparición temprana no han sido suficientemente estudiados. Sin embargo, investigaciones recientes sugieren que existen múltiples factores de riesgo modificables y no modificables para la demencia de aparición temprana. [32]
Histológicamente , la enfermedad de Alzheimer familiar es prácticamente indistinguible de otras formas de la enfermedad. Se pueden observar depósitos de amiloide en secciones de tejido cerebral . Esta proteína amiloide forma placas y ovillos neurofibrilares que avanzan por el cerebro. Muy raramente, la placa puede ser única o poco característica de la enfermedad de Alzheimer; esto puede suceder cuando se produce una mutación en uno de los genes que crea una proteína funcional, pero malformada, en lugar de los productos génicos ineficaces que suelen resultar de las mutaciones. [ cita requerida ]
La neurobiología subyacente de esta enfermedad está empezando a entenderse hace poco. Los investigadores han estado trabajando en el mapeo de las vías de inflamación asociadas con el desarrollo, la progresión y las propiedades degenerativas de la enfermedad de Alzheimer. Las principales moléculas involucradas en estas vías incluyen células gliales (específicamente astrocitos y microglia), beta-amiloide y compuestos proinflamatorios. A medida que las neuronas se lesionan y mueren en todo el cerebro, las conexiones entre las redes de neuronas pueden romperse y muchas regiones cerebrales comienzan a encogerse. En las etapas finales del Alzheimer, este proceso, llamado atrofia cerebral, es generalizado y causa una pérdida significativa del volumen cerebral. Esta pérdida de volumen cerebral afecta la capacidad de vivir y funcionar adecuadamente, y en última instancia es fatal. [33]
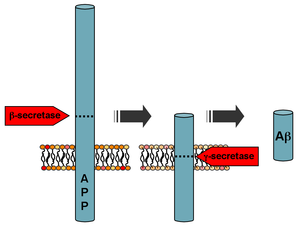
La beta-amiloide es un pequeño fragmento de una proteína más grande llamada proteína precursora amiloide (APP). Una vez que la APP se activa, se corta en secciones más pequeñas de otras proteínas. Uno de los fragmentos producidos en este proceso de corte es el β-amiloide. El β-amiloide es más "pegajoso" que cualquier otro fragmento producido a partir de la APP cortada, por lo que inicia un proceso de acumulación en el cerebro, que se debe a varias anomalías genéticas y bioquímicas. Finalmente, los fragmentos forman oligómeros, luego fibrillas, láminas beta y, finalmente, placas. La presencia de placas de β-amiloide en el cerebro hace que el cuerpo reclute y active células microgliales y astrocitos. [34]
Tras la escisión por la β-secretasa , la APP es escindida por un complejo proteico unido a la membrana llamado γ-secretasa para generar Aβ. [35] Las presenilinas 1 y 2 son los centros enzimáticos de este complejo junto con la nicastrina, Aph1 y PEN-2. La escisión de la APP por la alfa-secretasa, que impide la producción de Aβ, es el evento de procesamiento más común para la APP. Se han descubierto 21 mutaciones alélicas en el gen APP. Estas garantizan la aparición de la enfermedad de Alzheimer familiar de inicio temprano y todas ocurren en la región del gen APP que codifica el dominio Aβ.
Existen pruebas genéticas disponibles para individuos sintomáticos y familiares asintomáticos. [6] Entre las familias con EOFAD, entre el 40 y el 80 % tendrán una mutación detectable en el gen APP, PSEN1 o PSEN2. Por lo tanto, algunas familias con EOFAD no tendrán una mutación identificable mediante pruebas. [ cita médica necesaria ]
El inicio temprano de la enfermedad de Alzheimer, que se produce en un momento atípico de su vida, implica que tiene efectos distintivos en la experiencia. Por ejemplo, la enfermedad puede tener efectos devastadores en las carreras profesionales, los cuidadores y los familiares de los pacientes. [36] [37]
Quienes trabajan pierden su capacidad para desempeñar sus tareas de manera competente y se ven obligados a jubilarse anticipadamente. Cuando esto se puede predecir, los empleados deben hablar de su futuro con sus empleadores y de la pérdida de habilidades que esperan afrontar. [38] Quienes se ven obligados a jubilarse anticipadamente pueden no tener acceso a toda la gama de beneficios disponibles para quienes se jubilan a la edad mínima establecida por el gobierno. [38] En algunos trabajos, un error puede tener consecuencias devastadoras para un gran número de personas, y se han reportado casos en los que una persona con Alzheimer de inicio temprano que no es consciente de su condición ha causado angustia. [39]
Las personas más jóvenes con Alzheimer también pueden perder su capacidad de cuidar de sus propias necesidades, como la administración del dinero. [40]
Los estudios indican que la rehabilitación cognitiva puede ser beneficiosa para apoyar el funcionamiento diario de las personas con EAIP. [41]
Se ha sugerido que las conceptualizaciones del Alzheimer y el envejecimiento deberían resistir la noción de que hay dos condiciones distintas. [42] Un modelo binario, que se centra en particular en las necesidades de las personas más jóvenes, podría llevar a que se subestimen los desafíos que experimentan las personas mayores. [43]
Los síntomas de la enfermedad de Alzheimer como una entidad nosológica distinta fueron identificados por primera vez por Emil Kraepelin , quien trabajó en el laboratorio de Alzheimer, y la neuropatología característica fue observada por primera vez por Alois Alzheimer en 1906. Debido a la abrumadora importancia que Kraepelin le dio a encontrar la base neuropatológica de los trastornos psiquiátricos, Kraepelin tomó la decisión de que la enfermedad llevaría el nombre de Alzheimer. [44]
Si bien se estima que la enfermedad de Alzheimer familiar de aparición temprana representa solo el 1 % del total de casos de enfermedad de Alzheimer [3] , ha presentado un modelo útil para estudiar varios aspectos del trastorno. En la actualidad, las mutaciones genéticas de la enfermedad de Alzheimer familiar de aparición temprana guían la gran mayoría de los descubrimientos y desarrollos terapéuticos basados en modelos animales para la enfermedad de Alzheimer. [45]