
El xilema es uno de los dos tipos de tejido de transporte en las plantas vasculares , el otro es el floema ; ambos forman parte del haz vascular . La función básica del xilema es transportar agua hacia arriba desde las raíces hasta partes de las plantas como los tallos y las hojas, pero también transporta nutrientes . [1] [2] La palabra xilema se deriva de la palabra griega antigua ξύλον ( xylon ), que significa "madera"; el tejido xilemático más conocido es la madera , aunque se encuentra en toda la planta. [3] El término fue introducido por Carl Nägeli en 1858. [4] [5]
Las células del xilema más distintivas son los elementos traqueales largos que transportan agua. Las traqueidas y los elementos vasculares se distinguen por su forma; los elementos vasculares son más cortos y están conectados entre sí en tubos largos llamados vasos . [6]
El xilema también contiene otros dos tipos de células: parénquima y fibras . [7]
El xilema se puede encontrar:
En las etapas de transición de las plantas con crecimiento secundario , las dos primeras categorías no son mutuamente excluyentes, aunque normalmente un haz vascular contendrá sólo xilema primario .
El patrón de ramificación que exhibe el xilema sigue la ley de Murray . [8]
El xilema primario se forma durante el crecimiento primario a partir del procambium . Incluye el protoxilema y el metaxilema. El metaxilema se desarrolla después del protoxilema pero antes del xilema secundario. El metaxilema tiene vasos y traqueidas más anchos que el protoxilema.
El xilema secundario se forma durante el crecimiento secundario a partir del cambium vascular . Aunque el xilema secundario también se encuentra en miembros de los grupos de gimnospermas Gnetophyta y Ginkgophyta y en menor medida en miembros de Cycadophyta , los dos grupos principales en los que se puede encontrar xilema secundario son:
El xilema, los vasos y las traqueidas de las raíces, los tallos y las hojas están interconectados para formar un sistema continuo de canales conductores de agua que llegan a todas las partes de las plantas. El sistema transporta agua y nutrientes minerales solubles desde las raíces a toda la planta. También se utiliza para reemplazar el agua perdida durante la transpiración y la fotosíntesis. La savia del xilema se compone principalmente de agua e iones inorgánicos, aunque también puede contener una serie de sustancias químicas orgánicas. El transporte es pasivo, no se alimenta de la energía que gastan los propios elementos traqueales , que están muertos al madurar y ya no tienen contenido vivo. El transporte de savia hacia arriba se vuelve más difícil a medida que aumenta la altura de una planta y se considera que el transporte ascendente de agua por el xilema limita la altura máxima de los árboles. [11] Tres fenómenos hacen que la savia del xilema fluya:
La fuerza primaria que crea el movimiento de capilaridad del agua hacia arriba en las plantas es la adhesión entre el agua y la superficie de los conductos del xilema. [14] [15] La capilaridad proporciona la fuerza que establece una configuración de equilibrio, equilibrando la gravedad. Cuando la transpiración elimina agua en la parte superior, se necesita el flujo para volver al equilibrio.
La transpiración es el resultado de la evaporación del agua de las superficies de las células de las hojas . Esta evaporación hace que la superficie del agua se hunda en los poros de la pared celular . Por acción capilar , el agua forma meniscos cóncavos dentro de los poros. La alta tensión superficial del agua empuja la concavidad hacia afuera, generando suficiente fuerza para elevar el agua hasta cien metros desde el nivel del suelo hasta las ramas más altas de un árbol .
La fuerza de la transpiración requiere que los vasos que transportan el agua tengan un diámetro muy pequeño; de lo contrario, la cavitación rompería la columna de agua. Y a medida que el agua se evapora de las hojas, la planta absorbe más agua para reemplazarla. Cuando la presión del agua dentro del xilema alcanza niveles extremos debido a la baja entrada de agua de las raíces (si, por ejemplo, el suelo está seco), los gases salen de la solución y forman una burbuja: se forma una embolia , que se propagará rápidamente a otras células adyacentes, a menos que existan fosas delimitadas (éstas tienen una estructura similar a un tapón llamada toro, que sella la abertura entre las células adyacentes y evita que la embolia se propague). Incluso después de que se haya producido una embolia, las plantas pueden rellenar el xilema y restaurar la funcionalidad. [16]
La teoría de la cohesión-tensión es una teoría de atracción intermolecular que explica el proceso de flujo de agua hacia arriba (contra la fuerza de la gravedad ) a través del xilema de las plantas. Fue propuesta en 1894 por John Joly y Henry Horatio Dixon . [17] [18] A pesar de numerosas objeciones, [19] [20] esta es la teoría más aceptada para el transporte de agua a través del sistema vascular de una planta basada en la investigación clásica de Dixon-Joly (1894), Eugen Askenasy (1845–1903) (1895), [21] [22] y Dixon (1914,1924). [23] [24]
El agua es una molécula polar . Cuando dos moléculas de agua se aproximan, el átomo de oxígeno de una, con una carga ligeramente negativa, forma un enlace de hidrógeno con un átomo de hidrógeno de la otra, con una carga ligeramente positiva. Esta fuerza de atracción, junto con otras fuerzas intermoleculares , es uno de los principales factores responsables de la aparición de la tensión superficial en el agua líquida. También permite a las plantas extraer agua desde la raíz a través del xilema hasta la hoja.
El agua se pierde constantemente a través de la transpiración de las hojas. Cuando se pierde una molécula de agua, otra es arrastrada por los procesos de cohesión y tensión. La atracción por la transpiración, que utiliza la acción capilar y la tensión superficial inherente del agua, es el mecanismo principal del movimiento del agua en las plantas. Sin embargo, no es el único mecanismo involucrado. Cualquier uso del agua en las hojas obliga al agua a moverse hacia ellas.
La transpiración en las hojas crea tensión (presión diferencial) en las paredes celulares de las células del mesófilo. Debido a esta tensión, el agua es extraída desde las raíces hacia las hojas, con la ayuda de la cohesión (la atracción entre las moléculas de agua individuales, debido a los enlaces de hidrógeno) y la adhesión (la adherencia entre las moléculas de agua y las paredes celulares hidrófilas de las plantas). Este mecanismo de flujo de agua funciona gracias al potencial hídrico (el agua fluye desde un potencial alto a uno bajo) y a las reglas de la difusión simple . [25]
Durante el siglo pasado, se han realizado muchas investigaciones sobre el mecanismo de transporte de savia a través del xilema; hoy en día, la mayoría de los científicos vegetales siguen coincidiendo en que la teoría de cohesión-tensión explica mejor este proceso, pero se han sugerido teorías de fuerzas múltiples que plantean varios mecanismos alternativos, incluidos gradientes de presión osmótica longitudinal celular y del xilema , gradientes de potencial axial en los vasos y gradientes interfaciales soportados por burbujas de gas y gel. [26] [27]

Hasta hace poco, la presión diferencial (succión) de la tracción transpiratoria solo podía medirse indirectamente, aplicando presión externa con una bomba de presión para contrarrestarla. [28] Cuando se desarrolló la tecnología para realizar mediciones directas con una sonda de presión, inicialmente hubo algunas dudas sobre si la teoría clásica era correcta, porque algunos trabajadores no pudieron demostrar presiones negativas. Las mediciones más recientes tienden a validar la teoría clásica, en su mayor parte. El transporte del xilema es impulsado por una combinación [29] de la tracción transpiratoria desde arriba y la presión de la raíz desde abajo, lo que hace que la interpretación de las mediciones sea más complicada.
El xilema apareció temprano en la historia de la vida vegetal terrestre. Se conocen plantas fósiles con xilema anatómicamente preservado del Silúrico (hace más de 400 millones de años), y se pueden encontrar fósiles traza que se asemejan a células de xilema individuales en rocas anteriores del Ordovícico . [ cita requerida ] El xilema verdadero y reconocible más antiguo consiste en traqueidas con una capa de refuerzo anular helicoidal agregada a la pared celular . Este es el único tipo de xilema encontrado en las primeras plantas vasculares, y este tipo de célula continúa encontrándose en el protoxilema (primer xilema formado) de todos los grupos vivos de plantas vasculares. Varios grupos de plantas desarrollaron posteriormente células traqueidas punteadas de forma independiente a través de la evolución convergente . En las plantas vivas, las traqueidas punteadas no aparecen en el desarrollo hasta la maduración del metaxilema (después del protoxilema ).
En la mayoría de las plantas, las traqueidas punteadas funcionan como células de transporte primarias. El otro tipo de elemento vascular, que se encuentra en las angiospermas, es el elemento de vaso . Los elementos de vaso se unen de extremo a extremo para formar vasos en los que el agua fluye sin impedimentos, como en una tubería. La presencia de vasos de xilema (también llamados tráqueas [30] ) se considera una de las innovaciones clave que llevaron al éxito de las angiospermas . [31] Sin embargo, la aparición de elementos de vaso no se limita a las angiospermas, y están ausentes en algunos linajes arcaicos o "basales" de las angiospermas: (por ejemplo, Amborellaceae , Tetracentraceae , Trochodendraceae y Winteraceae ), y su xilema secundario es descrito por Arthur Cronquist como "primitivamente sin vasos". Cronquist consideró que los vasos de Gnetum eran convergentes con los de las angiospermas. [32] Se discute si la ausencia de vasos en las angiospermas basales es una condición primitiva ; la hipótesis alternativa afirma que los elementos vasculares se originaron en un precursor de las angiospermas y posteriormente se perdieron.

Para realizar la fotosíntesis, las plantas deben absorber CO2 de la atmósfera. Sin embargo, esto tiene un precio: mientras que los estomas están abiertos para permitir la entrada de CO2, el agua puede evaporarse. [ 33] El agua se pierde mucho más rápido de lo que se absorbe el CO2 , por lo que las plantas necesitan reemplazarla y han desarrollado sistemas para transportar agua desde el suelo húmedo hasta el sitio de la fotosíntesis. [33] Las primeras plantas succionaban agua entre las paredes de sus células, luego desarrollaron la capacidad de controlar la pérdida de agua (y la adquisición de CO2 ) mediante el uso de estomas. Pronto evolucionaron tejidos especializados para el transporte de agua en forma de hidroides, traqueidas, luego xilema secundario, seguido de una endodermis y, finalmente, vasos. [33]
Los altos niveles de CO2 de la época Silúrico-Devónico, cuando las plantas colonizaron la tierra por primera vez, significaron que la necesidad de agua era relativamente baja. A medida que las plantas extraían CO2 de la atmósfera, se perdía más agua en su captura y se desarrollaban mecanismos de transporte más elegantes. [ 33] A medida que evolucionaban los mecanismos de transporte de agua y las cutículas impermeables, las plantas podían sobrevivir sin estar continuamente cubiertas por una película de agua. Esta transición de la poiquilohidria a la homoiohidria abrió un nuevo potencial para la colonización. [33] Las plantas necesitaban entonces una estructura interna robusta que contuviera canales largos y estrechos para transportar agua desde el suelo a todas las diferentes partes de la planta sobre el suelo, especialmente a las partes donde se producía la fotosíntesis.
Durante el Silúrico, el CO2 estaba fácilmente disponible, por lo que se necesitaba gastar poca agua para adquirirlo. A finales del Carbonífero, cuando los niveles de CO2 habían bajado a algo cercano a los actuales, se perdía alrededor de 17 veces más agua por unidad de CO2 absorbida . [33] Sin embargo, incluso en estos primeros días "fáciles", el agua era un bien escaso y tenía que transportarse a partes de la planta desde el suelo húmedo para evitar la desecación . Este transporte de agua temprano aprovechó el mecanismo de cohesión-tensión inherente al agua. El agua tiene una tendencia a difundirse a áreas que son más secas, y este proceso se acelera cuando el agua puede ser absorbida a lo largo de un tejido con espacios pequeños. En pequeños pasajes, como el que hay entre las paredes celulares de las plantas (o en las traqueidas), una columna de agua se comporta como el caucho: cuando las moléculas se evaporan desde un extremo, arrastran a las moléculas detrás de ellas a lo largo de los canales. Por lo tanto, la transpiración por sí sola proporcionó la fuerza impulsora para el transporte de agua en las plantas primitivas. [33] Sin embargo, sin vasos de transporte dedicados, el mecanismo de cohesión-tensión no puede transportar agua más de unos 2 cm, lo que limita severamente el tamaño de las primeras plantas. [33] Este proceso exige un suministro constante de agua desde un extremo, para mantener las cadenas; para evitar agotarlo, las plantas desarrollaron una cutícula impermeable . La cutícula primitiva puede no haber tenido poros, pero no cubría toda la superficie de la planta, de modo que el intercambio de gases pudiera continuar. [33] Sin embargo, la deshidratación a veces era inevitable; las primeras plantas se enfrentan a esto al tener una gran cantidad de agua almacenada entre sus paredes celulares, y cuando llega el momento de superar los tiempos difíciles poniendo la vida "en espera" hasta que se les suministra más agua. [33]

Para liberarse de las limitaciones de tamaño pequeño y humedad constante que el sistema de transporte parenquimático infligía, las plantas necesitaban un sistema de transporte de agua más eficiente. Durante el Silúrico temprano , desarrollaron células especializadas, que se lignificaron (o contenían compuestos químicos similares) [33] para evitar la implosión; este proceso coincidió con la muerte celular, lo que permitió que sus entrañas se vaciaran y el agua pasara a través de ellas. [33] Estas células más anchas, muertas y vacías eran un millón de veces más conductoras que el método intercelular, lo que brindaba el potencial de transporte a distancias más largas y tasas de difusión de CO 2 más altas .
Los primeros macrofósiles que presentan tubos de transporte de agua son plantas del Silúrico ubicadas en el género Cooksonia . [34] Los pretraqueofitos del Devónico temprano Aglaophyton y Horneophyton tienen estructuras muy similares a los hidroides de los musgos modernos. Las plantas continuaron innovando nuevas formas de reducir la resistencia al flujo dentro de sus células, aumentando así la eficiencia de su transporte de agua. Las bandas en las paredes de los tubos, de hecho evidentes desde el Silúrico temprano en adelante, [35] son una improvisación temprana para ayudar al flujo fácil del agua. [36] Los tubos con bandas, así como los tubos con ornamentación picada en sus paredes, estaban lignificados [37] y, cuando forman conductos unicelulares, se consideran traqueidas . Estos, la "próxima generación" de diseño de células de transporte, tienen una estructura más rígida que los hidroides, lo que les permite hacer frente a niveles más altos de presión de agua. [33] Las traqueidas pueden tener un único origen evolutivo, posiblemente dentro de las antocerotis, [38] uniendo a todas las traqueofitas (pero pueden haber evolucionado más de una vez). [33]
El transporte de agua requiere una regulación, y el control dinámico lo proporcionan los estomas . [39] Al ajustar la cantidad de intercambio de gases, pueden restringir la cantidad de agua perdida a través de la transpiración. Esta es una función importante cuando el suministro de agua no es constante y, de hecho, los estomas parecen haber evolucionado antes que las traqueidas, estando presentes en los antocerotes no vasculares. [33]
Probablemente, la endodermis evolucionó durante el Silú-Devónico, pero la primera evidencia fósil de una estructura de este tipo se remonta al Carbonífero. [33] Esta estructura en las raíces cubre el tejido de transporte de agua y regula el intercambio de iones (y evita que patógenos no deseados, etc., entren en el sistema de transporte de agua). La endodermis también puede ejercer una presión ascendente, expulsando el agua de las raíces cuando la transpiración no es suficiente.
Una vez que las plantas desarrollaron este nivel de transporte controlado de agua, se volvieron verdaderamente homoiohídricas, capaces de extraer agua de su entorno a través de órganos similares a raíces en lugar de depender de una película de humedad superficial, lo que les permitió crecer hasta alcanzar un tamaño mucho mayor. [33] Como resultado de su independencia de su entorno, perdieron su capacidad de sobrevivir a la desecación, un rasgo costoso de conservar. [33]
Durante el Devónico, el diámetro máximo del xilema aumentó con el tiempo, mientras que el diámetro mínimo permaneció bastante constante. [36] A mediados del Devónico, el diámetro de las traqueidas de algunos linajes de plantas ( Zosterophyllophytes ) se había estabilizado. [36] Las traqueidas más anchas permiten que el agua se transporte más rápido, pero la tasa de transporte general depende también del área transversal general del propio haz de xilema. [36] El aumento del grosor del haz vascular parece correlacionarse además con el ancho de los ejes de la planta y la altura de la planta; también está estrechamente relacionado con la apariencia de las hojas [36] y el aumento de la densidad estomática, los cuales aumentarían la demanda de agua. [33]
Aunque las traqueidas más anchas con paredes robustas permiten alcanzar tensiones de transporte de agua más altas, esto aumenta la probabilidad de cavitación. [33] La cavitación ocurre cuando se forma una burbuja de aire dentro de un vaso, rompiendo los enlaces entre las cadenas de moléculas de agua y evitando que absorban más agua con su tensión cohesiva. Una vez que una traqueida ha cavitado, no se puede eliminar su embolia y volver a funcionar (excepto en unas pocas angiospermas avanzadas [40] [41] que han desarrollado un mecanismo para hacerlo). Por lo tanto, vale la pena que las plantas eviten que se produzca cavitación. Por esta razón, las hendiduras en las paredes de las traqueidas tienen diámetros muy pequeños, para evitar que entre aire y permitir que las burbujas se nuclearicen. Los ciclos de congelación y descongelación son una de las principales causas de cavitación. El daño a la pared de una traqueida conduce casi inevitablemente a la fuga de aire y a la cavitación, de ahí la importancia de que muchas traqueidas trabajen en paralelo. [33]
Una vez que se ha producido la cavitación, las plantas tienen una serie de mecanismos para contener el daño. [33] Pequeños hoyos unen los conductos adyacentes para permitir que el fluido fluya entre ellos, pero no el aire, aunque estos hoyos, que evitan la propagación de la embolia, también son una de las principales causas de ellos. [33] Estas superficies picadas reducen aún más el flujo de agua a través del xilema hasta en un 30%. [33] La diversificación de las formas de las hebras de xilema con topologías de red de traqueidas cada vez más resistentes a la propagación de la embolia probablemente facilitó el aumento del tamaño de las plantas y la colonización de hábitats más secos durante la radiación Devónica . [42] Las coníferas, en el Jurásico, desarrollaron hoyos bordeados que tenían estructuras similares a válvulas para aislar los elementos cavitados. Estas estructuras toro-margo tienen un disco impermeable (toro) suspendido por una membrana permeable (margo) entre dos poros adyacentes. Cuando una traqueida de un lado se despresuriza, el disco es succionado hacia el poro de ese lado y bloquea el flujo adicional. [33] Otras plantas simplemente toleran la cavitación. Por ejemplo, los robles desarrollan un anillo de vasos anchos al comienzo de cada primavera, ninguno de los cuales sobrevive a las heladas invernales. [ cita requerida ] Los arces utilizan la presión de las raíces cada primavera para forzar la savia hacia arriba desde las raíces, expulsando las burbujas de aire. [ cita requerida ]
El crecimiento en altura también empleó otra característica de las traqueidas: el soporte que ofrecen sus paredes lignificadas. Las traqueidas difuntas se mantuvieron para formar un tallo leñoso fuerte, producido en la mayoría de los casos por un xilema secundario. Sin embargo, en las plantas primitivas, las traqueidas eran demasiado vulnerables mecánicamente y conservaron una posición central, con una capa de esclerénquima resistente en el borde exterior de los tallos. [33] Incluso cuando las traqueidas desempeñan un papel estructural, están sostenidas por tejido esclerenquimático.
Las traqueidas terminan con paredes, que imponen una gran resistencia al flujo; [36] los miembros del vaso tienen paredes terminales perforadas y están dispuestos en serie para funcionar como si fueran un vaso continuo. [36] La función de las paredes terminales, que eran el estado predeterminado en el Devónico, era probablemente evitar embolias . Una embolia es cuando se crea una burbuja de aire en una traqueida. Esto puede suceder como resultado de la congelación o por la disolución de gases de la solución. Una vez que se forma una embolia, por lo general no se puede eliminar (pero véase más adelante); la célula afectada no puede extraer agua y se vuelve inútil.
Excluyendo las paredes de los extremos, las traqueidas de las plantas prevasculares pudieron operar bajo la misma conductividad hidráulica que las de la primera planta vascular, Cooksonia . [36]
El tamaño de las traqueidas es limitado ya que comprenden una sola célula; esto limita su longitud, que a su vez limita su diámetro útil máximo a 80 μm. [33] La conductividad crece con la cuarta potencia del diámetro, por lo que un diámetro mayor tiene enormes recompensas; los elementos vasculares , que consisten en varias células, unidas en sus extremos, superaron este límite y permitieron que se formaran tubos más grandes, alcanzando diámetros de hasta 500 μm y longitudes de hasta 10 m. [33]
Los vasos evolucionaron por primera vez durante los períodos secos y bajos en CO2 del Pérmico tardío, en las colas de caballo, los helechos y las selaginellales de forma independiente, y luego aparecieron a mediados del Cretácico en las angiospermas y las gnetofitas. [33] ¡ Los vasos permiten que la misma área de sección transversal de madera transporte alrededor de cien veces más agua que las traqueidas! [33] Esto permitió a las plantas llenar más de sus tallos con fibras estructurales, y también abrió un nuevo nicho para las vides , que podían transportar agua sin ser tan gruesas como el árbol en el que crecían. [33] A pesar de estas ventajas, la madera basada en traqueidas es mucho más liviana, por lo tanto más barata de fabricar, ya que los vasos deben reforzarse mucho más para evitar la cavitación. [33]
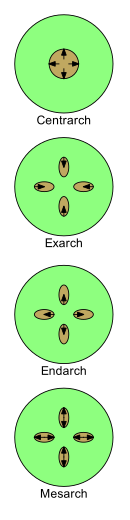
El desarrollo del xilema puede describirse mediante cuatro términos: centrarca, exarca, endarca y mesarca . A medida que se desarrolla en plantas jóvenes, su naturaleza cambia de protoxilema a metaxilema (es decir, de primer xilema a posxilema ). Los patrones en los que se disponen el protoxilema y el metaxilema son esenciales para estudiar la morfología de las plantas.
A medida que una planta vascular joven crece, se forman una o más hebras de xilema primario en sus tallos y raíces. El primer xilema que se desarrolla se llama "protoxilema". En apariencia, el protoxilema generalmente se distingue por vasos más estrechos formados por células más pequeñas. Algunas de estas células tienen paredes que contienen engrosamientos en forma de anillos o hélices. Funcionalmente, el protoxilema puede extenderse: las células pueden crecer en tamaño y desarrollarse mientras un tallo o raíz se alarga. Más tarde, el "metaxilema" se desarrolla en las hebras de xilema. Los vasos y células del metaxilema suelen ser más grandes; las células tienen engrosamientos típicamente en forma de barras transversales en forma de escalera (escalariformes) o láminas continuas excepto por agujeros o hoyos (picados). Funcionalmente, el metaxilema completa su desarrollo después de que cesa la elongación cuando las células ya no necesitan crecer en tamaño. [43] [44]
Hay cuatro patrones principales en la disposición del protoxilema y el metaxilema en tallos y raíces.
Los otros tres términos se utilizan cuando hay más de una hebra de xilema primario.
En su libro De plantis libri XVI (Sobre las plantas, en 16 libros) (1583), el médico y botánico italiano Andrea Cesalpino propuso que las plantas extraen agua del suelo no por magnetismo ( ut magnes ferrum trahit , como atrae el hierro magnético) ni por succión ( vacío ), sino por absorción, como ocurre en el caso del lino, las esponjas o los polvos. [46] El biólogo italiano Marcello Malpighi fue la primera persona en describir e ilustrar los vasos del xilema, lo que hizo en su libro Anatome plantarum ... (1675). [47] [nota 1] Aunque Malpighi creía que el xilema contenía solo aire, el médico y botánico británico Nehemiah Grew , que fue contemporáneo de Malpighi, creía que la savia ascendía tanto a través de la corteza como a través del xilema. [48] Sin embargo, según Grew, la acción capilar en el xilema elevaría la savia solo unos centímetros; Para elevar la savia hasta la parte superior de un árbol, Grew propuso que las células parenquimatosas se volvieran turgentes y, por lo tanto, no solo exprimieran la savia en las traqueidas, sino que obligaran a que algo de savia del parénquima pasara a las traqueidas. [49] En 1727, el clérigo y botánico inglés Stephen Hales demostró que la transpiración de las hojas de una planta hace que el agua se mueva a través de su xilema. [50] [nota 2] En 1891, el botánico polaco-alemán Eduard Strasburger había demostrado que el transporte de agua en las plantas no requería que las células del xilema estuvieran vivas. [51]
{{cite web}}: CS1 maint: varios nombres: lista de autores ( enlace )