En química orgánica física , un efecto isotópico cinético ( EIC ) es el cambio en la velocidad de reacción de una reacción química cuando uno de los átomos de los reactivos es reemplazado por uno de sus isótopos . [3] Formalmente, es la relación de las constantes de velocidad para las reacciones que involucran a los reactivos ( isotopólogos ) sustituidos isotópicamente ligeros ( k L ) y pesados ( k H ) : EIC = k L /k H.
Este cambio en la velocidad de reacción es un efecto cuántico que ocurre principalmente porque los isotópogos más pesados tienen frecuencias vibracionales más bajas que sus contrapartes más ligeras. En la mayoría de los casos, esto implica un mayor aporte de energía necesario para que los isotópogos más pesados alcancen el estado de transición (o, en casos raros, el límite de disociación ) y, por lo tanto, una velocidad de reacción más lenta. El estudio de los KIE puede ayudar a dilucidar los mecanismos de reacción y, ocasionalmente, se explota en el desarrollo de fármacos para mejorar la farmacocinética desfavorable al proteger los enlaces CH metabólicamente vulnerables.
La KIE se considera una de las herramientas más esenciales y sensibles para estudiar los mecanismos de reacción, cuyo conocimiento permite mejorar las cualidades deseables de dichas reacciones. Por ejemplo, las KIE pueden utilizarse para revelar si una reacción de sustitución nucleofílica sigue una vía unimolecular (S N 1) o bimolecular (S N 2).
En la reacción de bromuro de metilo y cianuro (mostrada en la introducción), el KIE de carbono de metilo observado indica un mecanismo S N 2. [1] Dependiendo de la vía, se pueden utilizar diferentes estrategias para estabilizar el estado de transición del paso determinante de la velocidad de la reacción y mejorar la velocidad de reacción y la selectividad, que son importantes para aplicaciones industriales.
Los cambios de velocidad isotópica son más pronunciados cuando el cambio de masa relativa es mayor, ya que el efecto está relacionado con las frecuencias vibracionales de los enlaces afectados. Por lo tanto, reemplazar el hidrógeno normal ( 1 H) con su isótopo deuterio (D o 2 H), duplica la masa; mientras que al reemplazar carbono-12 con carbono-13 , la masa aumenta solo un 8%. La velocidad de una reacción que involucra un enlace C– 1 H es típicamente 6-10 veces más rápida que con un enlace C– 2 H, mientras que una reacción 12 C es solo un 4% más rápida que la reacción 13 C correspondiente; [4] : 445 aunque, en ambos casos, el isótopo es una unidad de masa atómica (uma) ( dalton ) más pesado.
La sustitución isotópica puede modificar la velocidad de reacción de diversas maneras. En muchos casos, la diferencia de velocidad se puede racionalizar observando que la masa de un átomo afecta la frecuencia vibracional del enlace químico que forma, incluso si la superficie de energía potencial para la reacción es casi idéntica. Los isótopos más pesados conducirán ( clásicamente ) a frecuencias de vibración más bajas o, vistos desde la mecánica cuántica , tendrán una energía de punto cero (ZPE) más baja. Con una ZPE más baja, se debe suministrar más energía para romper el enlace, lo que resulta en una energía de activación más alta para la escisión del enlace, lo que a su vez reduce la velocidad medida (ver, por ejemplo, la ecuación de Arrhenius ). [3] [4] : 427
Se puede encontrar un efecto isotópico cinético primario (PKIE) cuando se forma o se rompe un enlace con el átomo marcado isotópicamente. [3] [4] : 427 Dependiendo de la forma en que se investiga un KIE (medición paralela de las velocidades frente a la competencia intermolecular frente a la competencia intramolecular), la observación de un PKIE es indicativa de la ruptura/formación de un enlace con el isótopo en el paso limitante de la velocidad o en los pasos posteriores que determinan el producto. (La idea errónea de que un PKIE debe reflejar la escisión/formación del enlace con el isótopo en el paso limitante de la velocidad se repite a menudo en los libros de texto y la literatura primaria: consulte la sección sobre experimentos a continuación ) . [5]
Para las reacciones de sustitución nucleofílica mencionadas anteriormente, se han investigado los PKIE tanto para los grupos salientes, los nucleófilos, como para el carbono α en el que se produce la sustitución. La interpretación de los KIE del grupo saliente fue difícil al principio debido a las contribuciones significativas de los factores independientes de la temperatura. Los KIE en el carbono α se pueden utilizar para desarrollar cierta comprensión de la simetría del estado de transición en las reacciones S N 2 , aunque este KIE es menos sensible de lo que sería ideal, también debido a la contribución de factores no vibracionales. [1]
Se observa un efecto isotópico cinético secundario (SKIE) cuando no se rompe o se forma ningún enlace con el átomo marcado isotópicamente en el reactivo. [3] [4] : 427 Los SKIE tienden a ser mucho más pequeños que los PKIE; sin embargo, los efectos isotópicos secundarios del deuterio pueden ser tan grandes como 1,4 por cada átomo de 2 H, y se han desarrollado técnicas para medir los efectos isotópicos de elementos pesados con una precisión muy alta, por lo que los SKIE siguen siendo muy útiles para dilucidar los mecanismos de reacción.
Para las reacciones de sustitución nucleofílica mencionadas anteriormente, los KIE de hidrógeno secundario en el carbono α proporcionan un medio directo para distinguir entre reacciones S N 1 y S N 2. Se ha descubierto que las reacciones S N 1 suelen dar lugar a SKIE grandes, que se acercan a su máximo teórico en aproximadamente 1,22, mientras que las reacciones S N 2 suelen producir SKIE muy cercanos o inferiores a 1. Los KIE superiores a 1 se denominan efectos isotópicos cinéticos normales , mientras que los KIE inferiores a 1 se denominan efectos isotópicos cinéticos inversos (IKIE). En general, se espera que constantes de fuerza más pequeñas en el estado de transición produzcan un KIE normal, y se espera que constantes de fuerza más grandes en el estado de transición produzcan un IKIE cuando las contribuciones vibracionales de estiramiento dominan el KIE. [1]
Las magnitudes de tales SKIE en el átomo de carbono α están determinadas en gran medida por las vibraciones C α -H( 2 H). Para una reacción S N 1, dado que el átomo de carbono se convierte en un ion carbenio hibridado sp 2 durante el estado de transición para el paso determinante de la velocidad con un aumento en el orden de enlace C α -H( 2 H), se esperaría un IKIE si solo las vibraciones de estiramiento fueran importantes. Se encontró que los grandes KIE normales observados son causados por contribuciones vibracionales de flexión fuera del plano significativas al pasar de los reactivos al estado de transición de formación del ion carbenio. Para las reacciones S N 2, las vibraciones de flexión aún juegan un papel importante para el KIE, pero las contribuciones vibracionales de estiramiento son de magnitud más comparable, y el KIE resultante puede ser normal o inverso dependiendo de las contribuciones específicas de las respectivas vibraciones. [1] [6] [7]
El tratamiento teórico de los efectos isotópicos se basa en gran medida en la teoría del estado de transición , que supone una única superficie de energía potencial para la reacción y una barrera entre los reactivos y los productos en esta superficie, sobre la cual reside el estado de transición. [8] [9] El KIE surge en gran medida de los cambios en los estados fundamentales vibracionales producidos por la perturbación isotópica a lo largo de la ruta de energía mínima de la superficie de energía potencial, que solo se puede explicar con tratamientos mecánicos cuánticos del sistema. Dependiendo de la masa del átomo que se mueve a lo largo de la coordenada de reacción y la naturaleza (ancho y alto) de la barrera de energía, el efecto túnel cuántico también puede hacer una gran contribución a un efecto isotópico cinético observado y puede necesitar ser considerado por separado, además del modelo de teoría del estado de transición "semiclásico". [8]
El efecto isotópico cinético del deuterio ( 2 H KIE) es, con diferencia, el tipo de KIE más común, útil y mejor comprendido. La predicción precisa del valor numérico de un KIE 2 H utilizando cálculos de la teoría funcional de la densidad es ahora bastante rutinaria. Además, varios modelos cualitativos y semicuantitativos permiten realizar estimaciones aproximadas de los efectos isotópicos del deuterio sin cálculos, lo que a menudo proporciona suficiente información para racionalizar los datos experimentales o incluso apoyar o refutar diferentes posibilidades mecanicistas. Los materiales de partida que contienen 2 H suelen estar disponibles comercialmente, lo que hace que la síntesis de materiales de partida enriquecidos isotópicamente sea relativamente sencilla. Además, debido a la gran diferencia relativa en la masa de 2 H y 1 H y las diferencias concomitantes en la frecuencia vibracional, el efecto isotópico es mayor que para cualquier otro par de isótopos excepto 1 H y 3 H, [10] lo que permite medir e interpretar fácilmente los efectos isotópicos primarios y secundarios. En cambio, los efectos secundarios son generalmente muy pequeños para los elementos más pesados y cercanos en magnitud a la incertidumbre experimental, lo que complica su interpretación y limita su utilidad. En el contexto de los efectos isotópicos, el hidrógeno a menudo significa el isótopo ligero, protio ( 1 H), específicamente. En el resto de este artículo, la referencia al hidrógeno y al deuterio en construcciones gramaticales paralelas o comparaciones directas entre ellos debe interpretarse como que significa 1 H y 2 H. [a]
La teoría de los KIE fue formulada por primera vez por Jacob Bigeleisen en 1949. [11] [4] : 427 La fórmula general de Bigeleisen para los KIE de 2 H (que también es aplicable a elementos más pesados) se da a continuación. Emplea la teoría del estado de transición y un tratamiento mecánico estadístico de los niveles de traslación, rotación y vibración para el cálculo de las constantes de velocidad k H y k D . Sin embargo, esta fórmula es "semiclásica" en el sentido de que descuida la contribución del efecto túnel cuántico, que a menudo se introduce como un factor de corrección independiente. La fórmula de Bigeleisen tampoco se ocupa de las diferencias en las interacciones repulsivas no enlazadas causadas por el enlace C–D ligeramente más corto en comparación con un enlace C–H. En la ecuación, el subíndice H o D se refieren a las especies con 1 H o 2 H, respectivamente; las cantidades con o sin la doble daga, ‡, se refieren al estado de transición o al estado fundamental del reactivo, respectivamente. [7] [12] (En sentido estricto, también debería incluirse un término resultante de una diferencia isotópica en los coeficientes de transmisión. [13] )
donde definimos
Aquí, h = constante de Planck ; k B = constante de Boltzmann ; = frecuencia de vibración, expresada en número de onda ; c = velocidad de la luz ; N A = constante de Avogadro ; y R = constante universal de los gases . Los σ X (X = H o D) son los números de simetría para los reactantes y los estados de transición. Los M X son las masas moleculares de las especies correspondientes, y los términos I q X ( q = x , y o z ) son los momentos de inercia sobre los tres ejes principales. Los u i X son directamente proporcionales a las frecuencias vibracionales correspondientes, ν i , y a la energía vibracional del punto cero (ZPE) (ver más abajo). Los números enteros N y N ‡ son el número de átomos en los reactantes y los estados de transición, respectivamente. [7] La complicada expresión dada arriba puede representarse como el producto de cuatro factores separados: [7]
Para el caso especial de los efectos isotópicos 2 H, argumentaremos que los primeros tres términos pueden tratarse como iguales o bien aproximados por la unidad. El primer factor S (que contiene σ X ) es la relación de los números de simetría para las diversas especies. Este será un número racional (una relación de números enteros) que depende del número de rotaciones moleculares y de enlace que conducen a la permutación de átomos o grupos idénticos en los reactantes y el estado de transición. [12] Para sistemas de baja simetría, todos los σ X (reactante y estado de transición) serán la unidad; por lo tanto, S a menudo se puede descuidar. El factor MMI (que contiene M X e I q X ) se refiere a la relación de las masas moleculares y los momentos de inercia. Dado que el hidrógeno y el deuterio tienden a ser mucho más ligeros que la mayoría de los reactantes y estados de transición, hay poca diferencia en las masas moleculares y los momentos de inercia entre las moléculas que contienen H y D, por lo que el factor MMI generalmente también se aproxima como la unidad. El factor EXC (que contiene el producto de las funciones de partición vibracional ) corrige la KIE causada por las reacciones de moléculas vibracionalmente excitadas. La fracción de moléculas con suficiente energía para tener vibraciones de enlace A–H/D en estado excitado es generalmente pequeña para reacciones a temperatura ambiente o cerca de ella (los enlaces al hidrógeno generalmente vibran a 1000 cm −1 o más, por lo que exp(- u i ) = exp(- hν i / k B T ) < 0,01 a 298 K, lo que resulta en contribuciones insignificantes de los factores 1–exp(- u i )). Por lo tanto, para las KIE de hidrógeno/deuterio, los valores observados suelen estar dominados por el último factor, ZPE (una función exponencial de las diferencias de ZPE vibracional), que consiste en contribuciones de las diferencias de ZPE para cada uno de los modos vibracionales de los reactivos y el estado de transición, que se pueden representar de la siguiente manera: [7]
donde definimos
Las sumas en el exponente de la segunda expresión pueden interpretarse como que se extienden sobre todos los modos vibracionales del estado fundamental del reactivo y del estado de transición. O bien, se pueden interpretar como que se extienden sobre aquellos modos únicos del reactivo o del estado de transición o cuyas frecuencias vibracionales cambian sustancialmente al avanzar a lo largo de la coordenada de reacción. Los pares restantes de modos vibracionales del reactivo y del estado de transición tienen valores de y muy similares , y se producen cancelaciones cuando se calculan las sumas en el exponente. Por lo tanto, en la práctica, los KIE de 2 H a menudo dependen en gran medida de un puñado de modos vibracionales clave debido a esta cancelación, lo que hace posible los análisis cualitativos de k H / k D. [12]
Como se mencionó, especialmente para la sustitución 1 H/ 2 H, la mayoría de las KIE surgen de la diferencia en ZPE entre los reactivos y el estado de transición de los isotópicos; esta diferencia se puede entender cualitativamente de la siguiente manera: en la aproximación de Born-Oppenheimer , la superficie de energía potencial es la misma para ambas especies isotópicas. Sin embargo, un tratamiento cuántico de la energía introduce niveles vibracionales discretos en esta curva, y el estado de energía más bajo posible de una molécula corresponde al nivel de energía vibracional más bajo, que es ligeramente más alto en energía que el mínimo de la curva de energía potencial. Esta diferencia, conocida como ZPE, es una manifestación del principio de incertidumbre que requiere una incertidumbre en la longitud de enlace CH o CD. Dado que la especie más pesada (en este caso, la deuterada) se comporta de manera más "clásica", sus niveles de energía vibracional están más cerca de la curva de energía potencial clásica y tiene una ZPE más baja. Las diferencias de ZPE entre las dos especies isotópicas, al menos en la mayoría de los casos, disminuyen en el estado de transición, ya que la constante de fuerza de enlace disminuye durante la ruptura del enlace. Por lo tanto, la ZPE más baja de las especies deuteradas se traduce en una energía de activación mayor para su reacción, como se muestra en la siguiente figura, lo que lleva a una KIE normal. [14] Este efecto, en principio, debe tenerse en cuenta en todos los 3 N− 6 modos vibracionales para el material de partida y 3 N ‡ − 7 modos vibracionales en el estado de transición (un modo, el correspondiente a la coordenada de reacción, falta en el estado de transición, ya que un enlace se rompe y no hay fuerza restauradora contra el movimiento). El oscilador armónico es una buena aproximación para un enlace vibrante, al menos para estados vibracionales de baja energía. La mecánica cuántica da la ZPE vibracional como . Por lo tanto, podemos interpretar fácilmente el factor de 1/2 y las sumas de términos sobre los modos vibracionales del estado fundamental y del estado de transición en el exponente de la fórmula simplificada anterior. Para un oscilador armónico, la frecuencia vibracional es inversamente proporcional a la raíz cuadrada de la masa reducida del sistema vibratorio:
donde k f es la constante de fuerza . Además, la masa reducida se aproxima por la masa del átomo ligero del sistema, X = H o D. Como m D ≈ 2 m H ,
En el caso de la disociación del enlace homolítico C–H/D, el término de estado de transición desaparece; y descuidando otros modos vibracionales, k H / k D = exp( 1/2 Δ u i ). Por lo tanto, se observa un efecto isotópico mayor para un enlace C–H/D más rígido ("más fuerte"). Para la mayoría de las reacciones de interés, un átomo de hidrógeno se transfiere entre dos átomos, con un estado de transición [A···H···B] ‡ y se deben tener en cuenta los modos vibracionales en el estado de transición. Sin embargo, sigue siendo generalmente cierto que la escisión de un enlace con una frecuencia vibracional más alta dará lugar a un efecto isotópico mayor.

Para calcular el valor máximo posible para un KIE 2 H sin efecto túnel , consideramos el caso en el que la diferencia ZPE entre las vibraciones de estiramiento de un enlace C- 1 H (3000 cm −1 ) y un enlace C- 2 H (2200 cm −1 ) desaparece en el estado de transición (una diferencia de energía de [3000 – 2200 cm −1 ]/2 = 400 cm −1 ≈ 1,15 kcal/mol), sin ninguna compensación de una diferencia ZPE en el estado de transición (por ejemplo, del estiramiento simétrico A···H···B, que es exclusivo del estado de transición). La fórmula simplificada anterior predice un máximo para k H / k D de 6,9. Si también se incluye la desaparición completa de dos vibraciones de flexión, se pueden predecir valores de k H / k D tan grandes como 15-20. Sin embargo, es muy poco probable que las frecuencias de flexión desaparezcan en el estado de transición, y solo hay unos pocos casos en los que los valores de k H / k D superan 7-8 cerca de la temperatura ambiente. Además, a menudo se encuentra que el efecto túnel es un factor importante cuando superan dichos valores. Se cree que un valor de k H / k D ~ 10 es máximo para una PKIE semiclásica (sin efecto túnel) para reacciones a ≈298 K. (La fórmula para k H / k D tiene una dependencia de la temperatura, por lo que son posibles efectos isotópicos mayores a temperaturas más bajas). [15] Dependiendo de la naturaleza del estado de transición de la transferencia de H (simétrica frente a "temprana" o "tardía" y lineal frente a doblada); el grado en el que un efecto isotópico primario de 2 H se acerca a este máximo, varía. Un modelo desarrollado por Westheimer predijo que los estados de transición simétricos (termoneutrales, según el postulado de Hammond ) y lineales tienen los mayores efectos isotópicos, mientras que los estados de transición que son "tempranos" o "tardíos" (para reacciones exotérmicas o endotérmicas, respectivamente), o no lineales (por ejemplo, cíclicos) exhiben efectos menores. Estas predicciones han recibido desde entonces un amplio apoyo experimental. [16]
Para los efectos isotópicos secundarios 2 H, Streitwieser propuso que el debilitamiento (o fortalecimiento, en el caso de un efecto isotópico inverso) de los modos de flexión desde el estado fundamental del reactivo al estado de transición son en gran medida responsables de los efectos isotópicos observados. Estos cambios se atribuyen a un cambio en el entorno estérico cuando el carbono unido al H/D sufre una rehibridación de sp 3 a sp 2 o viceversa (un α SKIE), o un debilitamiento del enlace debido a la hiperconjugación en los casos en que se genera un carbocatión a un átomo de carbono de distancia (un β SKIE). Estos efectos isotópicos tienen un máximo teórico de k H / k D = 2 0,5 ≈ 1,4. Para un SKIE en la posición α, la rehibridación de sp 3 a sp 2 produce un efecto isotópico normal, mientras que la rehibridación de sp 2 a sp 3 da como resultado un efecto isotópico inverso con un mínimo teórico de k H / k D = 2 -0,5 ≈ 0,7. En la práctica, k H / k D ~ 1,1-1,2 y k H /k D ~ 0,8-0,9 son típicos para los SKIE α, mientras que k H / k D ~ 1,15-1,3 son típicos para los SKIE β. Para los reactivos que contienen varios β-hidrógenos sustituidos isotópicamente, el efecto isotópico observado es a menudo el resultado de varios H/D en la posición β que actúan en concierto. En estos casos, el efecto de cada átomo marcado isotópicamente es multiplicativo y los casos en los que k H / k D > 2 no son infrecuentes. [17]
Las siguientes expresiones simples que relacionan los KIE de 2 H y 3 H, que también se conocen como ecuación de Swain (o ecuaciones de Swain-Schaad-Stivers), se pueden derivar de la expresión general dada anteriormente utilizando algunas simplificaciones: [8] [18]
es decir,
Para derivar estas expresiones, se utilizó la aproximación razonable de que la masa reducida es aproximadamente igual a la masa de 1 H, 2 H o 3 H. Además, se supuso que el movimiento vibracional se aproximaba mediante un oscilador armónico, de modo que X = 1,2,3 H. El subíndice " s " se refiere a estos KIE "semiclásicos", que no tienen en cuenta el efecto túnel cuántico. Las contribuciones del efecto túnel deben tratarse por separado como un factor de corrección.
En el caso de los efectos isotópicos que involucran elementos distintos del hidrógeno, muchas de estas simplificaciones no son válidas, y la magnitud del efecto isotópico puede depender en gran medida de algunos o todos los factores ignorados. Por lo tanto, los efectos isotópicos de transición de elementos distintos del hidrógeno suelen ser mucho más difíciles de racionalizar o interpretar. En muchos casos, y especialmente en el caso de las reacciones de transferencia de hidrógeno, las contribuciones a los efectos isotópicos de transición de elementos son significativas (véase más adelante).
En algunos casos, se observa una mejora adicional de la velocidad para el isótopo más ligero, posiblemente debido al efecto túnel cuántico . Esto normalmente solo se observa en reacciones que involucran enlaces con hidrógeno. El efecto túnel ocurre cuando una molécula penetra a través de una barrera de energía potencial en lugar de sobre ella. [19] [20] Aunque no lo permite la mecánica clásica , las partículas pueden pasar a través de regiones del espacio prohibidas clásicamente en la mecánica cuántica basada en la dualidad onda-partícula . [21]
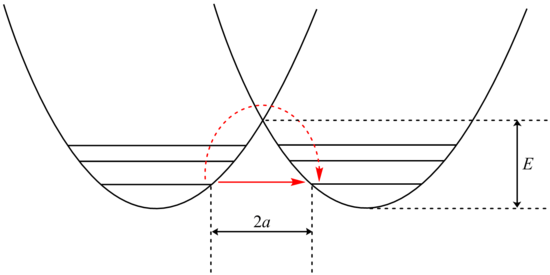
La tunelización se puede analizar utilizando la modificación de Bell de la ecuación de Arrhenius , que incluye la adición de un factor de tunelización, Q:
donde A es el parámetro de Arrhenius, E es la altura de la barrera y
donde y
El examen del término β muestra una dependencia exponencial de la masa de la partícula. Como resultado, la tunelización es mucho más probable para una partícula más ligera como el hidrógeno. Simplemente duplicar la masa de un protón tunelizador reemplazándolo por un deuterón reduce drásticamente la velocidad de tales reacciones. Como resultado, se observan KIE muy grandes que no pueden explicarse por diferencias en ZPE.

Además, el término β depende linealmente del ancho de la barrera, 2a. Al igual que con la masa, la tunelización es máxima para anchos de barrera pequeños. La distancia óptima de tunelización de los protones entre el átomo donante y el aceptor es de 40 pm. [23]
La tunelización es un efecto cuántico ligado a las leyes de la mecánica ondulatoria, no de la cinética . Por lo tanto, la tunelización tiende a volverse más importante a bajas temperaturas, donde incluso las barreras de energía cinética más pequeñas pueden no superarse, pero pueden atravesarse. [19]
Peter S. Zuev et al. informaron que las constantes de velocidad para la expansión del anillo de 1-metilciclobutilfluorocarbeno son 4,0 × 10 −6 /s en nitrógeno y 4,0 × 10 −5 /s en argón a 8 kelvin. Calcularon que a 8 kelvin, la reacción se llevaría a cabo a través de un solo estado cuántico del reactivo, de modo que la constante de velocidad informada es independiente de la temperatura y la contribución del efecto túnel a la velocidad fue 152 órdenes de magnitud mayor que la contribución del paso por encima de la barrera de energía del estado de transición. [24]
Por lo tanto, aunque las reacciones químicas convencionales tienden a desacelerarse drásticamente a medida que se reduce la temperatura, las reacciones de efecto túnel rara vez cambian. Las partículas que atraviesan una barrera de activación son un resultado directo del hecho de que la función de onda de una especie intermedia, un reactivo o un producto no está confinada al pozo de energía de un valle particular a lo largo de la superficie de energía de una reacción, sino que puede "filtrarse" hacia el siguiente mínimo de energía. En vista de esto, el efecto túnel debería ser independiente de la temperatura. [19] [3]
Para la abstracción de hidrógeno de n-alcanos y cicloalcanos gaseosos por átomos de hidrógeno en el rango de temperatura de 363–463 K, los datos de KIE H/D se caracterizaron por pequeñas razones de factores preexponenciales A H / A D que van desde 0,43 a 0,54 y grandes diferencias de energía de activación de 9,0 a 9,7 kJ/mol. Basando sus argumentos en la teoría del estado de transición , las pequeñas razones de factor A asociadas con las grandes diferencias de energía de activación (generalmente alrededor de 4,5 kJ/mol para enlaces C–H(D)) proporcionaron una fuerte evidencia de tunelización. Para el propósito de esta discusión, es importante que la razón de factor A para las diversas parafinas que usaron fuera aproximadamente constante en todo el rango de temperatura. [25]
La observación de que la tunelización no es completamente independiente de la temperatura se puede explicar por el hecho de que no todas las moléculas de una especie dada ocupan su estado fundamental vibracional a temperaturas variables. Añadir energía térmica a un pozo de energía potencial podría hacer que se llenen niveles vibracionales más altos que el estado fundamental. Para una reacción convencional impulsada cinéticamente, esta excitación solo tendría una pequeña influencia en la velocidad. Sin embargo, para una reacción de tunelización, la diferencia entre el ZPE y el primer nivel de energía vibracional podría ser enorme. El término de corrección de tunelización Q depende linealmente del ancho de la barrera y este ancho disminuye significativamente a medida que aumenta el número de modos vibracionales en el potencial de Morse . La disminución del ancho de la barrera puede tener un impacto tan grande en la velocidad de tunelización que incluso una pequeña población de estados vibracionales excitados dominaría este proceso. [19] [3]Para determinar si la tunelización está involucrada en la KIE de una reacción con H o D, se consideran algunos criterios:
También para las reacciones donde los isótopos incluyen H, D y T, un criterio de tunelización son las relaciones de Swain-Schaad que comparan las constantes de velocidad ( k ) de las reacciones donde se intercambian H, D o T:
En reacciones orgánicas, este efecto de tunelización de protones se ha observado en reacciones como la desprotonación y yodación de nitropropano con una base de piridina impedida [26] con un KIE informado de 25 a 25 °C:
y en un desplazamiento de hidrógeno 1,5-sigmatrópico , [27] aunque se observa que es difícil extrapolar valores experimentales obtenidos a alta temperatura a temperaturas más bajas: [28] [29]
Desde hace tiempo se ha especulado que la alta eficiencia de la catálisis enzimática en las reacciones de transferencia de iones protón o hidruro podría deberse en parte al efecto de tunelización de la mecánica cuántica. El entorno en el sitio activo de una enzima coloca al átomo donador y al aceptor cerca de la distancia óptima de tunelización, donde las cadenas laterales de aminoácidos pueden "forzar" al átomo donador y al aceptor a acercarse mediante interacciones electrostáticas y no covalentes. También es posible que la enzima y su entorno hidrofóbico inusual dentro de un sitio de reacción proporcionen una vibración que promueva la tunelización. [30] Los estudios sobre la cetoesteroide isomerasa han proporcionado evidencia experimental de que la enzima realmente mejora el movimiento acoplado/tunelización de hidrógeno al comparar los KIE primarios y secundarios de la reacción en condiciones catalizadas por enzimas y no catalizadas por enzimas. [31]
Existen muchos ejemplos de tunelización de protones en reacciones catalizadas por enzimas que fueron descubiertas por KIE. Un ejemplo bien estudiado es la metilamina deshidrogenasa, donde se han observado grandes KIE primarios de 5 a 55 para el paso de transferencia de protones. [32]
Otro ejemplo de la contribución del efecto túnel a la transferencia de protones en reacciones enzimáticas es la reacción llevada a cabo por la alcohol deshidrogenasa . Los KIE competitivos para el paso de transferencia de hidrógeno a 25 °C dieron como resultado 3,6 y 10,2 para los KIE primarios y secundarios, respectivamente. [33]
Los efectos isotópicos expresados con las ecuaciones dadas anteriormente sólo se refieren a reacciones que pueden describirse con cinética de primer orden . En todos los casos en los que esto no sea posible, se deben tener en cuenta los efectos isotópicos transitorios utilizando las ecuaciones GEBIK y GEBIF. [34]
Simmons y Hartwig se refieren a los siguientes tres casos como los principales tipos de experimentos KIE que involucran funcionalización del enlace CH: [5]
En este experimento, las constantes de velocidad para el sustrato normal y su análogo marcado isotópicamente se determinan de forma independiente, y el KIE se obtiene como una relación de los dos. La precisión del KIE medido está severamente limitada por la precisión con la que se puede medir cada una de estas constantes de velocidad. Además, reproducir las condiciones exactas en las dos reacciones paralelas puede ser muy difícil. Sin embargo, una medición de un gran efecto isotópico cinético a través de la comparación directa de las constantes de velocidad es indicativa de que la escisión del enlace CH se produce en el paso determinante de la velocidad. (Un valor menor podría indicar un efecto isotópico debido a un preequilibrio, de modo que la escisión del enlace CH se produce en algún momento antes del paso determinante de la velocidad).
Este tipo de experimento utiliza los mismos sustratos que en el experimento A, pero se les permite reaccionar en el mismo recipiente, en lugar de en dos recipientes separados. La KIE en este experimento se determina por la cantidad relativa de productos formados a partir de la funcionalización de CH frente a CD (o se puede inferir a partir de las cantidades relativas de materiales de partida que no reaccionaron). Se debe detener la reacción antes de que se complete para observar la KIE (consulte la sección Evaluación a continuación). Generalmente, la reacción se detiene en una conversión baja (~5 a 10% de conversión) o se utiliza un gran exceso (> 5 equiv.) de la mezcla isotópica. Este tipo de experimento garantiza que las funcionalizaciones de los enlaces CH y CD se produzcan exactamente en las mismas condiciones, y la proporción de productos de las funcionalizaciones de los enlaces CH y CD se puede medir con mucha mayor precisión que las constantes de velocidad en el experimento A. Además, solo se requiere una única medición de las concentraciones de producto de una única muestra. Sin embargo, un efecto isotópico cinético observado en este experimento es más difícil de interpretar, ya que puede significar que la escisión del enlace CH ocurre durante el paso que determina la velocidad o en un paso que determina el producto que sigue al paso que determina la velocidad. La ausencia de un KIE, al menos según Simmons y Hartwig, es no obstante indicativa de que la escisión del enlace CH no ocurre durante el paso que determina la velocidad.
Este tipo de experimento es análogo al Experimento B, excepto que esta vez hay una competencia intramolecular por la funcionalización del enlace CH o CD. En la mayoría de los casos, el sustrato posee un grupo director (DG) entre los enlaces CH y CD. El cálculo del KIE de este experimento y su interpretación siguen las mismas consideraciones que las del Experimento B. Sin embargo, los resultados de los Experimentos B y C diferirán si la unión irreversible del sustrato que contiene el isótopo tiene lugar en el Experimento B antes de la escisión del enlace CH o CD. En tal escenario, se puede observar un efecto isotópico en el Experimento C (donde la elección del isótopo puede tener lugar incluso después de la unión del sustrato) pero no en el Experimento B (ya que la elección de si se escinde el enlace CH o CD ya se hace tan pronto como el sustrato se une irreversiblemente). A diferencia del Experimento B, no es necesario detener la reacción en un consumo bajo de material de partida isotópico para obtener un k H / k D preciso , ya que la relación de H y D en el material de partida es 1:1, independientemente del grado de conversión.
Un ejemplo de activación no CH de diferentes efectos isotópicos observados en el caso de competencia intermolecular (Experimento B) e intramolecular (Experimento C) es la fotólisis de difenildiazometano en presencia de t -butilamina. Para explicar este resultado, se propuso la formación de difenilcarbeno, seguida de un ataque nucleofílico irreversible por t -butilamina. Debido a que hay poca diferencia isotópica en la tasa de ataque nucleofílico, el experimento intermolecular resultó en un KIE cercano a 1. En el caso intramolecular, sin embargo, la proporción de productos está determinada por la transferencia de protones que ocurre después del ataque nucleofílico, un proceso que tiene un KIE sustancial de 2,6. [35]

Por lo tanto, los experimentos A, B y C darán resultados con distintos niveles de precisión y requerirán diferentes configuraciones experimentales y formas de analizar los datos. Como resultado, la viabilidad de cada tipo de experimento depende del perfil cinético y estequiométrico de la reacción, así como de las características físicas de la mezcla de reacción (por ejemplo, homogénea frente a heterogénea). Además, como se señaló en el párrafo anterior, los experimentos proporcionan datos de KIE para diferentes pasos de una reacción de varios pasos, dependiendo de las ubicaciones relativas del paso limitante de la velocidad, los pasos determinantes del producto y/o el paso de escisión de CH/D.
Los ejemplos hipotéticos que se muestran a continuación ilustran situaciones comunes. Considere el siguiente diagrama de coordenadas de reacción. Para una reacción con este perfil, los tres experimentos (A, B y C) producirán una KIE primaria significativa:

Por otra parte, si una reacción sigue el siguiente perfil de energía, en el que la escisión del enlace CH o CD es irreversible pero ocurre después del paso determinante de la velocidad (RDS), no se observará una KIE significativa con el Experimento A, ya que la velocidad general no se ve afectada por la sustitución isotópica. Sin embargo, el paso de escisión irreversible del enlace CH dará una KIE primaria con los otros dos experimentos, ya que el segundo paso aún afectaría la distribución del producto. Por lo tanto, con los Experimentos B y C, es posible observar la KIE incluso si la escisión del enlace CH o CD no ocurre en el paso determinante de la velocidad, sino en el paso determinante del producto.

Una gran parte de la KIE surge de las diferencias vibracionales de la ZPE entre el estado fundamental del reactivo y el estado de transición que varían entre el reactivo y su análogo sustituido isotópicamente. Si bien se pueden realizar cálculos complejos de KIE mediante química computacional, gran parte del trabajo realizado es de orden más simple e implica la investigación de si determinadas sustituciones isotópicas producen una KIE detectable o no. Los cambios vibracionales de la sustitución isotópica en átomos alejados del sitio donde ocurre la reacción tienden a cancelarse entre el reactivo y el estado de transición. Por lo tanto, la presencia de una KIE indica que el átomo marcado isotópicamente está en el sitio de reacción o muy cerca de él.
La ausencia de un efecto isotópico es más difícil de interpretar: puede significar que el átomo marcado isotópicamente está lejos del sitio de reacción, pero también puede significar que hay ciertos efectos compensatorios que conducen a la falta de un KIE observable. Por ejemplo, las diferencias entre el reactivo y los ZPE del estado de transición pueden ser idénticas entre el reactivo normal y su versión marcada isotópicamente. Alternativamente, puede significar que la sustitución isotópica está en el sitio de reacción, pero los cambios vibracionales asociados con los enlaces a este átomo ocurren después del paso que determina la velocidad. Tal caso se ilustra en el siguiente ejemplo, en el que ABCD representa el esqueleto atómico de una molécula.
Suponiendo condiciones de estado estable para el intermedio ABC, la velocidad general de reacción es la siguiente:
Si el primer paso es determinar la velocidad, esta ecuación se reduce a:
O si el segundo paso es determinar la velocidad, la ecuación se reduce a:
En la mayoría de los casos, la sustitución isotópica en A, especialmente si se trata de un átomo pesado, no alterará k 1 o k 2 , pero lo más probable es que altere k 3 . Por lo tanto, si el primer paso es determinante de la velocidad, no habrá un efecto isotópico cinético observable en la reacción general con marcaje isotópico de A, pero lo habrá si el segundo paso es determinante de la velocidad. Para los casos intermedios donde ambos pasos tienen velocidades comparables, la magnitud del efecto isotópico cinético dependerá de la relación entre k 3 y k 2 .
La sustitución isotópica de D alterará k 1 y k 2 sin afectar a k 3 . La KIE siempre será observable con esta sustitución ya que k 1 aparece en la expresión de velocidad simplificada independientemente de qué paso determine la velocidad, pero será menos pronunciada si el segundo paso determina la velocidad debido a cierta cancelación entre los efectos isotópicos en k 1 y k 2 . Este resultado está relacionado con el hecho de que los efectos isotópicos de equilibrio suelen ser más pequeños que los KIE.
La sustitución isotópica de B alterará claramente k 3 , pero también puede alterar k 1 en menor medida si las vibraciones del enlace BC se ven afectadas en el estado de transición del primer paso. Por lo tanto, puede haber un pequeño efecto isotópico incluso si el primer paso es determinante de la velocidad.
Esta consideración hipotética revela cómo la observación de los KIE puede utilizarse para investigar los mecanismos de reacción. La existencia de un KIE es indicativa de un cambio en la constante de fuerza vibracional de un enlace asociado con el átomo marcado isotópicamente en el paso de control de velocidad o antes de él. Se pueden utilizar cálculos intrincados para aprender una gran cantidad de detalles sobre el estado de transición a partir de los efectos isotópicos cinéticos observados. Sin embargo, más comúnmente, el mero conocimiento cualitativo de que un enlace asociado con el átomo marcado isotópicamente se altera de una determinada manera puede ser muy útil. [36]En las reacciones de competencia, la KIE se calcula a partir de las proporciones de productos isotópicos o reactivos restantes después de la reacción, pero estas proporciones dependen en gran medida del grado de finalización de la reacción. La mayoría de las veces, el sustrato isotópico consiste en moléculas marcadas en una posición específica y sus contrapartes ordinarias no marcadas. [8] También se puede, en el caso de las KIE de 13 C, así como en casos similares, confiar simplemente en la abundancia natural del carbono isotópico para los experimentos de KIE, eliminando la necesidad de marcado isotópico. [37] Los dos sustratos isotópicos reaccionarán a través del mismo mecanismo, pero a diferentes velocidades. La proporción entre las cantidades de las dos especies en los reactivos y los productos cambiará así gradualmente a lo largo de la reacción, y este cambio gradual se puede tratar de la siguiente manera: [8] Supongamos que dos moléculas isotópicas, A 1 y A 2 , experimentan reacciones de competencia irreversibles:
Se ha determinado que el KIE para este escenario es:
Donde F 1 y F 2 se refieren a la fracción de conversiones para las especies isotópicas A 1 y A 2 , respectivamente.
En este tratamiento, se supone que todos los demás reactivos no son isotópicos. Suponiendo además que la reacción es de primer orden con respecto al sustrato isotópico A, se puede escribir la siguiente expresión general de velocidad para ambas reacciones:
Dado que f([B],[C],...) no depende de la composición isotópica de A, se puede resolver en ambas expresiones de velocidad con A 1 y A 2 , y las dos se pueden igualar para derivar las siguientes relaciones:
Donde [A 1 ] 0 y [A 2 ] 0 son las concentraciones iniciales de A 1 y A 2 , respectivamente. Esto conduce a la siguiente expresión de KIE:
Lo cual también puede expresarse en términos de cantidades fraccionarias de conversión de las dos reacciones, F 1 y F 2 , donde 1-F n =[A n ]/[A n ] 0 para n = 1 o 2, de la siguiente manera:

En cuanto a encontrar los KIE, las mezclas de sustratos que contienen isótopos estables se pueden analizar con un espectrómetro de masas, que produce las proporciones de las moléculas isotópicas en el sustrato inicial (definido aquí como [A 2 ] 0 /[A 1 ] 0 =R 0 ), en el sustrato después de alguna conversión ([A 2 ]/[A 1 ]=R) o en el producto ([P 2 ]/[P 1 ]=R P ). Cuando una de las especies, p. ej. 2, es un radioisótopo, su mezcla con las otras especies también se puede analizar por su radiactividad, que se mide en actividades molares que son proporcionales a [A 2 ] 0 / ([A 1 ] 0 +[A 2 ] 0 ) ≈ [A 2 ] 0 /[A 1 ] 0 = R 0 en el sustrato inicial, [A 2 ] / ([A 1 ]+[A 2 ]) ≈ [A 2 ]/[A 1 ] = R en el sustrato después de alguna conversión, y [R 2 ] / ([R 1 ]+[R 2 ]) ≈ [R 2 ]/[R 1 ] = R P , de modo que se pueden medir las mismas proporciones que en el otro caso siempre que el radioisótopo esté presente en cantidades trazadoras. Dichas proporciones también se pueden determinar utilizando espectroscopia de RMN. [38]
Cuando se sigue la composición del sustrato, se puede derivar la siguiente expresión de KIE en términos de R 0 y R :
Tomando la relación de R y R 0 utilizando la expresión derivada previamente para F 2 , se obtiene:
El enriquecimiento isotópico del material de partida se puede calcular a partir de la dependencia de R/R 0 en F 1 para varios KIE, lo que da como resultado la siguiente figura. Debido a la dependencia exponencial, incluso valores muy bajos de KIE conducen a grandes cambios en la composición isotópica del material de partida a altas conversiones.

Cuando se siguen los productos, el KIE se puede calcular utilizando la relación de productos R P junto con R 0 de la siguiente manera:
La medición de KIE en abundancia natural es un método general simple para medir KIE para reacciones químicas realizadas con materiales de abundancia natural . Esta técnica para medir KIE supera muchas limitaciones de los métodos de medición de KIE anteriores. Las mediciones de KIE de materiales marcados isotópicamente requieren una nueva síntesis para cada material marcado isotópicamente (un proceso a menudo prohibitivamente difícil), una reacción de competencia y un análisis. [5] La medición de KIE en abundancia natural evita estos problemas aprovechando técnicas cuantitativas de alta precisión ( espectroscopia de resonancia magnética nuclear , espectrometría de masas de relación isotópica ) para medir selectivamente el fraccionamiento cinético de isótopos , ya sea en el producto o en el material de partida para una reacción química determinada .
La espectroscopia de resonancia magnética nuclear (RMN) cuantitativa de pulso único es un método adecuado para medir el fraccionamiento cinético de isótopos para mediciones de KIE de abundancia natural. Pascal et al. se inspiraron en estudios que demostraban variaciones dramáticas de deuterio dentro de compuestos idénticos de diferentes fuentes y plantearon la hipótesis de que la RMN podría usarse para medir KIE de 2 H en abundancia natural. [39] [40] Pascal y colaboradores probaron su hipótesis estudiando la reacción de inserción de dimetil diazomalonato en ciclohexano . Pascal et al. midieron un KIE de 2,2 usando RMN de 2 H para materiales de abundancia natural. [40]

Singleton y colaboradores demostraron la capacidad de las mediciones de KIE de abundancia natural basadas en RMN de 13 C para estudiar el mecanismo de la cicloadición [4 + 2] de isopreno con anhídrido maleico . [37] Estudios previos de Gajewski sobre materiales enriquecidos isotópicamente observaron resultados de KIE que sugerían un estado de transición asincrónico, pero siempre fueron consistentes, dentro del error, para un mecanismo de reacción perfectamente sincrónico . [41]

Este trabajo de Singleton et al. estableció la medición de múltiples KIE de 13 C dentro del diseño de un único experimento. Estas mediciones de KIE de 2 H y 13 C determinadas en abundancia natural encontraron que los hidrógenos "internos" del dieno experimentan un KIE de 2 H más pronunciado que los hidrógenos "externos" y que el C1 y el C4 experimentan un KIE significativo. Estas observaciones clave sugieren un mecanismo de reacción asincrónico para la cicloadición de isopreno con anhídrido maleico .
Las limitaciones para determinar los KIE en abundancia natural utilizando RMN son que el material recuperado debe tener una cantidad y pureza adecuadas para el análisis de RMN (la señal de interés debe ser distinta de otras señales), la reacción de interés debe ser irreversible y el mecanismo de reacción no debe cambiar mientras dure la reacción química .
Los detalles experimentales para el uso de RMN cuantitativa de pulso único para medir KIE en abundancia natural son los siguientes: el experimento debe realizarse en condiciones cuantitativas que incluyan un tiempo de relajación de 5 T 1 , un ángulo de giro de 90° medido, una resolución digital de al menos 5 puntos en un pico y una relación señal:ruido mayor que 250. El FID bruto se llena con ceros hasta al menos 256K puntos antes de la transformada de Fourier. Los espectros de RMN se ponen en fase y luego se tratan con una corrección de línea base de orden cero sin ninguna corrección de inclinación. Las integraciones de señales se determinan numéricamente con una tolerancia mínima para cada señal integrada. [37] [ aclaración necesaria ]
Colletto et al. desarrollaron una β-arilación regioselectiva de benzo[b]tiofenos a temperatura ambiente con yoduros de arilo como socios de acoplamiento y buscaron comprender el mecanismo de esta reacción realizando mediciones de KIE de abundancia natural a través de RMN de pulso único. [42]



La observación de un efecto isotópico primario de 13 C en C3, un efecto isotópico inverso de 2 H, un efecto isotópico secundario de 13 C en C2 y la falta de un efecto isotópico de 2 H en C2; llevó a Colletto et al. a sugerir un mecanismo de reacción de tipo Heck para la β -arilación regioselectiva de benzo[b]tiofenos a temperatura ambiente con yoduros de arilo como socios de acoplamiento. [42]
Frost et al. buscaron comprender los efectos de los aditivos de ácido de Lewis en el mecanismo de activación del enlace CN catalizado por paladio enantioselectivo utilizando mediciones de KIE de abundancia natural mediante RMN de pulso único. [43]


El 13 C KIE primario observado en ausencia de BPh 3 sugiere un mecanismo de reacción con oxidación cis limitante de la velocidad en el enlace C–CN de la cianoformamida. La adición de BPh 3 provoca una disminución relativa en el 13 C KIE observado, lo que llevó a Frost et al. a sugerir un cambio en el paso limitante de la velocidad de la oxidación cis a la coordinación del paladio con la cianoformamida. [43]
Aunque las mediciones de KIE en abundancia natural son una herramienta poderosa para comprender los mecanismos de reacción, las cantidades de material necesarias para el análisis pueden hacer que esta técnica sea inaccesible para reacciones que utilizan reactivos costosos o materiales de partida inestables. Para mitigar estas limitaciones, Jacobsen y sus colaboradores desarrollaron la transferencia de polarización de 1 H a 13 C como un medio para reducir el tiempo y el material requerido para las mediciones de KIE en abundancia natural. La mejora sin distorsión por transferencia de polarización (DEPT) aprovecha la mayor relación giromagnética de 1 H sobre 13 C, para mejorar teóricamente la sensibilidad de la medición en un factor de 4 o disminuir el tiempo del experimento en un factor de 16. Este método para la medición de isótopos cinéticos en abundancia natural es favorable para el análisis de reacciones que contienen materiales de partida inestables y catalizadores o productos que son relativamente costosos. [44]
Jacobsen y colaboradores identificaron la glicosilación de galactosa catalizada por tiourea como una reacción que cumplía ambos criterios antes mencionados (materiales costosos y sustratos inestables) y era una reacción con un mecanismo poco comprendido. [45] La glicosilación es un caso especial de sustitución nucleofílica que carece de una definición clara entre el carácter mecanístico S N 1 y S N 2. La presencia del oxígeno adyacente al sitio de desplazamiento (es decir, C1) puede estabilizar la carga positiva. Esta estabilización de carga puede hacer que cualquier vía concertada potencial se vuelva asincrónica y se aproxime a intermediarios con carácter de oxocarbenio del mecanismo S N 1 para la glicosilación.


Jacobsen y sus colaboradores observaron pequeños KIE normales en C1, C2 y C5, lo que sugiere un carácter oxocarbenio significativo en el estado de transición y un mecanismo de reacción asincrónico con un gran grado de separación de carga.
La espectrometría de masas de relación isotópica de alta precisión (IRMS) es otro método para medir el fraccionamiento cinético de isótopos para mediciones de KIE de abundancia natural. Widlanski y colaboradores demostraron 34 S KIE en mediciones de abundancia natural para la hidrólisis de monoésteres de sulfato . Su observación de un gran KIE sugiere que la escisión del enlace SO controla la velocidad y probablemente descarta un mecanismo de reacción asociado . [46]

La principal limitación para determinar los KIE en abundancia natural utilizando IRMS es la degradación selectiva del sitio requerida sin fraccionamiento isotópico en una molécula pequeña analizable, una tarea no trivial. [37]
Los KIE primarios de hidrógeno se refieren a casos en los que se forma o se rompe un enlace con el hidrógeno marcado isotópicamente en un paso determinante de la velocidad y/o del producto de una reacción. [5] Estos son los KIE medidos con mayor frecuencia, y gran parte de la teoría cubierta anteriormente se refiere a los KIE primarios. Cuando hay evidencia adecuada de que la transferencia del hidrógeno marcado ocurre en el paso determinante de la velocidad de una reacción, si se observa un KIE bastante grande, por ejemplo, k H /k D de al menos 5-6 o k H /k T alrededor de 10-13 a temperatura ambiente, es bastante probable que la transferencia de hidrógeno sea lineal y que el hidrógeno esté ubicado bastante simétricamente en el estado de transición. Por lo general, no es posible hacer comentarios sobre las contribuciones de la tunelización al efecto isotópico observado a menos que el efecto sea muy grande. Si el KIE primario no es tan grande, generalmente se considera que es indicativo de una contribución significativa del movimiento de átomos pesados a la coordenada de reacción, aunque también puede significar que la transferencia de hidrógeno sigue una vía no lineal. [8]
Los efectos isotópicos secundarios del hidrógeno o efectos isotópicos secundarios de hidrógeno (EIS) surgen en casos en los que la sustitución isotópica está alejada del enlace que se está rompiendo. No obstante, el átomo alejado influye en las vibraciones internas del sistema, que a través de cambios en la energía del punto cero (EPC) afectan las velocidades de las reacciones químicas. [47] Dichos efectos se expresan como proporciones de la velocidad del isótopo ligero con respecto a la del isótopo pesado y pueden ser efectos "normales" (proporción ≥ 1) o "inversos" (proporción < 1). [48] Los EIS se definen como efectos isotópicos secundarios α, β (etc.) donde dichos prefijos se refieren a la posición de la sustitución isotópica en relación con el centro de reacción (véase carbono alfa y beta ). [49] El prefijo α se refiere al isótopo asociado con el centro de reacción y el prefijo β se refiere al isótopo asociado con un átomo vecino al centro de reacción, y así sucesivamente.
En química orgánica física, el SKIE se analiza en términos de efectos electrónicos como la inducción, la hibridación de enlaces o la hiperconjugación . [50] Estas propiedades están determinadas por la distribución de electrones y dependen de la longitud y los ángulos de enlace promedio vibracional que no se ven muy afectados por la sustitución isotópica. Por lo tanto, el uso del término "efecto isotópico electrónico", aunque legítimo, se desaconseja ya que puede malinterpretarse como que sugiere que el efecto isotópico es de naturaleza electrónica en lugar de vibracional. [49]
Los SKIE se pueden explicar en términos de cambios en la hibridación orbital. Cuando la hibridación de un átomo de carbono cambia de sp 3 a sp 2 , se ven afectados varios modos vibracionales (estiramientos, flexión en el plano y fuera del plano). La flexión en el plano y fuera del plano en un carbono hibridado sp 3 son similares en frecuencia debido a la simetría de un carbono hibridado sp 3 . En un carbono hibridado sp 2 la flexión en el plano es mucho más rígida que la flexión fuera del plano, lo que resulta en una gran diferencia en la frecuencia, la ZPE y, por lo tanto, el SKIE (que existe cuando hay una diferencia en la ZPE del reactivo y el estado de transición). [19] El cambio máximo teórico causado por la diferencia de frecuencia de flexión se ha calculado como 1,4. [19]
Cuando el carbono sufre una reacción que cambia su hibridación de sp 3 a sp 2 , la constante de fuerza de flexión fuera del plano en el estado de transición es más débil ya que está desarrollando el carácter sp 2 y se observa un SKIE "normal" con valores típicos de 1,1 a 1,2. [19] Por el contrario, cuando la hibridación del carbono cambia de sp 2 a sp 3 , las constantes de fuerza de flexión fuera del plano en el estado de transición aumentan y se observa un SKIE inverso con valores típicos de 0,8 a 0,9. [19]
De manera más general, el SKIE para reacciones reversibles puede ser "normal" en un sentido e "inverso" en el otro si el enlace en el estado de transición está a mitad de camino en rigidez entre el sustrato y el producto, o pueden ser "normales" en ambos sentidos si el enlace es más débil en el estado de transición, o "inverso" en ambos sentidos si el enlace es más fuerte en el estado de transición que en cualquiera de los reactivos. [48]
Un ejemplo de un SKIE α "inverso" se puede ver en el trabajo de Fitzpatrick y Kurtz, quienes utilizaron dicho efecto para distinguir entre dos vías propuestas para la reacción de la d-aminoácido oxidasa con aniones nitroalcano . [51] La vía A implicaba un ataque nucleofílico sobre la coenzima flavina adenina dinucleótido (FAD), mientras que la vía B implica un intermediario de radicales libres. Como la vía A da como resultado que el carbono intermedio cambie la hibridación de sp 2 a sp 3, se espera un SKIE "inverso". Si ocurre la vía B, entonces no se debería observar SKIE ya que el intermediario de radicales libres no cambia la hibridación. Se observó un SKIE de 0,84 y la vía A se verificó como se muestra en el esquema a continuación.
Otro ejemplo de SKIE es la oxidación de alcoholes bencílicos por dimetildioxirano, en la que se propusieron tres estados de transición para diferentes mecanismos. Nuevamente, al considerar cómo y si los átomos de hidrógeno estaban involucrados en cada uno, los investigadores predijeron si esperarían o no un efecto de sustitución isotópica de ellos. Luego, el análisis de los datos experimentales de la reacción les permitió elegir qué vía era la más probable en función del efecto isotópico observado. [52]
Los efectos de los isótopos de hidrógeno secundarios de los hidrógenos de metileno también se utilizaron para demostrar que la reorganización de Cope en 1,5-hexadieno sigue una vía de reorganización de enlace concertada, y no una de las vías de radicales alilo o 1,4-diilo propuestas alternativamente, todas las cuales se presentan en el siguiente esquema. [53]

Mecanismos alternativos para la reorganización de Cope del 1,5-hexadieno: (de arriba hacia abajo), vía del radical alilo, vía concertada sincrónica y vía del 1,4-diilo. Se ha descubierto que la vía predominante es la del medio, que tiene seis electrones π deslocalizados correspondientes a un intermedio aromático. [53]
El efecto isotópico estérico (EIE) es un SKIE que no implica la formación o ruptura de enlaces. Este efecto se atribuye a las diferentes amplitudes vibracionales de los isotopólogos . [54] Un ejemplo de dicho efecto es la racemización de 9,10-dihidro-4,5-dimetilfenantreno. [55] La menor amplitud de vibración para 2 H que para 1 H en enlaces C– 1 H, C– 2 H, da como resultado un radio de van der Waals o tamaño efectivo menor además de una diferencia en el ZPE entre los dos. Cuando hay un mayor volumen efectivo de moléculas que contienen uno sobre el otro, esto puede manifestarse por un efecto estérico en la constante de velocidad. Para el ejemplo anterior, 2 H racemiza más rápido que 1 H, lo que resulta en un EIE. Bartell desarrolló un modelo para el EIE. [56] Una SIE suele ser pequeña, a menos que las transformaciones pasen por un estado de transición con un impedimento estérico severo, como en el proceso de racemización que se muestra arriba.
Otro ejemplo de SIE se encuentra en la reacción de deslizamiento de rotaxanos. El 2H, debido a su menor tamaño efectivo, permite un paso más fácil de los tapones a través del macrociclo, lo que resulta en un deslizamiento más rápido de los rotaxanos deuterados . [57]
Se conocen reacciones en las que la especie deuterada reacciona más rápido que la no deuterada, y se dice que estos casos exhiben KIE inversas (IKIE). Las IKIE se observan a menudo en la eliminación reductora de hidruros de metales alquílicos, por ejemplo ( (Me 2 NCH 2 ) 2 )PtMe(H). [b] En tales casos, el enlace CD en el estado de transición, una especie agóstica , está altamente estabilizado en relación con el enlace C–H. [58]
Un efecto inverso también puede ocurrir en una reacción de múltiples pasos si la constante de velocidad general depende de un preequilibrio previo al paso determinante de la velocidad que tiene un efecto isotópico de equilibrio inverso . Por ejemplo, las velocidades de las reacciones catalizadas por ácido son usualmente 2-3 veces mayores para las reacciones en D 2 O catalizadas por D 3 O + que para las reacciones análogas en H 2 O catalizadas por H 3 O + [4] : 433 Esto puede explicarse por un mecanismo de catálisis específica de iones de hidrógeno de un reactivo R por H 3 O + (o D 3 O + ).
La velocidad de formación de productos es entonces d[P]/dt = k 2 [RH + ] = k 2 K 1 [H 3 O + ][R] = k obs [H 3 O + ][R]. En el primer paso, H 3 O + es normalmente un ácido más fuerte que RH + . La deuteración desplaza el equilibrio hacia la especie ácida más fuertemente ligada RD + en la que el efecto de la deuteración sobre la energía vibracional del punto cero es mayor, de modo que la constante de equilibrio deuterada K 1D es mayor que K 1H . Este efecto isotópico de equilibrio en el primer paso normalmente supera al efecto isotópico cinético en el segundo paso, de modo que hay un efecto isotópico inverso aparente y la constante de velocidad global observada k obs = k 2 K 1 disminuye. [4] : 433
Para que los efectos isotópicos del disolvente sean mensurables, una fracción del disolvente debe tener una composición isotópica diferente a la del resto. Por lo tanto, deben estar disponibles grandes cantidades de las especies isotópicas menos comunes, lo que limita los efectos isotópicos del disolvente observables a las sustituciones isotópicas que involucran hidrógeno. Los efectos isotópicos del disolvente detectables ocurren solo cuando los solutos intercambian hidrógeno con el disolvente o cuando hay una interacción soluto-disolvente específica cerca del sitio de reacción. Ambos fenómenos son comunes para los disolventes próticos, en los que el hidrógeno es intercambiable, y pueden formar interacciones dipolo-dipolo o enlaces de hidrógeno con moléculas polares. [8]
La mayoría de las reacciones orgánicas implican la ruptura y formación de enlaces con el carbono, por lo que es razonable esperar efectos detectables de isótopos de carbono. Sin embargo, cuando se utiliza 13 C como etiqueta, el cambio en la masa del isótopo es solo de ~8%, lo que limita los KIE observables a valores mucho más pequeños que los observables con los efectos de isótopos de hidrógeno.
A menudo, la mayor fuente de error en un estudio que depende de la abundancia natural de carbono es la ligera variación en la abundancia natural de 13 C. Estas variaciones surgen porque los materiales de partida en la reacción son en sí mismos productos de otras reacciones que tienen KIE y, por lo tanto, enriquecen isotópicamente los productos. Para compensar este error cuando se utiliza la espectroscopia de RMN para determinar el KIE, se han propuesto las siguientes pautas: [38]
Si se siguen estas y otras precauciones enumeradas por Jankowski, se pueden lograr KIE con precisiones de tres decimales. [38]
La interpretación de los efectos de los isótopos del carbono suele ser complicada debido a la formación y ruptura simultánea de enlaces con el carbono. Incluso las reacciones que implican solo la ruptura de enlaces del carbono, como las reacciones S N 1 , implican el fortalecimiento de los enlaces restantes con el carbono. En muchas de estas reacciones, los efectos de los isótopos del grupo saliente tienden a ser más fáciles de interpretar. Por ejemplo, las reacciones de sustitución y eliminación en las que el cloro actúa como un grupo saliente son fáciles de interpretar, especialmente porque el cloro actúa como una especie monoatómica sin enlaces internos que compliquen la coordenada de reacción, y tiene dos isótopos estables, 35 Cl y 37 Cl, ambos con alta abundancia. El principal desafío para la interpretación de tales efectos de isótopos es la solvatación del grupo saliente. [8]
Debido a las incertidumbres experimentales, la medición del efecto isotópico puede implicar una incertidumbre significativa. A menudo, los efectos isotópicos se determinan a través de estudios complementarios sobre una serie de isotopómeros. En consecuencia, es bastante útil combinar los efectos isotópicos del hidrógeno con los efectos isotópicos de los átomos pesados. Por ejemplo, la determinación del efecto isotópico del nitrógeno junto con el efecto isotópico del hidrógeno se utilizó para demostrar que la reacción del ion 2-feniletiltrimetilamonio con etóxido en etanol a 40 °C sigue un mecanismo E2, en oposición a mecanismos alternativos no concertados. Se llegó a esta conclusión al demostrar que esta reacción produce un efecto isotópico del nitrógeno, k 14 / k 15 , de 1,0133 ± 0,0002 junto con un KIE de hidrógeno de 3,2 en el hidrógeno saliente. [8]
De manera similar, se utilizó la combinación de efectos de isótopos de nitrógeno e hidrógeno para demostrar que las eliminaciones syn de sales de amonio simples también siguen un mecanismo concertado, lo cual fue una cuestión de debate anteriormente. En las siguientes dos reacciones del ion 2-fenilciclopentiltrimetilamonio con etóxido, ambas de las cuales producen 1-fenilciclopenteno, ambos isómeros exhibieron un efecto de isótopo de nitrógeno k 14 / k 15 a 60 °C. Aunque la reacción del isómero trans, que sigue a la eliminación syn, tiene un KIE de nitrógeno más pequeño (1.0064) que el isómero cis que sufre una eliminación anti (1.0108); ambos resultados son lo suficientemente grandes como para ser indicativos de debilitamiento del enlace CN en el estado de transición que ocurriría en un proceso concertado. [c]
Dado que los KIE surgen de diferencias en la masa isotópica, los KIE observables más grandes están asociados con la sustitución isotópica de 1 H con 2 H (aumento de masa de 2x) o 3 H (aumento de masa de 3x). Los KIE de las proporciones de masas isotópicas pueden ser tan grandes como 36,4 utilizando muones. Han producido el átomo de "hidrógeno" más ligero, 0,11 H (0,113 uma), en el que un electrón orbita un "núcleo" muónico positivo (μ + ) que tiene una masa de 206 electrones. También han preparado el átomo de "hidrógeno" más pesado reemplazando un electrón en helio con un muón negativo μ − para formar Heμ (masa de 4,116 uma). Como μ − es mucho más pesado que un electrón, orbita mucho más cerca del núcleo, protegiendo efectivamente a un protón, haciendo que Heμ se comporte como 4,1 H. Con estos átomos exóticos , se investigó la reacción de H con 1 H 2. Las constantes de velocidad de la reacción de los análogos de hidrógeno más ligeros y más pesados con 1 H 2 se utilizaron luego para calcular k 0,11 / k 4,1 , en la que hay una diferencia de 36,4x en la masa isotópica. Para esta reacción, la sustitución isotópica produce un IKIE, y los autores informan un KIE tan bajo como 1,74 × 10 −4 , que es el KIE más pequeño jamás informado. [59]
La KIE produce una distribución específica de 2 H en los productos naturales, dependiendo de la vía por la que se sintetizaron en la naturaleza. Por tanto, mediante espectroscopia de RMN es fácil detectar si el alcohol del vino se ha fermentado a partir de glucosa o de sacarosa añadida ilegalmente .
Otro mecanismo de reacción que se dilucidó utilizando el KIE es la halogenación del tolueno : [60]
En este estudio particular de "KIE intramolecular", un hidrógeno bencílico sufre una sustitución radicalaria por bromo utilizando N -bromosuccinimida como agente bromante. Se descubrió que el PhCH 3 broma 4,86 veces más rápido que el PhCD 3 (PhC 2 H 3 ). Un KIE elevado de 5,56 está asociado con la reacción de cetonas con bromo e hidróxido de sodio . [61]
En esta reacción, el paso limitante de la velocidad es la formación del enolato por desprotonación de la cetona. En este estudio, la KIE se calcula a partir de las constantes de velocidad de reacción para la 2,4-dimetil-3-pentanona regular y su isómero deuterado mediante mediciones de densidad óptica .
En la catálisis asimétrica, hay casos raros en los que una KIE se manifiesta como una diferencia significativa en la enantioselectividad observada para un sustrato deuterado en comparación con uno no deuterado. Toste y colaboradores informaron un ejemplo en el que un sustrato deuterado produjo una enantioselectividad de 83% ee, en comparación con 93% ee para el sustrato no deuterado. El efecto se utilizó para corroborar datos adicionales de KIE de competencia inter e intramolecular que sugerían la escisión del enlace CH/D en el paso de determinación de enantio. [62]