La administración de genes es el proceso de introducir material genético extraño, como ADN o ARN , en las células huésped . [1] La administración de genes debe alcanzar el genoma de la célula huésped para inducir la expresión genética . [2] La administración exitosa de genes requiere que el gen extraño permanezca estable dentro de la célula huésped y pueda integrarse en el genoma o replicarse independientemente de él. [3] Esto requiere que el ADN extraño se sintetice como parte de un vector , que está diseñado para ingresar a la célula huésped deseada y administrar el transgén al genoma de esa célula. [4] Los vectores utilizados como método para la administración de genes se pueden dividir en dos categorías, virus recombinantes y vectores sintéticos (virales y no virales). [2] [5]
En los eucariotas multicelulares complejos (más específicamente, los weissmanistas ), si el transgén se incorpora a las células de la línea germinal del huésped, la célula huésped resultante puede pasar el transgén a su progenie . Si el transgén se incorpora a las células somáticas , el transgén permanecerá con la línea celular somática y, por lo tanto, con su organismo huésped. [6]
La administración de genes es un paso necesario en la terapia génica para la introducción o el silenciamiento de un gen con el fin de promover un resultado terapéutico en los pacientes y también tiene aplicaciones en la modificación genética de cultivos. Existen muchos métodos diferentes de administración de genes para diversos tipos de células y tejidos. [6]
Los vectores virales surgieron en la década de 1980 como una herramienta para la expresión de transgenes. En 1983, Albert Siegel describió el uso de vectores virales en la expresión de transgenes de plantas, aunque la manipulación viral mediante clonación de ADNc aún no estaba disponible. [7] El primer virus que se utilizó como vector de vacuna fue el virus vaccinia en 1984 como una forma de proteger a los chimpancés contra la hepatitis B. [8] La administración de genes no virales fue reportada por primera vez en 1943 por Avery et al., quienes demostraron el cambio de fenotipo celular a través de la exposición al ADN exógeno . [9]

Existen diversos métodos disponibles para introducir genes en las células huésped. Cuando se introducen genes en bacterias o plantas, el proceso se denomina transformación y cuando se utiliza para introducir genes en animales, se denomina transfección . Esto se debe a que la transformación tiene un significado diferente en relación con los animales, ya que indica la progresión a un estado canceroso. [10] En el caso de algunas bacterias, no se necesitan métodos externos para introducir genes, ya que son capaces de absorber ADN extraño de forma natural . [11] La mayoría de las células requieren algún tipo de intervención para que la membrana celular sea permeable al ADN y permita que el ADN se inserte de forma estable en el genoma del huésped .
Los métodos de administración de genes basados en productos químicos pueden utilizar compuestos naturales o sintéticos para formar partículas que facilitan la transferencia de genes a las células. [2] Estos vectores sintéticos tienen la capacidad de unirse electrostáticamente al ADN o ARN y compactar la información genética para permitir transferencias genéticas más grandes. [5] Los vectores químicos generalmente ingresan a las células por endocitosis y pueden proteger el material genético de la degradación. [6]
Uno de los métodos más simples consiste en alterar el entorno de la célula y luego estresarla mediante un choque térmico . Normalmente, las células se incuban en una solución que contiene cationes divalentes (a menudo cloruro de calcio ) en condiciones de frío, antes de exponerlas a un pulso de calor. El cloruro de calcio altera parcialmente la membrana celular, lo que permite que el ADN recombinante entre en la célula huésped. Se sugiere que la exposición de las células a cationes divalentes en condiciones de frío puede cambiar o debilitar la estructura de la superficie celular, haciéndola más permeable al ADN. Se cree que el pulso de calor crea un desequilibrio térmico a través de la membrana celular, lo que obliga al ADN a entrar en las células a través de los poros celulares o la pared celular dañada.
Otro método sencillo consiste en utilizar fosfato de calcio para unir el ADN y luego exponerlo a células cultivadas. La solución, junto con el ADN, queda encapsulada por las células y una pequeña cantidad de ADN puede integrarse en el genoma. [12]
Los liposomas y polímeros pueden utilizarse como vectores para introducir ADN en las células. Los liposomas con carga positiva se unen al ADN con carga negativa, mientras que los polímeros pueden diseñarse para que interactúen con el ADN. [2] Forman lipoplexos y poliplexos respectivamente, que luego son absorbidos por las células. [13] Los dos sistemas también pueden combinarse. [6] Los vectores no virales basados en polímeros utilizan polímeros para interactuar con el ADN y formar poliplexos. [6]
El uso de nanopartículas orgánicas e inorgánicas diseñadas es otro enfoque no viral para la administración de genes. [14] [15]
La administración artificial de genes puede mediarse mediante métodos físicos que utilizan la fuerza para introducir material genético a través de la membrana celular. [2]

La electroporación es un método para promover la competencia . Las células reciben una descarga eléctrica breve de 10-20 kV /cm, que se cree que crea agujeros en la membrana celular a través de los cuales puede entrar el ADN plasmídico. Después de la descarga eléctrica, los agujeros se cierran rápidamente mediante los mecanismos de reparación de la membrana celular.

Otro método utilizado para transformar células vegetales es la biolística , en la que partículas de oro o tungsteno se recubren con ADN y luego se inyectan en células vegetales jóvenes o embriones vegetales. [16] Parte del material genético ingresa a las células y las transforma. Este método se puede utilizar en plantas que no son susceptibles a la infección por Agrobacterium y también permite la transformación de plástidos vegetales . Las células vegetales también se pueden transformar mediante electroporación, que utiliza una descarga eléctrica para hacer que la membrana celular sea permeable al ADN plasmídico. Debido al daño causado a las células y al ADN, la eficiencia de transformación de la biolística y la electroporación es menor que la transformación agrobacteriana. [17]
La microinyección es cuando se inyecta ADN a través de la envoltura nuclear de la célula directamente al núcleo . [11]
La sonoporación es la permeación transitoria de las membranas celulares asistida por ultrasonidos , generalmente en presencia de microburbujas de gas . [18] La sonoporación permite la entrada de material genético en las células. [19] [20]
La fotoporación es cuando se utilizan pulsos de láser para crear poros en una membrana celular para permitir la entrada de material genético.
La magnetofección utiliza partículas magnéticas complejadas con ADN y un campo magnético externo que concentra las partículas de ácido nucleico en las células objetivo.
Se puede utilizar un efecto capilar hidrodinámico para manipular la permeabilidad celular.
En las plantas, el ADN se inserta a menudo utilizando la recombinación mediada por Agrobacterium , [21] aprovechando la secuencia de ADN-T de Agrobacterium que permite la inserción natural de material genético en las células vegetales. [22] El tejido vegetal se corta en trozos pequeños y se sumerge en un líquido que contiene Agrobacterium suspendido . Las bacterias se unirán a muchas de las células vegetales expuestas por los cortes. La bacteria utiliza la conjugación para transferir un segmento de ADN llamado ADN-T desde su plásmido a la planta. El ADN transferido se dirige al núcleo de la célula vegetal y se integra en el ADN genómico de la planta huésped. El ADN-T del plásmido se integra de forma semialeatoria en el genoma de la célula huésped. [23]
Al modificar el plásmido para que exprese el gen de interés, los investigadores pueden insertar el gen elegido de forma estable en el genoma de la planta. Las únicas partes esenciales del ADN-T son sus dos repeticiones pequeñas (de 25 pares de bases) en el borde, de las cuales al menos una es necesaria para la transformación de la planta. [24] [25] Los genes que se van a introducir en la planta se clonan en un vector de transformación vegetal que contiene la región del ADN-T del plásmido . Un método alternativo es la agroinfiltración . [26] [27]
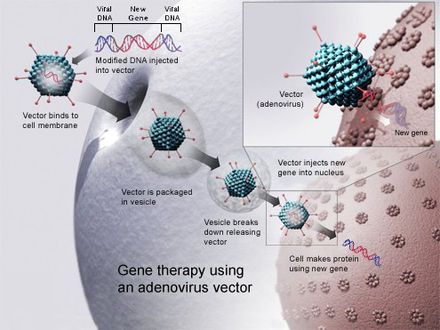
La administración de genes mediada por virus utiliza la capacidad de un virus para inyectar su ADN dentro de una célula huésped y aprovecha la propia capacidad del virus para replicarse e implementar su propio material genético. Los métodos virales de administración de genes tienen más probabilidades de inducir una respuesta inmunitaria, pero tienen una alta eficiencia. [6] La transducción es el proceso que describe la inserción de ADN mediada por virus en la célula huésped. Los virus son una forma particularmente eficaz de administración de genes porque la estructura del virus evita la degradación a través de los lisosomas del ADN que está entregando al núcleo de la célula huésped. [28] En la terapia génica, un gen que se pretende administrar se empaqueta en una partícula viral deficiente en replicación para formar un vector viral . [29] Los virus utilizados para la terapia génica hasta la fecha incluyen retrovirus, adenovirus, virus adenoasociados y virus del herpes simple. Sin embargo, existen desventajas en el uso de virus para administrar genes a las células. Los virus solo pueden administrar fragmentos muy pequeños de ADN a las células, es un trabajo intensivo y existen riesgos de sitios de inserción aleatorios, efectos citopáticos y mutagénesis. [30]
La administración de genes mediante vectores virales utiliza un vector viral para entregar material genético a la célula huésped. Esto se hace utilizando un virus que contiene el gen deseado y eliminando la parte del genoma del virus que es infecciosa. [2] Los virus son eficientes en la entrega de material genético al núcleo de la célula huésped, lo cual es vital para la replicación. [2]
Los virus basados en ARN se desarrollaron debido a la capacidad de transcribir directamente a partir de transcripciones de ARN infecciosas. Los vectores de ARN se expresan rápidamente y se expresan en la forma deseada, ya que no se requiere procesamiento [fuente requerida]. Los vectores retrovirales incluyen oncorretrovirales, lentivirales y virus espumoso humano, que son vectores virales basados en ARN que se transcriben de manera inversa y se integran en el genoma del huésped, lo que permite la expresión de transgenes a largo plazo. [2]
Los vectores virales basados en ADN incluyen Adenoviridae , virus adenoasociados y virus del herpes simple . [2]
Varios de los métodos utilizados para facilitar la administración de genes tienen aplicaciones con fines terapéuticos. La terapia génica utiliza la administración de genes para administrar material genético con el objetivo de tratar una enfermedad o afección en la célula. La administración de genes en entornos terapéuticos utiliza vectores no inmunogénicos capaces de especificidad celular que pueden administrar una cantidad adecuada de expresión transgénica para provocar el efecto deseado. [3]
Los avances en genómica han permitido identificar una variedad de nuevos métodos y genes diana para posibles aplicaciones. Los microarrays de ADN utilizados en una variedad de secuenciación de próxima generación pueden identificar miles de genes simultáneamente, con software analítico que analiza los patrones de expresión génica y los genes ortólogos en especies modelo para identificar la función. [31] Esto ha permitido identificar una variedad de posibles vectores para su uso en terapia génica. Como método para crear una nueva clase de vacuna, se ha utilizado la administración génica para generar un vector biosintético híbrido para administrar una posible vacuna. Este vector supera las barreras tradicionales para la administración génica al combinar E. coli con un polímero sintético para crear un vector que mantiene el ADN plasmídico al mismo tiempo que tiene una mayor capacidad para evitar la degradación por los lisosomas de la célula diana. [32]
{{cite book}}: CS1 maint: location (link)