La paracoccidioidomicosis (PCM) , también conocida como blastomicosis sudamericana , es una infección por hongos que puede presentarse como tipo de boca y piel, tipo linfangítico , tipo con afectación multiorgánica (particularmente pulmones) o tipo mixto. [1] [6] Si hay úlceras en la boca o lesiones en la piel, es probable que la enfermedad esté muy extendida. [1] Es posible que no haya síntomas o que se presente con fiebre , sepsis, pérdida de peso , glándulas grandes o hígado y bazo grandes . [4] [7]
La causa son los hongos del género Paracoccidioides , incluidos Paracoccidioides brasiliensis y Paracoccidioides lutzii , [8] adquiridos al respirar esporas de hongos. [6]
El diagnóstico se realiza mediante muestras de sangre , esputo o piel . [4] La enfermedad puede parecer similar a la tuberculosis , la leucemia y el linfoma. [4] El tratamiento es con antifúngicos ; itraconazol . [1] [7] Para la enfermedad grave, el tratamiento es con anfotericina B seguida de itraconazol o trimetoprima/sulfametoxazol como alternativa. [1] [7]
Es endémica de América Central y del Sur, [9] y se considera un tipo de enfermedad tropical desatendida . [8] En Brasil, la enfermedad causa alrededor de 200 muertes por año. [1]
La infección pulmonar asintomática es común y menos del 5% de las personas infectadas desarrollan enfermedad clínica. [10]
Puede ocurrir como tipo de boca y piel, tipo linfangítico , tipo de afectación de múltiples órganos (particularmente pulmones) o tipo mixto. [1] [6] Si hay úlceras en la boca o lesiones en la piel, es probable que la enfermedad esté muy extendida. [1] Es posible que no haya síntomas o que se presente con fiebre , sepsis, pérdida de peso , glándulas grandes o hígado y bazo grandes . [4] [7]
Se conocen dos presentaciones, en primer lugar la forma aguda o subaguda, que afecta predominantemente a niños y adultos jóvenes, [11] y la forma crónica , que afecta predominantemente a hombres adultos. [12] La mayoría de los casos se infectan antes de los 20 años, aunque los síntomas pueden presentarse muchos años después. [13]
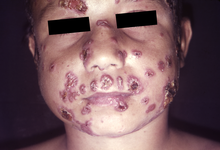
La forma juvenil aguda se caracteriza por síntomas como fiebre, pérdida de peso y malestar junto con agrandamiento de los ganglios linfáticos y agrandamiento del hígado y del bazo . [14] [15] [16] Esta forma se disemina con mayor frecuencia y los síntomas se manifiestan según los órganos involucrados. [14] A menudo hay lesiones en la piel y las membranas mucosas , [17] y en casos graves puede producirse afectación ósea. [14] Esta presentación aguda y grave puede simular tuberculosis , linfoma o leucemia . [17]
La forma crónica se presenta meses o años después de que ocurre la infección inicial y con mayor frecuencia presenta tos seca y dificultad para respirar. [10] Otros síntomas incluyen exceso de salivación , dificultad para tragar y dificultades con el control de la voz . [14] Pueden presentarse lesiones de la mucosa del tracto respiratorio superior, así como aumento de la producción de moco y tos con sangre . [18] La afectación tanto pulmonar como extrapulmonar es común. [14]
Hasta el 70% de los casos tiene afectación de las mucosas, encontrándose a menudo lesiones en la boca, orofaringe , laringe y paladar. Las lesiones clásicas son úlceras granulares dolorosas superficiales , con pequeñas manchas de sangrado. [15]
La paracoccidioidomicosis es causada por dos especies de hongos que pueden existir como moho o levadura dependiendo de la temperatura , P. brasiliensis y P. lutzii . [19] En entornos de suelo protegidos, cerca de fuentes de agua, que se ven alterados de forma natural o por la actividad humana, se ha observado epidemiológicamente (aunque no aislado) P. brasiliensis . [20] Un portador de animales conocido es el armadillo . [13] En el entorno natural, los hongos se encuentran como estructuras filamentosas y desarrollan esporas infecciosas conocidas como conidios . [13]
La transmisión de persona a persona nunca ha sido probada. [21]
Se cree que la infección primaria, aunque no se comprende bien debido a la falta de datos, se produce mediante la inhalación de conidios a través del tracto respiratorio, después de inhalar conidios fúngicos producidos por la forma micelial de P. brasiliensis . [14] [21] Esto ocurre predominantemente en la niñez y la edad adulta temprana, después de la exposición a la actividad agrícola. [13] La infección puede ocurrir mediante inoculación directa en la piel, aunque esto es raro. [15]
Después de la inhalación en los alvéolos , se produce una rápida multiplicación del organismo en el tejido pulmonar, propagándose a veces a través de los sistemas venoso y linfático. [14] Aproximadamente el 2% de las personas desarrollan características clínicas después de la infección asintomática inicial. [15]
El tipo de respuesta inmunitaria determina la manifestación clínica de la infección; los niños y las personas coinfectadas por el VIH desarrollan con mayor frecuencia la enfermedad diseminada aguda/subaguda. [14] La mayoría de los infectados desarrollan una respuesta inmune mediada por células T tipo 1 (T h 1), lo que resulta en alveolitis fibrosante y formación de granulomas compactos que controlan la replicación fúngica e infección latente o asintomática. [13] [14] Luego se cree que permanece latente en lesiones pulmonares residuales y ganglios linfáticos mediastínicos . [21] Una respuesta deficiente de las células Th 1 da como resultado las formas graves de la enfermedad. En estos individuos no se forman granulomas y la persona afectada desarrolla respuestas Th 2 y Th 9, lo que resulta en activación de linfocitos B , niveles elevados de anticuerpos circulantes, eosinofilia e hipergammaglobulinemia . [13]
Posteriormente, la afectación pulmonar ocurre después de una fase latente, que se manifiesta en síntomas del tracto respiratorio superior e infiltrados pulmonares en las imágenes. [15] La forma crónica más común es casi con certeza una reactivación de la enfermedad, [15] y puede convertirse en una cicatrización progresiva de los pulmones (fibrosis pulmonar) . [22]
Puede causar enfermedad en personas con función inmune normal, aunque la inmunosupresión aumenta la agresividad del hongo. Rara vez causa enfermedad en mujeres en edad fértil, probablemente debido al efecto protector del estradiol . [23]
Más del 90% de los casos pueden diagnosticarse con examen histológico directo de tejidos, como esputos, líquido de lavado bronquial, exudados y biopsias . Estudio histopatológico con tinción de plata metenamina de Gomori (GMS) o tinción de hematoxilina y eosina ( H&E ) que revela células de levadura grandes con paredes celulares translúcidas con múltiples yemas. [14]
En la forma juvenil, las anomalías pulmonares se muestran en tomografías computarizadas de alta resolución de los pulmones, mientras que en la forma crónica las radiografías simples pueden mostrar infiltrados intersticiales y alveolares en los campos pulmonares central e inferior. [14]
El cultivo de P. brasiliensis tarda entre 20 y 30 días y requiere múltiples muestras y medios de cultivo. El cultivo inicial puede realizarse a temperatura ambiente; sin embargo, una vez que se observa el crecimiento, se confirma mediante la incubación a 36-37 grados para transformar el hongo en células de levadura. [14]
La detección de anticuerpos es útil tanto para el diagnóstico agudo como para el seguimiento. La inmunodifusión en gel se utiliza habitualmente en zonas endémicas y diagnostica el 95% de los casos con alta especificidad . [14] La fijación del complemento permite medir la gravedad de los casos cuantificando el nivel de anticuerpos y, por lo tanto, es útil para monitorear la respuesta al tratamiento. Sin embargo, sólo es sensible en el 85% de los casos y tiene reacciones cruzadas con H. capsulatum . [14]
La enfermedad puede parecer similar a la tuberculosis , la leucemia y el linfoma [4]
Tanto P. brasiliensis como P. lutzii son susceptibles in vitro a la mayoría de los agentes antifúngicos, a diferencia de otras infecciones fúngicas sistémicas . Las formas leves y moderadas se tratan con itraconazol durante 9 a 18 meses, ya que se ha demostrado que es más eficaz, tiene una duración de tratamiento más corta y es más tolerado. [ cita necesaria ] Se ha demostrado que las bebidas ácidas reducen la absorción de itraconazol. [13] El cotrimoxazol es un agente de segunda línea y se prefiere para aquellas personas con afectación cerebral y durante el embarazo. [13] Para casos graves, está indicado el tratamiento intravenoso con anfotericina B , durante un promedio de 2 a 4 semanas. [13] La prednisolona recetada al mismo tiempo puede reducir la inflamación durante el tratamiento. [13] Los pacientes deben ser tratados hasta la estabilización de los síntomas y el aumento del peso corporal. Se deben proporcionar consejos sobre el apoyo nutricional, así como sobre el tabaquismo y la ingesta de alcohol. La insuficiencia suprarrenal , si se encuentra, se trata con corticosteroides. [24] Los criterios clínicos para la curación incluyen la ausencia o curación de las lesiones, la estabilización del peso corporal y pruebas de autoanticuerpos negativas y negativas. [13] No hay datos suficientes que respalden los beneficios de los medicamentos mencionados anteriormente para tratar la enfermedad. [25]
La paracoccidioidomicosis es endémica en zonas rurales de América Latina, desde el sur de México hasta Argentina, y también se encuentra en Brasil, Colombia, Venezuela, Ecuador y Paraguay. [13] [15] Nunca se ha observado un brote epidémico. [13] Tiene la prevalencia más alta de todas las micosis sistémicas (infecciones fúngicas) en el área. [12] Se ha estimado que hasta el 75% de las personas en áreas endémicas están infectadas con la forma asintomática (hasta 10 millones de personas), y el 2% desarrolla una enfermedad clínicamente significativa. [12] La morbilidad y la mortalidad están fuertemente asociadas con el entorno socioeconómico del paciente, [12] y la mayoría de los pacientes adultos son trabajadores agrícolas varones. [26] Otros factores de riesgo incluyen el tabaquismo, el consumo de alcohol, la coinfección por VIH u otros tipos de inmunosupresión. [21] El 80% de los casos notificados se encuentran en Brasil, en el sureste, el medio oeste y el sur, y se extendieron en la década de 1990 al área del Amazonas. La mayoría de las infecciones restantes se encuentran en Argentina, Colombia y Venezuela. [21] La mayoría de los informes epidemiológicos se han centrado en P. brasliensis , y la epidemiología de P. lutzii no se comprende bien en 2015. [21]
El aumento de casos se ha relacionado con la agricultura y la deforestación en Brasil, la urbanización en áreas urbanas periféricas con infraestructura deficiente, así como con el aumento de la humedad del suelo y del aire. [13] [21] Una tribu indígena brasileña, los Surui, después de cambiar de la agricultura de subsistencia al cultivo de café, mostró tasas de infección más altas que las tribus circundantes. [21]
También ha habido informes en zonas no endémicas con el auge del ecoturismo, en Estados Unidos, Europa y Japón. [15] Todos los casos reportados fueron viajeros que regresaron de regiones endémicas. [21]
La enfermedad de Lutz-Splendore-de Almeida [3] lleva el nombre de los médicos Adolfo Lutz , [27] Alfonso Splendor (1871-1953), un parasitólogo italo-brasileño [28] y Floriano Paulo de Almeida (1898-1977), un brasileño. patólogo especializado en Micología Patológica (Estudio de Hongos Infecciosos), [29] [30] que caracterizó por primera vez la enfermedad en Brasil a principios del siglo XX.
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )