El desarrollo del sistema nervioso , o desarrollo neuronal ( neurodesarrollo ), se refiere a los procesos que generan, dan forma y remodelan el sistema nervioso de los animales, desde las primeras etapas del desarrollo embrionario hasta la edad adulta. El campo del desarrollo neuronal se basa tanto en la neurociencia como en la biología del desarrollo para describir y brindar información sobre los mecanismos celulares y moleculares mediante los cuales se desarrollan los sistemas nerviosos complejos, desde los nematodos y las moscas de la fruta hasta los mamíferos .
Los defectos en el desarrollo neuronal pueden conducir a malformaciones como la holoprosencefalia , y una amplia variedad de trastornos neurológicos , incluyendo paresia y parálisis de las extremidades , trastornos del equilibrio y de la visión, y convulsiones , [1] y en humanos otros trastornos como el síndrome de Rett , el síndrome de Down y la discapacidad intelectual . [2]
El sistema nervioso central (SNC) de los vertebrados se deriva del ectodermo , la capa germinal más externa del embrión. Una parte del ectodermo dorsal se convierte en ectodermo neural, neuroectodermo que forma la placa neural a lo largo del lado dorsal del embrión. [3] [4] Esta es una parte del patrón inicial del embrión (incluido el embrión de invertebrados) que también establece un eje anteroposterior. [5] [6] La placa neural es la fuente de la mayoría de las neuronas y células gliales del SNC. El surco neural se forma a lo largo del eje largo de la placa neural, y la placa neural se pliega para dar lugar al tubo neural . [7] Este proceso se conoce como neurulación . [8] Cuando el tubo está cerrado en ambos extremos, se llena de líquido cefalorraquídeo embrionario. [9] A medida que el embrión se desarrolla, la parte anterior del tubo neural se expande y forma tres vesículas cerebrales primarias , que se convierten en el prosencéfalo ( prosencéfalo ), el mesencéfalo ( mesencéfalo ) y el rombencéfalo ( rombencéfalo ). Estas vesículas simples y tempranas se agrandan y se dividen aún más en el telencéfalo (futura corteza cerebral y ganglios basales ), el diencéfalo (futuro tálamo e hipotálamo ), el mesencéfalo (futuros colículos ), el metencéfalo (futuro puente y cerebelo ) y el mielencéfalo (futuro bulbo raquídeo ). [10] La cámara central llena de LCR es continua desde el telencéfalo hasta el canal central de la médula espinal y constituye el sistema ventricular en desarrollo del SNC. El líquido cefalorraquídeo embrionario difiere del que se forma en etapas posteriores del desarrollo y del LCR adulto; influye en el comportamiento de los precursores neuronales. [9] Debido a que el tubo neural da origen al cerebro y la médula espinal, cualquier mutación en esta etapa del desarrollo puede provocar deformidades fatales como la anencefalia o discapacidades permanentes como la espina bífida . Durante este tiempo, las paredes del tubo neural contienen células madre neurales ., que impulsan el crecimiento del cerebro a medida que se dividen muchas veces. Gradualmente, algunas de las células dejan de dividirse y se diferencian en neuronas y células gliales , que son los principales componentes celulares del SNC. [11] Las neuronas recién generadas migran a diferentes partes del cerebro en desarrollo para autoorganizarse en diferentes estructuras cerebrales. Una vez que las neuronas han alcanzado sus posiciones regionales, extienden axones y dendritas , que les permiten comunicarse con otras neuronas a través de sinapsis . La comunicación sináptica entre neuronas conduce al establecimiento de circuitos neuronales funcionales que median el procesamiento sensorial y motor, y subyacen al comportamiento. [12]
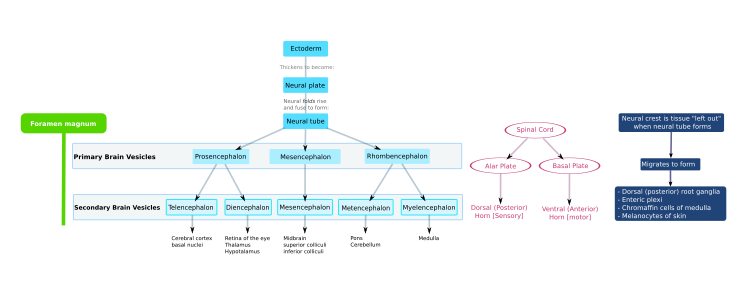
Durante el desarrollo embrionario temprano del vertebrado, el ectodermo dorsal se especifica para dar lugar a la epidermis y al sistema nervioso; una parte del ectodermo dorsal se especifica al ectodermo neural para formar la placa neural que da lugar al sistema nervioso. [3] [13] La conversión del ectodermo indiferenciado en neuroectodermo requiere señales del mesodermo . Al inicio de la gastrulación, las células mesodérmicas presuntas se mueven a través del labio del blastoporo dorsal y forman una capa de mesodermo entre el endodermo y el ectodermo. Las células mesodérmicas migran a lo largo de la línea media dorsal para dar lugar a la notocorda que se desarrolla en la columna vertebral . El neuroectodermo que recubre la notocorda se desarrolla en la placa neural en respuesta a una señal difusible producida por la notocorda. El resto del ectodermo da lugar a la epidermis. La capacidad del mesodermo de convertir el ectodermo suprayacente en tejido neural se denomina inducción neural .
En el embrión temprano, la placa neural se pliega hacia afuera para formar el surco neural . A partir de la futura región del cuello, los pliegues neurales de este surco se cierran para crear el tubo neural . La formación del tubo neural a partir del ectodermo se denomina neurulación . La parte ventral del tubo neural se denomina placa basal ; la parte dorsal se denomina placa alar . El interior hueco se denomina canal neural y los extremos abiertos del tubo neural, llamados neuroporos, se cierran. [14]
Un labio de blastoporo trasplantado puede convertir el ectodermo en tejido neural y se dice que tiene un efecto inductivo. Los inductores neurales son moléculas que pueden inducir la expresión de genes neurales en explantos de ectodermo sin inducir también genes mesodérmicos. La inducción neural se estudia a menudo en embriones de Xenopus, ya que tienen un plan corporal simple y hay buenos marcadores para distinguir entre tejido neural y no neural. Ejemplos de inductores neurales son las moléculas noggin y chordin .
Cuando las células ectodérmicas embrionarias se cultivan a baja densidad en ausencia de células mesodérmicas, experimentan una diferenciación neuronal (expresan genes neuronales), lo que sugiere que la diferenciación neuronal es el destino predeterminado de las células ectodérmicas. En los cultivos de explantes (que permiten interacciones directas entre células), las mismas células se diferencian en epidermis. Esto se debe a la acción de BMP4 (una proteína de la familia TGF-β ) que induce a los cultivos ectodérmicos a diferenciarse en epidermis. Durante la inducción neuronal, el mesodermo dorsal (notocorda) produce noggin y chordin y se difunden en el ectodermo suprayacente para inhibir la actividad de BMP4. Esta inhibición de BMP4 hace que las células se diferencien en células neuronales. La inhibición de la señalización de TGF-β y BMP (proteína morfogenética ósea) puede inducir de manera eficiente el tejido neuronal a partir de células madre pluripotentes . [15]
En una etapa posterior del desarrollo, la parte superior del tubo neural se flexiona a nivel del futuro mesencéfalo, el mesencéfalo , en el ángulo mesencefálico o flexura cefálica . Por encima del mesencéfalo se encuentra el prosencéfalo (futuro prosencéfalo) y por debajo de él se encuentra el rombencéfalo (futuro rombencéfalo).
La placa alar del prosencéfalo se expande para formar el telencéfalo , que da origen a los hemisferios cerebrales , mientras que su placa basal se convierte en el diencéfalo . La vesícula óptica (que finalmente se convertirá en el nervio óptico, la retina y el iris) se forma en la placa basal del prosencéfalo.
En los cordados , el ectodermo dorsal forma todo el tejido neural y el sistema nervioso. La formación de patrones se produce debido a condiciones ambientales específicas: diferentes concentraciones de moléculas de señalización
La mitad ventral de la placa neural está controlada por la notocorda , que actúa como "organizadora". La mitad dorsal está controlada por la placa del ectodermo , que flanquea ambos lados de la placa neural. [16]
El ectodermo sigue una vía predeterminada para convertirse en tejido neural. La evidencia de esto proviene de células individuales cultivadas de ectodermo, que luego forman tejido neural. Se postula que esto se debe a una falta de BMP , que son bloqueadas por el organizador. El organizador puede producir moléculas como folistatina , noggin y chordin que inhiben las BMP.
El tubo neural ventral está modelado por sonic hedgehog (Shh) de la notocorda, que actúa como tejido inductor. Shh derivado de la notocorda envía señales a la placa del suelo e induce la expresión de Shh en la placa del suelo. Shh derivado de la placa del suelo posteriormente envía señales a otras células en el tubo neural y es esencial para la especificación adecuada de los dominios progenitores de las neuronas ventrales. La pérdida de Shh de la notocorda y/o la placa del suelo impide la especificación adecuada de estos dominios progenitores. Shh se une a Patched1 , aliviando la inhibición mediada por Patched de Smoothened , lo que lleva a la activación de la familia Gli de factores de transcripción ( GLI1 , GLI2 y GLI3 ).
En este contexto, Shh actúa como un morfógeno : induce la diferenciación celular en función de su concentración. En concentraciones bajas, forma interneuronas ventrales , en concentraciones más altas induce el desarrollo de neuronas motoras y en concentraciones más altas induce la diferenciación de la placa del suelo. El fracaso de la diferenciación modulada por Shh causa holoprosencefalia .
El tubo neural dorsal está modelado por BMP del ectodermo epidérmico que flanquea la placa neural. Estas inducen interneuronas sensoriales activando las quinasas Sr/Thr y alterando los niveles del factor de transcripción SMAD .
Las señales que controlan el desarrollo neuronal anteroposterior incluyen FGF y ácido retinoico , que actúan en el rombencéfalo y la médula espinal. [17] El rombencéfalo, por ejemplo, está modelado por genes Hox , que se expresan en dominios superpuestos a lo largo del eje anteroposterior bajo el control del ácido retinoico. Los genes 3 ′ (extremo principal 3) en el grupo Hox son inducidos por el ácido retinoico en el rombencéfalo, mientras que los genes Hox 5 ′ (extremo principal 5) no son inducidos por el ácido retinoico y se expresan más posteriormente en la médula espinal. Hoxb-1 se expresa en el rombómero 4 y da lugar al nervio facial . Sin esta expresión de Hoxb-1, surge un nervio similar al nervio trigémino .
La neurogénesis es el proceso por el cual se generan neuronas a partir de células madre neuronales y células progenitoras . Las neuronas son «postmitóticas», lo que significa que nunca volverán a dividirse durante la vida del organismo. [12]
Las modificaciones epigenéticas desempeñan un papel clave en la regulación de la expresión génica en la diferenciación de las células madre neuronales y son fundamentales para la determinación del destino celular en el cerebro de los mamíferos en desarrollo y adultos. Las modificaciones epigenéticas incluyen la metilación de la citosina del ADN para formar 5-metilcitosina y la desmetilación de la 5-metilcitosina . [18] [19] La metilación de la citosina del ADN es catalizada por las metiltransferasas del ADN (DNMT) . La desmetilación de la metilcitosina es catalizada en varios pasos secuenciales por las enzimas TET que llevan a cabo reacciones oxidativas (por ejemplo, 5-metilcitosina a 5-hidroximetilcitosina ) y enzimas de la vía de reparación por escisión de bases del ADN (BER). [18]

La migración neuronal es el método por el cual las neuronas viajan desde su origen o lugar de nacimiento hasta su posición final en el cerebro. Existen varias formas en las que pueden hacerlo, por ejemplo, mediante migración radial o migración tangencial. Se han capturado secuencias de migración radial (también conocida como guía glial) y translocación somal mediante microscopía de lapso de tiempo . [20]

Las células precursoras neuronales proliferan en la zona ventricular del neocórtex en desarrollo , donde la principal célula madre neuronal es la célula glial radial . Las primeras células postmitóticas deben abandonar el nicho de células madre y migrar hacia afuera para formar la preplaca, que está destinada a convertirse en células de Cajal-Retzius y neuronas de la subplaca . Estas células lo hacen por translocación somal. Las neuronas que migran con este modo de locomoción son bipolares y unen el borde delantero del proceso a la piamadre . Luego, el soma se transporta a la superficie de la piamadre mediante nucleocinesis, un proceso por el cual una "jaula" de microtúbulos alrededor del núcleo se alarga y se contrae en asociación con el centrosoma para guiar al núcleo a su destino final. [21]
Las células gliales radiales , cuyas fibras sirven como andamiaje para las células migratorias y como medio de comunicación radial mediada por la actividad dinámica del calcio, [22] [23] actúan como la principal célula madre neuronal excitatoria de la corteza cerebral [24] [25] o se translocan a la placa cortical y se diferencian en astrocitos o neuronas . [26] La translocación somal puede ocurrir en cualquier momento durante el desarrollo. [20]
Las oleadas posteriores de neuronas dividen la preplaca al migrar a lo largo de las fibras gliales radiales para formar la placa cortical. Cada oleada de células migratorias pasa por delante de sus predecesoras formando capas de adentro hacia afuera, lo que significa que las neuronas más jóvenes son las más cercanas a la superficie. [27] [28] Se estima que la migración guiada por la glía representa el 90% de las neuronas migratorias en humanos y aproximadamente el 75% en roedores. [29]
La mayoría de las interneuronas migran tangencialmente a través de múltiples modos de migración para alcanzar su ubicación apropiada en la corteza. Un ejemplo de migración tangencial es el movimiento de las interneuronas desde la eminencia ganglionar hasta la corteza cerebral. Un ejemplo de migración tangencial continua en un organismo maduro, observada en algunos animales, es la corriente migratoria rostral que conecta la zona subventricular y el bulbo olfatorio .
Muchas neuronas que migran a lo largo del eje anteroposterior del cuerpo utilizan tractos axónicos existentes para migrar; esto se llama migración axófila. Un ejemplo de este modo de migración es en las neuronas que expresan GnRH , que hacen un largo viaje desde su lugar de nacimiento en la nariz, a través del prosencéfalo y hacia el hipotálamo. [30] Muchos de los mecanismos de esta migración han sido elaborados, empezando por las señales de guía extracelulares [31] que desencadenan la señalización intracelular. Estas señales intracelulares, como la señalización de calcio , conducen a la dinámica del citoesqueleto de actina [32] y microtúbulos [33] , que producen fuerzas celulares que interactúan con el entorno extracelular a través de proteínas de adhesión celular [34] para provocar el movimiento de estas células.
También existe un método de migración neuronal llamado migración multipolar . [35] [36] Esto se observa en células multipolares, que en el ser humano están abundantemente presentes en la zona intermedia cortical . No se parecen a las células que migran por locomoción o translocación somal. En cambio, estas células multipolares expresan marcadores neuronales y extienden múltiples procesos delgados en varias direcciones independientemente de las fibras gliales radiales. [35]
La supervivencia de las neuronas está regulada por factores de supervivencia, llamados factores tróficos. La hipótesis neurotrófica fue formulada por Victor Hamburger y Rita Levi Montalcini basándose en estudios del sistema nervioso en desarrollo. Victor Hamburger descubrió que implantar una extremidad adicional en el pollo en desarrollo conducía a un aumento en el número de neuronas motoras espinales. Inicialmente pensó que la extremidad adicional inducía la proliferación de neuronas motoras, pero él y sus colegas demostraron más tarde que había una gran cantidad de muertes de neuronas motoras durante el desarrollo normal, y la extremidad adicional impedía esta muerte celular. Según la hipótesis neurotrófica, los axones en crecimiento compiten por cantidades limitadas de factores tróficos derivados del objetivo y los axones que no reciben suficiente apoyo trófico mueren por apoptosis. Ahora está claro que los factores producidos por varias fuentes contribuyen a la supervivencia neuronal.
Gran parte de nuestro conocimiento sobre la formación de sinapsis proviene de estudios en la unión neuromuscular. El transmisor en esta sinapsis es la acetilcolina. El receptor de acetilcolina (AchR) está presente en la superficie de las células musculares antes de la formación de la sinapsis. La llegada del nervio induce la agrupación de los receptores en la sinapsis. McMahan y Sanes demostraron que la señal sinaptogénica se concentra en la lámina basal . También demostraron que la señal sinaptogénica es producida por el nervio e identificaron el factor como Agrina . Agrina induce la agrupación de AchR en la superficie muscular y la formación de sinapsis se interrumpe en ratones knock out de agrina. Agrina transduce la señal a través del receptor MuSK a rapsyn . Fischbach y sus colegas demostraron que las subunidades del receptor se transcriben selectivamente desde los núcleos próximos al sitio sináptico. Esto está mediado por neuregulinas.
En la sinapsis madura, cada fibra muscular está inervada por una neurona motora. Sin embargo, durante el desarrollo, muchas de las fibras están inervadas por múltiples axones. Lichtman y sus colegas han estudiado el proceso de eliminación de sinapsis. [37] Este es un evento dependiente de la actividad. El bloqueo parcial del receptor conduce a la retracción de las terminales presinápticas correspondientes. Más tarde, utilizaron un enfoque conectómico, es decir, rastrearon todas las conexiones entre las neuronas motoras y las fibras musculares, para caracterizar la eliminación de sinapsis del desarrollo a nivel de un circuito completo. El análisis confirmó la reconexión masiva, una disminución de 10 veces en el número de sinapsis, que tiene lugar a medida que los axones podan sus unidades motoras pero agregan más áreas sinápticas en las uniones motoras con las que permanecen en contacto. [38]
La agrina no parece ser un mediador central de la formación de sinapsis del sistema nervioso central y existe un interés activo en identificar señales que median la sinaptogénesis del sistema nervioso central. Las neuronas en cultivo desarrollan sinapsis que son similares a las que se forman in vivo, lo que sugiere que las señales sinaptogénicas pueden funcionar correctamente in vitro. Los estudios de sinaptogénesis del sistema nervioso central se han centrado principalmente en las sinapsis glutamatérgicas. Los experimentos de imagenología muestran que las dendritas son muy dinámicas durante el desarrollo y a menudo inician el contacto con los axones. A esto le sigue el reclutamiento de proteínas postsinápticas al sitio de contacto. Stephen Smith y sus colegas han demostrado que el contacto iniciado por los filopodios dendríticos puede convertirse en sinapsis.
Inducción de la formación de sinapsis por factores gliales: Barres y sus colegas observaron que los factores presentes en los medios acondicionados con glía inducen la formación de sinapsis en cultivos de células ganglionares de la retina. La formación de sinapsis en el SNC está correlacionada con la diferenciación de los astrocitos, lo que sugiere que estos últimos podrían proporcionar un factor sinaptogénico. La identidad de los factores astrocíticos aún no se conoce.
Las neuroliginas y la SynCAM como señales sinaptogénicas: Sudhof, Serafini, Scheiffele y sus colegas han demostrado que las neuroliginas y la SynCAM pueden actuar como factores que inducen la diferenciación presináptica. Las neuroliginas se concentran en el sitio postsináptico y actúan a través de las neurexinas concentradas en los axones presinápticos. La SynCAM es una molécula de adhesión celular que está presente tanto en las membranas presinápticas como en las postsinápticas.
En general, se cree que los procesos de migración neuronal , diferenciación y guía axonal son mecanismos independientes de la actividad y dependen de programas genéticos cableados en las propias neuronas. Sin embargo, los hallazgos de la investigación han implicado un papel para los mecanismos dependientes de la actividad en la mediación de algunos aspectos de estos procesos, como la tasa de migración neuronal, [39] aspectos de la diferenciación neuronal [40] y la búsqueda de rutas axonal. [41] Los mecanismos dependientes de la actividad influyen en el desarrollo de circuitos neuronales y son cruciales para diseñar mapas de conectividad temprana y el refinamiento continuo de las sinapsis que ocurre durante el desarrollo. [42] Hay dos tipos distintos de actividad neuronal que observamos en los circuitos en desarrollo: actividad espontánea temprana y actividad evocada sensorialmente. La actividad espontánea ocurre temprano durante el desarrollo del circuito neuronal incluso cuando no hay entrada sensorial y se observa en muchos sistemas como el sistema visual en desarrollo , [43] [44] el sistema auditivo , [45] [46] el sistema motor , [47] el hipocampo , [48] el cerebelo [49] y el neocórtex . [50]
Técnicas experimentales como el registro electrofisiológico directo, la obtención de imágenes por fluorescencia utilizando indicadores de calcio y las técnicas optogenéticas han arrojado luz sobre la naturaleza y la función de estas primeras explosiones de actividad. [51] [52] Tienen patrones espaciales y temporales distintos durante el desarrollo [53] y se sabe que su ablación durante el desarrollo produce déficits en el refinamiento de la red en el sistema visual. [54] En la retina inmadura , las ondas de potenciales de acción espontáneos surgen de las células ganglionares de la retina y recorren la superficie de la retina en las primeras semanas posnatales. [55] Estas ondas están mediadas por el neurotransmisor acetilcolina en la fase inicial y más tarde por el glutamato . [56] Se cree que instruyen la formación de dos mapas sensoriales: el mapa retinotópico y la segregación específica del ojo. [57] El refinamiento del mapa retinotópico se produce en objetivos visuales posteriores en el cerebro: el colículo superior (SC) y el núcleo geniculado lateral dorsal (LGN). [58] La disrupción farmacológica y los modelos de ratón que carecen de la subunidad β2 del receptor nicotínico de acetilcolina han demostrado que la falta de actividad espontánea conduce a defectos marcados en la retinotopía y la segregación específica del ojo. [57]
Estudios recientes confirman que la microglía , la célula inmune residente del cerebro, establece contactos directos con los cuerpos celulares de las neuronas en desarrollo y, a través de estas conexiones, regula la neurogénesis, la migración, la integración y la formación de redes neuronales de manera dependiente de la actividad. [59]
En el sistema auditivo en desarrollo , la cóclea en desarrollo genera ráfagas de actividad que se propagan a través de las células ciliadas internas y las neuronas ganglionares espirales que transmiten información auditiva al cerebro. [60] La liberación de ATP de las células de soporte desencadena potenciales de acción en las células ciliadas internas . [61] En el sistema auditivo, se cree que la actividad espontánea está involucrada en la formación del mapa tonotópico al segregar los axones de las neuronas cocleares sintonizados con frecuencias altas y bajas. [60] En el sistema motor, las ráfagas periódicas de actividad espontánea son impulsadas por el GABA y el glutamato excitatorios durante las primeras etapas y por la acetilcolina y el glutamato en etapas posteriores. [62] En la médula espinal en desarrollo del pez cebra , la actividad espontánea temprana es necesaria para la formación de ráfagas alternas cada vez más sincrónicas entre las regiones ipsilaterales y contralaterales de la médula espinal y para la integración de nuevas células en el circuito. [63] Se cree que las neuronas motoras que inervan las mismas fibras musculares de contracción mantienen una actividad sincrónica que permite que ambas neuronas permanezcan en contacto con la fibra muscular en la edad adulta. [38] En la corteza , se han observado ondas tempranas de actividad en el cerebelo y en cortes corticales. [64] Una vez que el estímulo sensorial está disponible, el ajuste fino final de los mapas de codificación sensorial y el refinamiento del circuito comienza a depender cada vez más de la actividad evocada sensorialmente, como lo demuestran los experimentos clásicos sobre los efectos de la privación sensorial durante períodos críticos . [64]
Las técnicas de resonancia magnética ponderadas por difusión contemporáneas también pueden revelar el proceso macroscópico del desarrollo axonal. El conectoma se puede construir a partir de datos de resonancia magnética ponderada por difusión : los vértices del gráfico corresponden a áreas de materia gris etiquetadas anatómicamente, y dos de esos vértices, digamos u y v , están conectados por un borde si la fase de tractografía del procesamiento de datos encuentra una fibra axonal que conecta las dos áreas, correspondientes a u y v .
Numerosos gráficos cerebrales, calculados a partir del Proyecto Conectoma Humano, se pueden descargar del sitio http://braingraph.org. La Dinámica de Consenso de Conectomas (CCD) es un fenómeno notable que se descubrió al disminuir continuamente el parámetro de confianza mínimo en la interfaz gráfica del Servidor de Conectomas de Referencia de Budapest . [65] [66] El Servidor de Conectomas de Referencia de Budapest (http://connectome.pitgroup.org) representa las conexiones cerebrales de n=418 sujetos con un parámetro de frecuencia k: Para cualquier k=1,2,...,n se puede ver el gráfico de los bordes que están presentes en al menos k conectomas. Si el parámetro k se disminuye uno por uno desde k=n hasta k=1, entonces aparecen cada vez más bordes en el gráfico, ya que la condición de inclusión se relaja. La observación sorprendente es que la apariencia de los bordes está lejos de ser aleatoria: se asemeja a una estructura creciente y compleja, como un árbol o un arbusto (visualizado en la animación de la izquierda).
En [67] se plantea la hipótesis de que la estructura en crecimiento copia el desarrollo axonal del cerebro humano : las conexiones en desarrollo más temprano (fibras axonal) son comunes en la mayoría de los sujetos, y las conexiones en desarrollo posterior tienen una varianza cada vez mayor, porque sus varianzas se acumulan en el proceso de desarrollo axonal.
Varias neuronas motoras compiten por cada unión neuromuscular, pero sólo una sobrevive hasta la edad adulta. [37] Se ha demostrado que la competencia in vitro implica una sustancia neurotrófica limitada que se libera, o que la actividad neuronal infiere ventaja a las conexiones postsinápticas fuertes al dar resistencia a una toxina que también se libera tras la estimulación nerviosa. In vivo , se sugiere que las fibras musculares seleccionan la neurona más fuerte a través de una señal retrógrada o que los mecanismos de eliminación de sinapsis dependientes de la actividad determinan la identidad del axón "ganador" en una placa terminal motora. [38]
El mapeo cerebral puede mostrar cómo cambia el cerebro de un animal a lo largo de su vida. En 2021, los científicos mapearon y compararon los cerebros completos de ocho gusanos C. elegans a lo largo de su desarrollo a nivel neuronal [68] [69] y el cableado completo de un solo músculo mamífero desde el nacimiento hasta la edad adulta. [38]
La neurogénesis también ocurre en partes específicas del cerebro adulto.