En biología, cualquier grupo de peces que se mantiene unido por razones sociales se denomina cardumen , y si el grupo nada en la misma dirección de manera coordinada, se denomina cardumen . [1] En el uso común, a veces se usan estos términos de manera bastante vaga. [1] Aproximadamente una cuarta parte de las especies de peces se encuentran en cardúmenes durante toda su vida, y aproximadamente la mitad lo hacen durante parte de su vida. [2]
Los peces obtienen muchos beneficios de la pertenencia a cardúmenes, como la defensa contra los depredadores (mediante una mejor detección de los depredadores y la reducción de las posibilidades de captura de individuos), un mayor éxito en la búsqueda de alimento y un mayor éxito en la búsqueda de pareja. También es probable que los peces se beneficien de la pertenencia a cardúmenes mediante una mayor eficiencia hidrodinámica .
Los peces utilizan muchos rasgos para elegir a sus compañeros de cardumen. Por lo general, prefieren cardúmenes más grandes, compañeros de cardumen de su misma especie, compañeros de cardumen de tamaño y apariencia similares a ellos, peces sanos y parientes (cuando los reconocen).
El efecto de rareza postula que cualquier miembro del cardumen que se destaque en apariencia será el objetivo preferencial de los depredadores. Esto puede explicar por qué los peces prefieren formar cardúmenes con individuos que se parecen a ellos. El efecto de rareza tiende, por lo tanto, a homogeneizar los cardúmenes.

Una agregación de peces es el término general para cualquier conjunto de peces que se han reunido en alguna localidad. Las agregaciones de peces pueden ser estructuradas o no estructuradas. Una agregación no estructurada puede ser un grupo de especies y tamaños mixtos que se han reunido al azar cerca de algún recurso local, como sitios de alimentación o de anidación.
Si, además, la agregación se reúne de una manera interactiva y social, se puede decir que forman cardúmenes . [1] [a] Aunque los peces que forman cardúmenes pueden relacionarse entre sí de una manera vaga, ya que cada pez nada y busca alimento de forma algo independiente, son conscientes de los otros miembros del grupo, como lo demuestra la forma en que adaptan el comportamiento, como la natación, para permanecer cerca de los otros peces del grupo. Los grupos de cardúmenes pueden incluir peces de tamaños dispares y pueden incluir subgrupos de especies mixtas.
Si el cardumen se organiza de forma más compacta y los peces sincronizan su natación de modo que todos se mueven a la misma velocidad y en la misma dirección, entonces se puede decir que los peces están formando cardúmenes . [1] [3] [b] Los peces que forman cardúmenes suelen ser de la misma especie y de la misma edad/tamaño. Los cardúmenes de peces se mueven con los miembros individuales espaciados con precisión entre sí. Los cardúmenes realizan maniobras complicadas, como si tuvieran mente propia. [4]
Los entresijos de la formación de cardúmenes están lejos de ser completamente comprendidos, especialmente la energía de la natación y la alimentación. Se han sugerido muchas hipótesis para explicar la función de la formación de cardúmenes, como una mejor orientación, caza sincronizada , confusión de depredadores y menor riesgo de ser descubierto. La formación de cardúmenes también tiene desventajas, como la acumulación de excreción en el medio respiratorio y el agotamiento del oxígeno y los alimentos. La forma en que se disponen los peces en el cardumen probablemente brinda ventajas de ahorro de energía, aunque esto es controvertido. [5]

Los peces pueden ser cardúmenes obligados o facultativos (opcionales). [6] Los cardúmenes obligados, como los atunes , los arenques y las anchoas , pasan todo el tiempo en cardúmenes y se agitan si se separan del grupo. Los cardúmenes facultativos, como el bacalao del Atlántico , los saiths y algunos carángidos , forman cardúmenes solo una parte del tiempo, tal vez con fines reproductivos. [7]
Los peces que se reúnen en cardúmenes pueden pasar de ser un cardumen disciplinado y coordinado a ser un cardumen amorfo en cuestión de segundos. Estos cambios se desencadenan por cambios en la actividad, como alimentarse, descansar, viajar o evitar depredadores. [4]
Cuando los bancos de peces se detienen para alimentarse, se separan y forman cardúmenes. Los cardúmenes son más vulnerables a los ataques de los depredadores. La forma que adopta un cardumen o un banco depende del tipo de pez y de lo que esté haciendo. Los bancos que se desplazan pueden formar líneas largas y delgadas, cuadrados u óvalos o formas ameboides. Los bancos que se desplazan rápidamente suelen tener forma de cuña, mientras que los bancos que se alimentan tienden a volverse circulares. [4]
Los peces forrajeros son peces pequeños que son presa de depredadores más grandes para alimentarse. Los depredadores incluyen otros peces más grandes, aves marinas y mamíferos marinos . Los peces forrajeros oceánicos típicos son peces pequeños que se alimentan por filtración, como el arenque , las anchoas y el sábalo . Los peces forrajeros compensan su pequeño tamaño formando cardúmenes. Algunos nadan en cuadrículas sincronizadas con la boca abierta para poder filtrar y alimentarse de plancton de manera eficiente . [8] Estos cardúmenes pueden llegar a ser enormes, moviéndose a lo largo de las costas y migrando a través de océanos abiertos. Los cardúmenes son recursos alimenticios concentrados para los grandes depredadores marinos.

Estas concentraciones, a veces inmensas, alimentan la red alimentaria del océano . La mayoría de los peces forrajeros son pelágicos , lo que significa que forman sus cardúmenes en aguas abiertas, y no en el fondo o cerca de él ( peces demersales ). Los peces forrajeros tienen una vida corta y pasan desapercibidos para los humanos. Los depredadores están muy concentrados en los cardúmenes, muy conscientes de su número y paradero, y realizan migraciones ellos mismos, a menudo en cardúmenes propios, que pueden abarcar miles de kilómetros para conectarse con ellos o permanecer conectados con ellos. [9]
Los arenques se encuentran entre los peces de cardumen más espectaculares. Se agrupan en grandes cantidades. Los cardúmenes más grandes a menudo se forman durante las migraciones al fusionarse con cardúmenes más pequeños. Se han observado "cadenas" de cardúmenes de cien kilómetros (60 millas) de largo de salmonetes migrando en el mar Caspio . Radakov estimó que los cardúmenes de arenques en el Atlántico Norte pueden ocupar hasta 4,8 kilómetros cúbicos (1,2 millas cúbicas) con densidades de peces de entre 0,5 y 1,0 peces/metro cúbico ( 3 ⁄ 8 a 3 ⁄ 4 peces por yarda cúbica), lo que suma un total de unos tres mil millones de peces en un solo cardumen. [10] Estos cardúmenes se mueven a lo largo de las costas y atraviesan los océanos abiertos. Los cardúmenes de arenques en general tienen disposiciones muy precisas que les permiten mantener velocidades de crucero relativamente constantes. Los arenques tienen un oído excelente y sus cardúmenes reaccionan muy rápidamente ante un depredador. Los arenques se mantienen a cierta distancia de un buceador en movimiento o de un depredador que navega como una orca, formando una vacuola que parece una rosquilla desde un avión de reconocimiento. [11]
Muchas especies de peces depredadores de gran tamaño también se agrupan en cardúmenes, incluidos muchos peces altamente migratorios , como el atún y algunos tiburones oceánicos . Los cetáceos , como los delfines, las marsopas y las ballenas, viven en grupos sociales organizados llamados manadas .
"La conducta de agrupamiento en cardúmenes se describe generalmente como un equilibrio entre los beneficios de vivir en grupos contra los depredadores y los costos de una mayor competencia por la alimentación". [12] Landa (1998) sostiene que las ventajas acumulativas de agruparse en cardúmenes, como se explica a continuación, son fuertes incentivos selectivos para que los peces se unan a los cardúmenes. [13] Parrish et al. (2002) sostienen de manera similar que la formación de cardúmenes es un ejemplo clásico de emergencia , donde hay propiedades que posee el cardumen pero no los peces individuales. Las propiedades emergentes otorgan una ventaja evolutiva a los miembros del cardumen que los no miembros no reciben. [14]
El apoyo a la función social y genética de las agregaciones, especialmente las formadas por peces, se puede ver en varios aspectos de su comportamiento. Por ejemplo, los experimentos han demostrado que los peces individuales retirados de un banco tendrán una frecuencia respiratoria más alta que los que se encuentran en el banco. [15] Este efecto se ha atribuido al estrés, y el efecto de estar con congéneres parece ser, por lo tanto, calmante y una poderosa motivación social para permanecer en una agregación. [16] Los arenques, por ejemplo, se agitarán mucho si se los aísla de sus congéneres. [7] Debido a su adaptación al comportamiento de banco, rara vez se los exhibe en acuarios . Incluso con las mejores instalaciones que los acuarios pueden ofrecer, se vuelven frágiles y lentos en comparación con su energía temblorosa en los bancos salvajes. [ cita requerida ]

También se ha propuesto que nadar en grupos mejora el éxito en la búsqueda de alimento. Esta capacidad fue demostrada por Pitcher y otros en su estudio del comportamiento de búsqueda de alimento en cardúmenes de ciprínidos . [17] En este estudio, se cuantificó el tiempo que tardaban los grupos de pececillos y peces de colores en encontrar un trozo de alimento. Se varió el número de peces en los grupos y se estableció una disminución estadísticamente significativa en la cantidad de tiempo necesario para que grupos más grandes encontraran alimento. Otro respaldo a la mejora de la capacidad de búsqueda de alimento de los cardúmenes se ve en la estructura de los cardúmenes de peces depredadores. Partridge y otros analizaron la estructura del cardumen del atún rojo del Atlántico a partir de fotografías aéreas y descubrieron que el cardumen asumía una forma parabólica, un hecho que sugería una caza cooperativa en esta especie. [18]
"La razón de esto es la presencia de muchos ojos que buscan el alimento. Los peces en cardúmenes "comparten" información al monitorear de cerca el comportamiento de los demás. El comportamiento de alimentación de un pez estimula rápidamente el comportamiento de búsqueda de alimento en otros. [19]
Las surgencias oceánicas proporcionan zonas de alimentación fértiles para los peces forrajeros. Los giros oceánicos son corrientes oceánicas de gran escala causadas por el efecto Coriolis . Las corrientes superficiales impulsadas por el viento interactúan con estos giros y la topografía submarina, como los montes submarinos , los bancos de pesca y el borde de las plataformas continentales , para producir afloramientos y hundimientos . [20] Estos pueden transportar nutrientes de los que prospera el plancton. El resultado puede ser una rica zona de alimentación atractiva para los peces forrajeros que se alimentan de plancton. A su vez, los propios peces forrajeros se convierten en una zona de alimentación para peces depredadores más grandes. La mayoría de las surgencias son costeras y muchas de ellas sustentan algunas de las pesquerías más productivas del mundo. Las regiones de surgencias notables incluyen la costa de Perú , Chile , el mar Arábigo , el oeste de Sudáfrica , el este de Nueva Zelanda y la costa de California . [ cita requerida ]
Los copépodos , el zooplancton primario , son un elemento importante en el menú de los peces forrajeros. Son un grupo de pequeños crustáceos que se encuentran en hábitats oceánicos y de agua dulce . Los copépodos suelen tener entre uno y dos milímetros de largo y un cuerpo en forma de lágrima. Algunos científicos dicen que forman la biomasa animal más grande del planeta. [21] Los copépodos son muy alertas y evasivos. Tienen grandes antenas (ver foto de abajo a la izquierda). Cuando extienden sus antenas pueden sentir la onda de presión de un pez que se acerca y saltar a gran velocidad unos pocos centímetros. Si las concentraciones de copépodos alcanzan niveles altos, los arenques en cardúmenes adoptan un método llamado alimentación de carnero . En la foto de abajo, el carnero del arenque se alimenta de un cardumen de copépodos . Nadan con la boca bien abierta y los opérculos completamente expandidos. [ cita requerida ]
Los peces nadan en una cuadrícula en la que la distancia entre ellos es igual a la longitud del salto de su presa, como se indica en la animación de arriba a la derecha. En la animación, los arenques juveniles cazan a los copépodos de esta manera sincronizada. Los copépodos detectan con sus antenas la onda de presión de un arenque que se acerca y reaccionan con un rápido salto de escape. La longitud del salto es bastante constante. Los peces se alinean en una cuadrícula con esta longitud de salto característica. Un copépodo puede lanzarse unas 80 veces antes de cansarse. Después de un salto, tarda 60 milisegundos en desplegar de nuevo sus antenas, y este retraso de tiempo se convierte en su perdición, ya que la corriente casi interminable de arenques permite que un arenque acabe por atrapar al copépodo. Un solo arenque juvenil nunca podría atrapar a un copépodo grande. [8]
Un tercer beneficio propuesto para los grupos de peces es que cumplen una función reproductiva. Proporcionan un mayor acceso a posibles parejas, ya que encontrar una en un cardumen no requiere mucha energía. Y para los peces migratorios que navegan largas distancias para desovar, es probable que la navegación en el cardumen, con la participación de todos los miembros del mismo, sea mejor que la realizada por un pez individual. [4] [ página necesaria ]
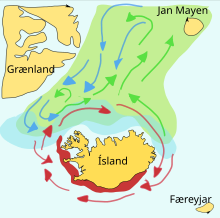
Los peces forrajeros suelen realizar grandes migraciones entre sus zonas de desove, alimentación y crianza. Los bancos de una población determinada suelen viajar en un triángulo entre estas zonas. Por ejemplo, una población de arenques tiene su zona de desove en el sur de Noruega , su zona de alimentación en Islandia y su zona de crianza en el norte de Noruega. Los amplios viajes triangulares como estos pueden ser importantes porque los peces forrajeros, cuando se alimentan, no pueden distinguir a sus propias crías. [ cita requerida ]
El capelán es un pez forrajero de la familia de los eperlanos que se encuentra en los océanos Atlántico y Ártico . En verano, pastan en densos bancos de plancton en el borde de la plataforma de hielo. Los capelán más grandes también comen krill y otros crustáceos . El capelán se mueve hacia la costa en grandes cardúmenes para desovar y migrar en primavera y verano para alimentarse en áreas ricas en plancton entre Islandia , Groenlandia y Jan Mayen . La migración se ve afectada por las corrientes oceánicas . Alrededor de Islandia, el capelán en madurez realiza grandes migraciones de alimentación hacia el norte en primavera y verano. La migración de regreso tiene lugar entre septiembre y noviembre. La migración de desove comienza al norte de Islandia en diciembre o enero. [22]
Esta teoría afirma que los grupos de peces pueden ahorrar energía al nadar juntos, de forma muy similar a cómo los ciclistas pueden arrastrarse unos a otros en un pelotón . También se cree que los gansos que vuelan en formación de V ahorran energía al volar en la corriente ascendente del vórtice de la punta del ala generado por el animal anterior en la formación. [23] [24] Se ha propuesto una mayor eficiencia en la natación en grupos para los bancos de peces y el krill antártico . [ cita requerida ]
Parecería razonable pensar que la uniformidad de tamaño y espaciamiento regular de los peces en los cardúmenes daría como resultado eficiencias hidrodinámicas. [12] Si bien los primeros experimentos de laboratorio no lograron detectar los beneficios hidrodinámicos creados por los vecinos de un pez en un cardumen, [19] se cree que sí se producen ganancias de eficiencia en la naturaleza. Experimentos más recientes con grupos de peces que nadan en canales respaldan esto, y los peces reducen sus costos de natación hasta en un 20% en comparación con cuando los mismos peces nadan de manera aislada. [25] Landa (1998) argumentó que el líder de un cardumen cambia constantemente, porque si bien estar en el cuerpo de un cardumen le da una ventaja hidrodinámica, el líder será el primero en llegar a la comida. [13] Trabajos más recientes sugieren que, después de que los individuos que están al frente del cardumen encuentran e ingieren más comida, luego se reubican más atrás dentro del cardumen debido a las restricciones locomotoras generadas durante la digestión de la comida. [26]

.jpg/440px-Red_Fish_at_Papahānaumokuākea_(cropped).jpg)

Se observa comúnmente que los peces que se agrupan en bancos corren un peligro particular de ser devorados si se los separa del banco. [4] Se han propuesto varias funciones antidepredadoras de los bancos de peces.
Un método potencial por el cual los bancos de peces podrían frustrar a los depredadores es el "efecto de confusión del depredador" propuesto y demostrado por Milinski y Heller (1978). [29] Esta teoría se basa en la idea de que se vuelve difícil para los depredadores elegir presas individuales de grupos porque los muchos objetivos en movimiento crean una sobrecarga sensorial del canal visual del depredador. Los hallazgos de Milinski y Heller han sido corroborados tanto en experimentos [30] [31] como en simulaciones por computadora. [32] [33] "Los peces que se encuentran en bancos son del mismo tamaño y plateados, por lo que es difícil para un depredador orientado visualmente distinguir un individuo de una masa de peces que giran y parpadean y luego tener tiempo suficiente para atrapar su presa antes de que desaparezca en el banco". [4]
El comportamiento de cardumen confunde el órgano de la línea lateral (LLO) así como el sistema electrosensorial (ESS) de los depredadores. [34] [35] [36] Los movimientos de las aletas de un solo pez actúan como una fuente de onda en forma de punto, emitiendo un gradiente por el cual los depredadores podrían localizarlo. Dado que los campos de muchos peces se superpondrán, la formación de cardúmenes debería oscurecer este gradiente, tal vez imitando las ondas de presión de un animal más grande, y más probablemente confundir la percepción de la línea lateral. [34] El LLO es esencial en las etapas finales de un ataque de depredador. [ 37] Los animales electrorreceptores pueden localizar una fuente de campo utilizando no uniformidades espaciales. Para producir señales separadas, las presas individuales deben estar separadas por aproximadamente cinco anchos corporales. Si los objetos están demasiado cerca para distinguirlos, formarán una imagen borrosa. [38] Con base en esto, se sugirió que la formación de cardúmenes puede confundir el ESS de los depredadores. [34]
Un tercer efecto antidepredador potencial de las agrupaciones animales es la hipótesis de los "muchos ojos". Esta teoría afirma que, a medida que aumenta el tamaño del grupo, la tarea de explorar el entorno en busca de depredadores puede repartirse entre muchos individuos. Esta colaboración masiva no sólo proporciona presumiblemente un mayor nivel de vigilancia, sino que también podría permitir más tiempo para la alimentación individual. [39] [40]
Una cuarta hipótesis para un efecto antidepredador de los bancos de peces es el efecto de "dilución de encuentro". El efecto de dilución es una elaboración de la seguridad en números e interactúa con el efecto de confusión. [19] Un ataque de depredador dado comerá una proporción menor de un banco grande que de uno pequeño. [41] Hamilton propuso que los animales se agrupan debido a una evitación "egoísta" de un depredador y, por lo tanto, era una forma de búsqueda de refugio. [42] Otra formulación de la teoría fue dada por Turner y Pitcher y fue vista como una combinación de probabilidades de detección y ataque. [43] En el componente de detección de la teoría, se sugirió que las presas potenciales podrían beneficiarse al vivir juntas, ya que es menos probable que un depredador se encuentre con un solo grupo que con una distribución dispersa. En el componente de ataque, se pensó que es menos probable que un depredador atacante se coma un pez en particular cuando hay una mayor cantidad de peces presentes. En resumen, un pez tiene una ventaja si está en el grupo más grande de dos, suponiendo que la probabilidad de detección y ataque no aumenta desproporcionadamente con el tamaño del grupo. [44]
Los peces forrajeros en cardúmenes están sujetos a constantes ataques de depredadores. Un ejemplo son los ataques que tienen lugar durante la migración de la sardina africana . La migración de la sardina africana es una espectacular migración de millones de sardinas plateadas a lo largo de la costa sur de África. En términos de biomasa, la migración de la sardina podría rivalizar con la gran migración de ñus de África oriental . [45] Las sardinas tienen un ciclo de vida corto, ya que viven solo dos o tres años. Las sardinas adultas, de unos dos años de edad, se agrupan en el Banco Agulhas , donde desovan durante la primavera y el verano, liberando decenas de miles de huevos en el agua. Luego, las sardinas adultas se abren camino en cientos de cardúmenes hacia las aguas subtropicales del océano Índico . Un cardumen más grande puede tener 7 kilómetros (4,3 millas) de largo, 1,5 kilómetros (0,93 millas) de ancho y 30 metros (98 pies) de profundidad. Enormes cantidades de tiburones, delfines, atunes, peces vela, lobos marinos del Cabo e incluso orcas se congregan y siguen los bancos de peces, creando un frenesí alimentario a lo largo de la costa. [46]

Cuando se sienten amenazadas, las sardinas (y otros peces forrajeros) se agrupan instintivamente y crean enormes bolas de cebo . Las bolas de cebo pueden tener hasta 20 metros (66 pies) de diámetro. Tienen una vida corta, rara vez duran más de 20 minutos. Los huevos de pez, que quedan en los bancos de Agulhas, se desplazan hacia el noroeste con la corriente hacia aguas cercanas a la costa oeste, donde las larvas se convierten en peces juveniles. Cuando son lo suficientemente mayores, se agrupan en cardúmenes densos y migran hacia el sur, regresando a los bancos de Agulhas para reiniciar el ciclo. [46]
El desarrollo de la conducta de cardumen probablemente estuvo asociado con una mayor calidad de percepción, un estilo de vida depredador y mecanismos de selección por tamaño para evitar el canibalismo. [36] En los ancestros que se alimentaban por filtración, antes de que se desarrollara la visión y el sistema octavolateral (OLS), el riesgo de depredación habría sido limitado y se habría debido principalmente a los depredadores invertebrados. Por lo tanto, en ese momento, la seguridad en los números probablemente no era un incentivo importante para reunirse en cardúmenes o bancos. El desarrollo de la visión y el OLS habría permitido la detección de presas potenciales. Esto podría haber llevado a un mayor potencial de canibalismo dentro del cardumen. Por otro lado, una mayor calidad de percepción daría a los individuos pequeños la oportunidad de escapar o de nunca unirse a un cardumen con peces más grandes. Se ha demostrado que los peces pequeños evitan unirse a un grupo con peces más grandes, aunque los peces grandes no evitan unirse a congéneres pequeños. [47] Este mecanismo de selección basado en una mayor calidad de percepción podría haber resultado en la homogeneidad del tamaño de los peces en los cardúmenes, lo que aumentaría la capacidad de moverse en sincronía. [36]
.JPG/440px-School_of_blackfin_barracuda_(sphyraena_qenie).JPG)
Los depredadores han ideado diversas contramedidas para socavar las maniobras defensivas de los peces forrajeros. El pez vela levanta su vela para parecer mucho más grande y así poder arrear un banco de peces o calamares. El pez espada carga a gran velocidad a través de los bancos de peces forrajeros, cortando con sus espadas para matar o aturdir a la presa. Luego se dan la vuelta y regresan para consumir su "captura". Los tiburones zorro usan sus largas colas para aturdir a los peces que se agrupan en bancos. Antes de atacar, los tiburones compactan los bancos de presas nadando alrededor de ellos y salpicando el agua con sus colas, a menudo en parejas o grupos pequeños. Los tiburones zorro nadan en círculos para conducir a las presas del banco hasta formar una masa compacta, antes de golpearlas con fuerza con el lóbulo superior de su cola para aturdirlas. [48] [49] Los tiburones giradores cargan verticalmente a través del banco, girando sobre su eje con la boca abierta y mordiendo por todos lados. El impulso del tiburón al final de estas carreras en espiral a menudo lo lleva por el aire. [50] [51]
Algunos depredadores, como los delfines, cazan en grupos propios. Una técnica empleada por muchas especies de delfines es la de pastoreo , en la que una manada controla un cardumen de peces mientras los miembros individuales se turnan para abrirse paso y alimentarse del cardumen más compacto (una formación conocida comúnmente como bola de cebo ). El acorralamiento es un método en el que se persigue a los peces hasta aguas poco profundas donde es más fácil capturarlos. En Carolina del Sur , el delfín mular del Atlántico lleva esto un paso más allá con lo que se conoce como alimentación en la playa, en la que los peces son llevados a bancos de barro y recuperados de allí. [53]
Se ha observado que los delfines mulares comunes utilizan otra técnica. Un delfín actúa como "conductor" y conduce un banco de peces hacia otros delfines que forman una barrera. El delfín conductor golpea con su aleta caudal, lo que hace que el pez salte en el aire. Cuando el pez salta, el delfín conductor se mueve con los delfines barrera y atrapa al pez en el aire. [52] Este tipo de especialización de roles cooperativos parece ser más común en los animales marinos que en los animales terrestres , tal vez porque los océanos tienen más variabilidad en la diversidad de presas, biomasa y movilidad de los depredadores. [52]
Durante la migración de la sardina , hasta 18.000 delfines, comportándose como perros pastores, arrean a las sardinas en bolas de cebo o las acorralan en aguas poco profundas. Una vez que las bolas de cebo están acorraladas, los delfines y otros depredadores se turnan para atravesarlas, atiborrándose de los peces a medida que avanzan. Las aves marinas también los atacan desde arriba, bandadas de alcatraces , cormoranes , charranes y gaviotas . Algunas de estas aves marinas caen en picado desde alturas de 30 metros (100 pies), sumergiéndose en el agua dejando rastros similares a vapor, similares a los de los aviones de combate. [46] Los alcatraces se sumergen en el agua a hasta 100 kilómetros por hora (60 mph). Tienen bolsas de aire debajo de la piel en la cara y el pecho que actúan como plástico de burbujas , amortiguando el impacto con el agua.
Se sabe que algunos subgrupos de poblaciones de delfines mulares de Mauritania practican la pesca cooperativa interespecífica con pescadores humanos. Los delfines conducen un banco de peces hacia la orilla, donde los humanos los esperan con sus redes. En la confusión de lanzar las redes, los delfines también capturan una gran cantidad de peces. También se han observado técnicas de alimentación cooperativa intraespecífica y algunos proponen que estos comportamientos se transmiten por medios culturales. Rendell y Whitehead han propuesto una estructura para el estudio de la cultura en los cetáceos. [54]
Algunas ballenas se alimentan a trompicones con bolas de cebo. [55] La alimentación a trompicones es un método de alimentación extremo, en el que la ballena acelera desde debajo de una bola de cebo a gran velocidad y luego abre la boca en un ángulo amplio. Esto genera la presión de agua necesaria para expandir su boca y engullir y filtrar una gran cantidad de agua y peces. Se dice que la alimentación a trompicones de los enormes rorcuales es el mayor evento biomecánico de la Tierra. [56]

Los bancos de peces nadan en falanges disciplinadas, y algunas especies, como los arenques, pueden moverse de un lado a otro a velocidades impresionantes, dando vueltas de un lado a otro y realizando cambios sorprendentes en la forma del banco sin colisionar. Es como si sus movimientos estuvieran coreografiados, aunque no es así. Debe haber sistemas de respuesta muy rápidos que permitan a los peces hacer esto. Los peces jóvenes practican técnicas de formación de bancos en parejas y luego en grupos más grandes a medida que sus técnicas y sentidos maduran. El comportamiento de formación de bancos se desarrolla instintivamente y no se aprende de los peces mayores. Para formar bancos como lo hacen, los peces necesitan sistemas sensoriales que puedan responder con gran velocidad a pequeños cambios en su posición relativa a su vecino. La mayoría de los bancos pierden su capacidad de formación de bancos después del anochecer y se quedan en bancos. Esto indica que la visión es importante para la formación de bancos. La importancia de la visión también se indica por el comportamiento de los peces que han quedado cegados temporalmente. Las especies que forman bancos tienen ojos a los lados de la cabeza, lo que significa que pueden ver fácilmente a sus vecinos. Además, las especies que forman cardúmenes suelen tener "marcas de formación" en los hombros o en la base de la cola, o rayas visualmente prominentes, que proporcionan marcas de referencia cuando forman cardúmenes, [57] de función similar a los marcadores pasivos en la captura artificial de movimiento. Sin embargo, los peces que no tienen estos marcadores seguirán participando en el comportamiento de formación de cardúmenes, [58] aunque quizás no de manera tan eficiente. [ cita requerida ]
También se utilizan otros sentidos. Las feromonas o el sonido también pueden desempeñar un papel, pero hasta ahora no se han encontrado pruebas que lo respalden. La línea lateral es una línea que corre a lo largo de cada lado del pez desde las cubiertas branquiales hasta la base de la cola. En experimentos de laboratorio se han eliminado las líneas laterales de los peces en cardúmenes. Nadaron más cerca, lo que llevó a una teoría de que las líneas laterales proporcionan una entrada de estímulos adicionales cuando los peces se acercan demasiado. [57] El sistema de la línea lateral es muy sensible a los cambios en las corrientes de agua y la vibración en el agua. Utiliza receptores llamados neuromastos , cada uno de los cuales está compuesto por un grupo de células ciliadas. Los pelos están rodeados por una cúpula gelatinosa que sobresale , típicamente de 0,1 a 0,2 mm de largo. Las células ciliadas en la línea lateral son similares a las células ciliadas dentro del oído interno de los vertebrados, lo que indica que la línea lateral y el oído interno comparten un origen común. [4]
Es difícil observar y describir la estructura tridimensional de los bancos de peces del mundo real debido a la gran cantidad de peces involucrados. Las técnicas incluyen el uso de avances recientes en acústica pesquera . [59]
Los parámetros que definen un banco de peces incluyen:
El enfoque observacional se complementa con el modelado matemático de los cardúmenes. Los modelos matemáticos de cardúmenes más comunes instruyen a los animales individuales a seguir tres reglas:
Un ejemplo de este tipo de simulación es el programa boids creado por Craig Reynolds en 1986. [65] Otro es el modelo de partículas autopropulsadas introducido por Vicsek et al. en 1995. [66] Muchos modelos actuales utilizan variaciones de estas reglas. Por ejemplo, muchos modelos implementan estas tres reglas a través de zonas en capas alrededor de cada pez.
La forma de estas zonas se verá necesariamente afectada por las capacidades sensoriales de los peces. Los peces dependen tanto de la visión como de las señales hidrodinámicas transmitidas a través de su línea lateral . El krill antártico depende de la visión y de las señales hidrodinámicas transmitidas a través de sus antenas .
En una tesis de maestría publicada en 2008, Moshi Charnell produjo un comportamiento escolar sin utilizar el componente de correspondencia de alineamiento del comportamiento de un individuo. [67] Su modelo reduce las tres reglas básicas a las dos reglas siguientes:
En un artículo publicado en 2009, investigadores de Islandia relatan su aplicación de un modelo de partículas interactuantes a la población de capelán alrededor de Islandia, prediciendo con éxito la ruta de migración de desove para 2008. [68]
Para comprender mejor por qué los animales desarrollan el comportamiento de enjambre , los científicos han recurrido a modelos evolutivos que simulan poblaciones de animales en evolución. Normalmente, estos estudios utilizan un algoritmo genético para simular la evolución a lo largo de muchas generaciones en el modelo. Estos estudios han investigado una serie de hipótesis que explican por qué los animales desarrollan el comportamiento de enjambre, como la teoría de la manada egoísta , [69] [70] [71] [72] el efecto de confusión del depredador, [33] [73] el efecto de dilución, [74] [75] y la teoría de los muchos ojos. [76]
En 2009, basándose en los recientes avances en imágenes acústicas , [59] [77] un grupo de investigadores del MIT observó por "primera vez la formación y posterior migración de un enorme banco de peces". [78] Los resultados proporcionan la primera confirmación de campo de las teorías generales sobre cómo se comportan los grupos grandes, desde los enjambres de langostas hasta las bandadas de aves . [79]
Los investigadores tomaron imágenes de arenques atlánticos en desove en el banco Georges . Descubrieron que los peces se reúnen desde aguas más profundas por la noche, formando cardúmenes de manera desordenada. Se desencadena una reacción en cadena cuando la densidad de población alcanza un valor crítico, como una ola de público que se desplaza alrededor de un estadio deportivo. Luego se produce una transición rápida y los peces se polarizan y sincronizan altamente, como los peces en cardúmenes. Después de la transición, los cardúmenes comienzan a migrar, extendiéndose hasta 40 kilómetros (25 millas) a través del océano, hasta partes poco profundas del banco. Allí desovan durante la noche. Por la mañana, los peces vuelven a agruparse en aguas más profundas y luego se disuelven. También se descubrieron pequeños grupos de líderes que influyeron significativamente en grupos mucho más grandes. [79]
Los bancos de peces se enfrentan a decisiones que deben tomar si quieren permanecer juntos. Por ejemplo, una decisión podría ser en qué dirección nadar cuando se enfrentan a un depredador, en qué áreas detenerse para buscar alimento, o cuándo y dónde migrar. [80]
El quórum sensing puede funcionar como un proceso de toma de decisiones colectivas en cualquier sistema descentralizado . Una respuesta de quórum se ha definido como "un aumento pronunciado en la probabilidad de que los miembros del grupo realicen un comportamiento determinado una vez que se supera un número mínimo de sus compañeros de grupo que ya realizan ese comportamiento". [81] Una investigación reciente mostró que pequeños grupos de peces usaban la toma de decisiones por consenso al decidir qué modelo de pez seguir. Los peces hicieron esto mediante una simple regla de quórum de modo que los individuos observaban las decisiones de los demás antes de tomar sus propias decisiones. Esta técnica generalmente resultó en la decisión "correcta", pero ocasionalmente se tradujo en la decisión "incorrecta". Además, a medida que aumentaba el tamaño del grupo, los peces tomaban decisiones más precisas al seguir el modelo de pez más atractivo. [82] La toma de decisiones por consenso, una forma de inteligencia colectiva , utiliza de manera efectiva la información de múltiples fuentes para llegar generalmente a la conclusión correcta. Este comportamiento también se ha demostrado en el comportamiento de agrupamiento de los espinosos de tres espinas . [81]
Otras cuestiones abiertas sobre el comportamiento de los cardúmenes incluyen la identificación de qué individuos son responsables de la dirección del movimiento del cardumen. En el caso del movimiento migratorio , la mayoría de los miembros de un cardumen parecen saber hacia dónde se dirigen. Las observaciones sobre el comportamiento de búsqueda de alimento de los peces dorados cautivos (una especie de pececillo ) encontraron que formaban cardúmenes que eran liderados por un pequeño número de individuos experimentados que sabían cuándo y dónde había comida disponible. [83] Si todos los peces dorados de un cardumen tienen un conocimiento similar de la disponibilidad de comida, hay algunos individuos que aún emergen como líderes naturales (estando al frente más a menudo) y las pruebas de comportamiento sugieren que son naturalmente más audaces. [84] Los peces dorados más pequeños parecen estar más dispuestos que los más grandes a estar cerca del frente del cardumen, tal vez porque están más hambrientos. [85] Las observaciones sobre la cucaracha común han demostrado que los individuos privados de alimento tienden a estar en la parte delantera de un banco, donde obtienen más alimento [86] [87] pero donde también pueden ser más vulnerables a los depredadores emboscadores. [88] Los individuos que se muestran cautelosos ante la depredación tienden a buscar posiciones más centrales dentro de los bancos. [89]

Los estudios experimentales sobre la preferencia por los cardúmenes son relativamente fáciles de realizar. Un acuario que contiene un pez que elige se coloca entre dos acuarios que contienen cardúmenes diferentes y se supone que el pez que elige pasa más tiempo junto al cardumen que prefiere. Estudios de este tipo han identificado varios factores importantes para la preferencia por los cardúmenes. [ cita requerida ]
Los peces generalmente prefieren los cardúmenes más grandes. [90] [91] Esto tiene sentido, ya que los cardúmenes más grandes suelen brindar una mejor protección contra los depredadores. De hecho, la preferencia por los cardúmenes más grandes parece ser más fuerte cuando los depredadores están cerca, [92] [93] o en especies que dependen más de los cardúmenes que de la armadura corporal contra la depredación. [94] Los cardúmenes más grandes también pueden encontrar comida más rápido, aunque esa comida tendría que ser compartida entre más individuos. La competencia puede significar que los individuos hambrientos podrían preferir cardúmenes más pequeños o exhibir una menor preferencia por cardúmenes muy grandes, como se muestra en los espinosos. [95] [96]
Los peces prefieren agruparse en cardúmenes con los de su propia especie. A veces, varias especies pueden mezclarse en un cardumen, pero cuando un depredador se presenta en dichos cardúmenes, los peces se reorganizan de manera que cada individuo termina estando más cerca de los miembros de su propia especie. [97]
Los peces tienden a preferir cardúmenes formados por individuos que coinciden con su tamaño. [98] [99] [100] Esto tiene sentido ya que a los depredadores les resulta más fácil atrapar individuos que se destacan en un cardumen. Algunos peces incluso pueden preferir cardúmenes de otra especie si esto significa una mejor coincidencia en el tamaño corporal actual. [101] Sin embargo, en cuanto al tamaño del cardumen, el hambre puede afectar la preferencia por peces de tamaño similar; los peces grandes, por ejemplo, pueden preferir asociarse con los más pequeños debido a la ventaja competitiva que obtendrán sobre estos compañeros de cardumen. En el caso del pez dorado , los peces grandes saciados prefieren asociarse con otros individuos grandes, pero los hambrientos prefieren compañeros de cardumen más pequeños. [102]
Los peces prefieren agruparse en cardúmenes con individuos con los que el pez que elige ya está familiarizado. Esto se ha demostrado en guppies , [103] [104] pez espinoso de tres espinas , [105] killis rayados , [106] la perca de surf Embiotoca jacksoni , [107] tetra mexicano , [108] y varios pececillos. [109] [110] Un estudio con el pececillo de montaña White Cloud también ha descubierto que los peces que eligen prefieren agruparse en cardúmenes con individuos que han consumido la misma dieta que ellos. [111]
Se ha demostrado que los espinosos y los peces killi prefieren los bancos formados por individuos sanos en lugar de los parasitados, basándose en signos visuales de parasitismo y en el comportamiento anormal de los peces parasitados. [112] [113] [114] [115] Los peces cebra prefieren los bancos formados por peces bien alimentados (con un estómago más ancho) en lugar de los privados de alimento. [116]
Los peces espinosos de tres espinas prefieren unirse a bancos formados por individuos audaces en lugar de tímidos. [117] Los peces ángel prefieren bancos formados por individuos subordinados en lugar de individuos dominantes. [118] Los peces europeos pueden discriminar entre bancos compuestos por buenos y malos competidores, incluso en ausencia de señales obvias como diferencias en agresividad, tamaño o ritmo de alimentación; prefieren asociarse con los malos competidores. [119] Todo esto sugiere una estrategia para obtener alimento, ya que los individuos más audaces deberían tener más probabilidades de encontrar alimento, mientras que los subordinados ofrecerían menos competencia por el alimento descubierto. [ cita requerida ]
Los peces prefieren unirse a bancos que se alimentan activamente. [120] [121] El pez dorado también puede detectar la actividad anticipatoria de los bancos que esperan ser alimentados pronto y se une preferentemente a dichos bancos. [122] El pez cebra también elige bancos que son más activos. [123]
La pesca comercial explota a escala industrial el comportamiento de los peces en cardúmenes . Enormes buques cerqueros utilizan aviones de reconocimiento para localizar cardúmenes como el atún, el bacalao, la caballa y los peces forrajeros. Pueden capturar cardúmenes enormes rodeándolos rápidamente con redes de cerco con la ayuda de rápidas embarcaciones auxiliares y un sofisticado sonar que puede rastrear la forma del cardumen. [ cita requerida ]

Los peces herrero viven en bancos sueltos. Tienen una relación simbiótica con el pez señorita, que se alimenta de parásitos. Cuando se encuentran con un banco de peces señorita, se detienen y forman una bola compacta y se cuelgan boca abajo (en la imagen), cada pez esperando su turno para ser limpiado. El pez señorita extrae tejidos muertos y parásitos externos, como copécodos e isócodos parásitos, de la piel de otros peces. [ cita requerida ]
Algunos cardúmenes adoptan un comportamiento de acoso . Por ejemplo, las mojarras forman grandes colonias de anidación y, a veces, atacan a las tortugas mordedoras . Esto puede funcionar para anunciar su presencia, expulsar al depredador de la zona o ayudar a la transmisión cultural del reconocimiento del depredador. [124]
Las pirañas tienen fama de ser peces intrépidos que cazan en grupos feroces. Sin embargo, una investigación reciente, que "comenzó con la premisa de que se agrupan como un medio de caza cooperativa", descubrió que, de hecho, eran peces bastante temerosos, como otros peces, que se agrupaban para protegerse de sus depredadores, como cormoranes, caimanes y delfines. Las pirañas son "básicamente como peces normales con dientes grandes". [125]
Los calamares de Humboldt son grandes invertebrados marinos carnívoros que se desplazan en cardúmenes de hasta 1.200 individuos. Nadan a velocidades de hasta 24 kilómetros por hora (15 mph o 13 kn) impulsados por el agua expulsada a través de un sifón y por dos aletas triangulares. Sus tentáculos llevan ventosas revestidas de dientes afilados con los que agarran a sus presas y las arrastran hacia un pico grande y afilado. Durante el día, los calamares de Humboldt se comportan de manera similar a los peces mesopelágicos , viviendo a profundidades de 200 a 700 m (660 a 2.300 pies). El marcado electrónico ha demostrado que también realizan migraciones verticales diarias que los acercan a la superficie desde el anochecer hasta el amanecer. [126] Cazan cerca de la superficie por la noche, aprovechando la oscuridad para usar su aguda visión para alimentarse de presas más abundantes. El calamar se alimenta principalmente de peces pequeños , crustáceos , cefalópodos y copépodos , y caza a sus presas de manera cooperativa, la primera observación de tal comportamiento en invertebrados. [127] También se sabe que el calamar de Humboldt devora rápidamente presas más grandes cuando caza cooperativamente en grupos. Los calamares de Humboldt son conocidos por su velocidad al darse un festín de peces enganchados, tiburones y calamares, incluso de su propia especie y cardumen, [128] y se sabe que atacan a pescadores y buceadores. [129]