
Existen varios métodos para almacenar hidrógeno . Estos incluyen enfoques mecánicos como el uso de altas presiones y bajas temperaturas, o el empleo de compuestos químicos que liberan H 2 según la demanda. Si bien varias industrias producen grandes cantidades de hidrógeno, la mayoría se consume en el sitio de producción, en particular para la síntesis de amoníaco . Durante muchos años, el hidrógeno se ha almacenado como gas comprimido o líquido criogénico , y se ha transportado como tal en cilindros, tubos y tanques criogénicos para su uso en la industria o como propulsor en programas espaciales. El desafío general es el punto de ebullición muy bajo del H 2 : hierve alrededor de 20,268 K (−252,882 °C o −423,188 °F). Lograr temperaturas tan bajas requiere gastar una energía significativa.
Aunque el hidrógeno molecular tiene una densidad energética muy alta en términos de masa, en parte debido a su bajo peso molecular , como gas en condiciones ambientales tiene una densidad energética muy baja en términos de volumen. Si se va a utilizar como combustible almacenado a bordo de un vehículo, el gas hidrógeno puro debe almacenarse en una forma densa en energía para proporcionar una autonomía de conducción suficiente. Debido a que el hidrógeno es la molécula más pequeña, se escapa fácilmente de los contenedores. Considerando las fugas y los costos de transporte y producción, el hidrógeno podría tener un potencial de calentamiento global a lo largo de 100 años (GWP100) de 11,6. [1]

El hidrógeno comprimido es una forma de almacenamiento mediante la cual el gas hidrógeno se mantiene bajo presión para aumentar la densidad de almacenamiento. El hidrógeno comprimido en tanques de hidrógeno a 350 bar (5000 psi) y 700 bar (10 000 psi) se utiliza para sistemas de tanques de hidrógeno en vehículos, basados en tecnología de compuestos de carbono tipo IV. [ aclaración necesaria ] [2] Los fabricantes de automóviles, incluidos Honda [3] y Nissan [4], han estado desarrollando esta solución.
Tanques de hidrógeno líquido para automóviles, como por ejemplo el BMW Hydrogen 7. Japón tiene un sitio de almacenamiento de hidrógeno líquido (LH2) en el puerto de Kobe. [5] El hidrógeno se licúa reduciendo su temperatura a -253 °C, de forma similar al gas natural licuado (GNL), que se almacena a -162 °C. Se puede lograr una pérdida de eficiencia potencial de solo el 12,79 %, o 4,26 kW⋅h/kg de 33,3 kW⋅h/kg. [6]
El almacenamiento de sustancias químicas podría ofrecer un alto rendimiento de almacenamiento debido a las altas densidades de almacenamiento. Por ejemplo, el hidrógeno supercrítico a 30 °C y 500 bares solo tiene una densidad de 15,0 mol/L, mientras que el metanol tiene una densidad de hidrógeno de 49,5 mol H2 / L de metanol y el dimetiléter saturado a 30 °C y 7 bares tiene una densidad de 42,1 mol H2 / L de dimetiléter. [ cita requerida ]
La regeneración del material de almacenamiento es problemática. Se han investigado una gran cantidad de sistemas de almacenamiento químico. La liberación de H2 puede inducirse mediante reacciones de hidrólisis o reacciones de deshidrogenación catalizadas . Los compuestos de almacenamiento ilustrativos son los hidrocarburos, los hidruros de boro , el amoníaco y el alano , etc. [8] Un enfoque químico más prometedor es el almacenamiento electroquímico de hidrógeno, ya que la liberación de hidrógeno puede controlarse mediante la electricidad aplicada. [9] La mayoría de los materiales enumerados a continuación se pueden utilizar directamente para el almacenamiento electroquímico de hidrógeno.
Como se ha demostrado anteriormente, los nanomateriales ofrecen ventajas para los sistemas de almacenamiento de hidrógeno. Los nanomateriales ofrecen una alternativa que supera las dos principales barreras de los materiales a granel: la velocidad de sorción y la temperatura de liberación. [ cita requerida ]
La mejora de la cinética de sorción y la capacidad de almacenamiento se pueden mejorar mediante el dopaje de catalizadores basado en nanomateriales , como se muestra en el trabajo del Clean Energy Research Center de la Universidad del Sur de Florida . [10] Este grupo de investigación estudió LiBH4 dopado con nanopartículas de níquel y analizó la pérdida de peso y la temperatura de liberación de las diferentes especies. Observaron que una cantidad creciente de nanocatalizador reduce la temperatura de liberación en aproximadamente 20 °C y aumenta la pérdida de peso del material en un 2-3%. Se encontró que la cantidad óptima de partículas de Ni era 3 mol%, para la cual la temperatura estaba dentro de los límites establecidos (alrededor de 100 °C) y la pérdida de peso era notablemente mayor que la de las especies no dopadas.
La tasa de sorción de hidrógeno mejora en la nanoescala debido a la corta distancia de difusión en comparación con los materiales a granel. También tienen una relación favorable entre área superficial y volumen .
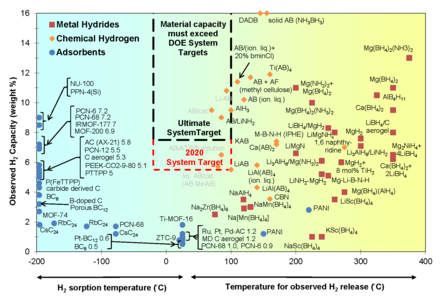
La temperatura de liberación de un material se define como la temperatura a la que comienza el proceso de desorción . La energía o temperatura para inducir la liberación afecta el costo de cualquier estrategia de almacenamiento químico. Si el hidrógeno está ligado demasiado débilmente, la presión necesaria para la regeneración es alta, cancelando así cualquier ahorro de energía. El objetivo para los sistemas de combustible de hidrógeno a bordo es aproximadamente <100 °C para la liberación y <700 bar para la recarga (20–60 kJ/mol H 2 ). [11] Una ecuación de van 't Hoff modificada relaciona la temperatura y la presión parcial del hidrógeno durante el proceso de desorción. Las modificaciones a la ecuación estándar están relacionadas con los efectos de tamaño a escala nanométrica.
Donde pH 2 es la presión parcial del hidrógeno, Δ H es la entalpía del proceso de sorción (exotérmico), Δ S es el cambio en la entropía , R es la constante del gas ideal , T es la temperatura en Kelvin, V m es el volumen molar del metal, r es el radio de la nanopartícula y γ es la energía libre superficial de la partícula.
De la relación anterior se desprende que el cambio de entalpía y entropía de los procesos de desorción depende del radio de la nanopartícula. Además, se incluye un nuevo término que tiene en cuenta el área superficial específica de la partícula y se puede demostrar matemáticamente que una disminución del radio de la partícula conduce a una disminución de la temperatura de liberación para una presión parcial dada. [12]
El enfoque actual para reducir el CO2 incluye la captura y el almacenamiento en instalaciones de todo el mundo. Sin embargo, el almacenamiento plantea barreras técnicas y económicas que impiden la aplicación a escala mundial. Para utilizar el CO2 en la fuente puntual, la hidrogenación del CO2 es un enfoque realista y práctico. La hidrogenación convencional reduce los compuestos orgánicos insaturados mediante la adición de H2 . Un método de hidrogenación del CO2 es a través de la vía del metanol. El metanol se puede utilizar para producir hidrocarburos de cadena larga. Algunas barreras de la hidrogenación del CO2 incluyen la purificación del CO2 capturado , la fuente de H2 a partir de la división del agua y las entradas de energía para la hidrogenación. Para superar estas barreras, podemos seguir desarrollando la tecnología verde del H2 y fomentar la investigación de catalizadores a nivel industrial y académico. Para aplicaciones industriales, el CO2 a menudo se convierte en metanol. Hasta ahora, se ha avanzado mucho en la conversión de CO2 en moléculas C1. Sin embargo, la conversión de CO2 en moléculas de alto valor aún enfrenta muchos obstáculos y el futuro de la hidrogenación del CO2 depende del avance de las tecnologías catalíticas. [13]
Los hidruros metálicos , como MgH2 , NaAlH4 , LiAlH4 , LiH , LaNi5H6, TiFeH2, borano de amoniaco e hidruro de paladio representan fuentes de hidrógeno almacenado. Nuevamente, los problemas persistentes son el % en peso de H2 que transportan y la reversibilidad del proceso de almacenamiento. [14] Algunos son líquidos fáciles de alimentar a temperatura y presión ambiente, mientras que otros son sólidos que podrían convertirse en pellets. Estos materiales tienen una buena densidad energética , aunque su energía específica es a menudo peor que la de los principales combustibles de hidrocarburos .
LiNH2 , LiBH4 y NaBH4 . [15]
Un método alternativo para reducir las temperaturas de disociación es el dopaje con activadores. Esta estrategia se ha utilizado para el hidruro de aluminio , pero la síntesis compleja hace que el enfoque sea poco atractivo. [16]
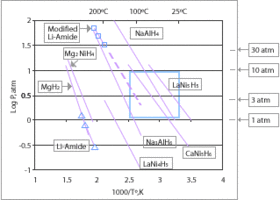
Los hidruros propuestos para su uso en una economía del hidrógeno incluyen hidruros simples de magnesio [17] o metales de transición e hidruros metálicos complejos , que normalmente contienen sodio , litio o calcio y aluminio o boro . Los hidruros elegidos para aplicaciones de almacenamiento proporcionan baja reactividad (alta seguridad) y altas densidades de almacenamiento de hidrógeno. Los principales candidatos son el hidruro de litio , el borohidruro de sodio , el hidruro de litio y aluminio y el borano de amoniaco . Una empresa francesa, McPhy Energy, está desarrollando el primer producto industrial, basado en hidruro de magnesio, ya vendido a algunos clientes importantes como Iwatani y ENEL.
El almacenamiento reversible de hidrógeno se exhibe mediante el par de Lewis frustrado , que produce un borohidruro. [18] [19] [20]
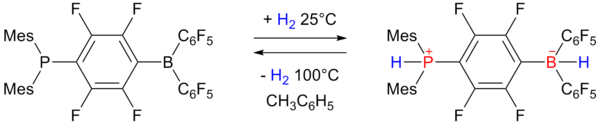
El fosfinoborano de la izquierda acepta un equivalente de hidrógeno a una atmósfera y 25 °C y lo vuelve a expulsar al calentarlo a 100 °C. La capacidad de almacenamiento es del 0,25 % en peso.
El hidrógeno se puede producir a partir del aluminio haciéndolo reaccionar con agua. [21] Anteriormente se creía que, para reaccionar con el agua, el aluminio debe ser despojado de su capa de óxido natural utilizando sustancias cáusticas, aleaciones, [22] o mezclándolo con galio (que produce nanopartículas de aluminio que permiten que el 90% del aluminio reaccione). [23] Desde entonces se ha demostrado que es posible una reacción eficiente aumentando la temperatura y la presión de la reacción. [24] El subproducto de la reacción para crear hidrógeno es óxido de aluminio , que puede reciclarse nuevamente en aluminio con el proceso Hall-Héroult , lo que hace que la reacción sea teóricamente renovable. Aunque esto requiere electrólisis, que consume una gran cantidad de energía, la energía luego se almacena en el aluminio (y se libera cuando el aluminio reacciona con agua).
Los materiales de almacenamiento de hidrógeno a base de Mg se pueden clasificar en tres categorías: Mg puro, aleaciones a base de Mg y compuestos a base de Mg. En particular, más de 300 tipos de aleaciones de almacenamiento de hidrógeno a base de Mg han recibido una gran atención [25] debido a su rendimiento general relativamente mejor. No obstante, la cinética inferior de absorción/desorción de hidrógeno, que tiene su origen en la estabilidad termodinámica excesivamente indebida del hidruro metálico, hace que las aleaciones de almacenamiento de hidrógeno a base de Mg actualmente no sean apropiadas para las aplicaciones reales y, por lo tanto, se han dedicado intentos masivos para superar estas deficiencias. Algunos métodos de preparación de muestras, como la fundición, la sinterización de polvo, la difusión, la aleación mecánica, el método de síntesis de combustión por hidruración, el tratamiento de superficies y el tratamiento térmico, etc., se han empleado ampliamente para alterar el rendimiento dinámico y la vida útil de las aleaciones de almacenamiento de hidrógeno a base de Mg. Además, algunas estrategias de modificación intrínseca, incluyendo aleación, [26] [27] [28] [29] nanoestructuración, [30] [31] [32] dopaje por aditivos catalíticos, [33] [34] y adquisición de nanocompuestos con otros hidruros, [35] [36] etc., se han explorado principalmente para aumentar intrínsecamente el rendimiento de las aleaciones de almacenamiento de hidrógeno basadas en Mg. [37] Al igual que el aluminio, el magnesio también reacciona con agua para producir hidrógeno. [38]
De las aleaciones primarias de almacenamiento de hidrógeno desarrolladas anteriormente, se cree que los materiales de almacenamiento de hidrógeno a base de Mg y Mg ofrecen la notable posibilidad de aplicación práctica, debido a las siguientes ventajas: 1) el recurso de Mg es abundante y económico. El elemento Mg existe en abundancia y representa aproximadamente el 2,35 % de la corteza terrestre, ocupando el octavo lugar; 2) baja densidad de solo 1,74 g cm-3; 3) capacidad superior de almacenamiento de hidrógeno. Las cantidades teóricas de almacenamiento de hidrógeno del Mg puro son del 7,6 % en peso (porcentaje en peso), [39] [40] [41] y del Mg2Ni es del 3,6 % en peso, respectivamente. [37]
El alanato de litio (LiAlH 4 ) se sintetizó por primera vez en 1947 mediante la disolución de hidruro de litio en una solución etérea de cloruro de aluminio. [42] El LiAlH 4 tiene una capacidad gravimétrica teórica de 10,5 % en peso de H 2 y se deshidrogena en los siguientes tres pasos: [43] [44] [45] 3LiAlH 4 ↔ Li 3 AlH 6 + 3H 2 + 2Al (423–448 K; 5,3 % en peso de H 2 ; ∆H = −10 kJ·mol−1 H 2 ); Li 3 AlH 6 ↔ 3LiH + Al + 1,5H 2 (453–493 K; 2,6 % en peso de H 2 ; ∆H = 25 kJ·mol−1 H 2 ); 3LiH + 3Al ↔ 3LiAl + 3/2H 2 (>673 K; 2,6 % en peso de H 2 ; ∆H = 140 kJ·mol−1 H 2 ). [46] Los dos primeros pasos dan lugar a una cantidad total de hidrógeno liberado igual al 7,9 % en peso, lo que podría resultar atractivo para aplicaciones prácticas, pero las temperaturas de trabajo y la cinética de desorción aún están lejos de los objetivos prácticos. En los últimos años se han aplicado varias estrategias para superar estos límites, como la molienda con bolas y la adición de catalizadores. [47] [48] [49] [50] [51] [46]
El alanato de potasio (KAlH 4 ) fue preparado por primera vez por Ashby et al. [52] mediante síntesis de un solo paso en tolueno, tetrahidrofurano y diglima. En cuanto a las propiedades de absorción y desorción de hidrógeno, este alanato fue poco estudiado. Morioka et al., [53] mediante análisis de desorción programada por temperatura (TPD), propusieron el siguiente mecanismo de deshidrogenación: 3KAlH 4 → K 3 AlH 6 + 2Al + 3H 2 (573 K, ∆H = 55 kJ·mol−1 H 2 ; 2,9 % en peso de H 2 ), K 3 AlH 6 → 3KH + Al + 3/2H 2 (613 K, ∆H = 70 kJ·mol−1 H 2 ; 1,4 % en peso de H 2 ), 3KH → 3K + 3/2H 2 (703 K, 1,4 % en peso de H 2 ). Se demostró que estas reacciones eran reversibles sin la adición de catalizadores a presiones y temperaturas de hidrógeno relativamente bajas. Se descubrió que la adición de TiCl3 disminuía la temperatura de trabajo del primer paso de deshidrogenación en 50 K, [54] pero no se registraron variaciones para los dos últimos pasos de reacción. [46]
Los compuestos orgánicos insaturados pueden almacenar enormes cantidades de hidrógeno. Estos portadores de hidrógeno orgánico líquido (LOHC) se hidrogenan para su almacenamiento y se deshidrogenan nuevamente cuando se necesita energía/hidrógeno. Usando LOHC, se pueden alcanzar densidades de almacenamiento gravimétrico relativamente altas (alrededor del 6 % en peso) y la eficiencia energética general es mayor que para otras opciones de almacenamiento químico, como la producción de metano a partir del hidrógeno. [55] Tanto la hidrogenación como la deshidrogenación de LOHC requieren catalizadores. [56] Se demostró que reemplazar hidrocarburos por heteroátomos, como N, O, etc., mejora las propiedades de deshidrogenación reversible.
La investigación sobre LOHC se concentró en los cicloalcanos en una etapa temprana, con su capacidad de hidrógeno relativamente alta (6-8 % en peso) y producción de hidrógeno libre de CO x [56] Los compuestos aromáticos heterocíclicos (o N-heterociclos) también son apropiados para esta tarea. Un compuesto que aparece en la investigación de LOHC es N-etilcarbazol [de] (NEC) [57] pero existen muchos otros. [58] El dibenciltolueno, que ya se utiliza como fluido de transferencia de calor en la industria, fue identificado como un LOHC potencial. Con un amplio rango de líquido entre -39 °C (punto de fusión) y 390 °C (punto de ebullición) y una densidad de almacenamiento de hidrógeno de 6.2 % en peso, el dibenciltolueno es ideal como material LOHC [59] El ácido fórmico se ha sugerido como un material de almacenamiento de hidrógeno prometedor con una capacidad de hidrógeno de 4.4 % en peso [60]
Los cicloalcanos que se describen como LOHC incluyen ciclohexano, metil-ciclohexano y decalina. La deshidrogenación de cicloalcanos es altamente endotérmica (63-69 kJ/mol H2 ) , lo que significa que este proceso requiere alta temperatura. [56] La deshidrogenación de decalina es la más favorecida termodinámicamente entre los tres cicloalcanos, y el metil-ciclohexano es el segundo debido a la presencia del grupo metilo. [61] La investigación sobre el desarrollo de catalizadores para la deshidrogenación de cicloalcanos se ha llevado a cabo durante décadas. Los catalizadores a base de níquel (Ni), molibdeno (Mo) y platino (Pt) son muy investigados para la deshidrogenación. Sin embargo, la coquización sigue siendo un gran desafío para la estabilidad a largo plazo del catalizador. [62] [63]
La temperatura requerida para la hidrogenación y deshidrogenación cae significativamente para heterociclos vs carbociclos simples. [64] Entre todos los N-heterociclos, el par saturado-insaturado de dodecahidro-N-etilcarbazol (12H-NEC) y NEC ha sido considerado como un candidato prometedor para el almacenamiento de hidrógeno con un contenido de hidrógeno bastante grande (5.8% en peso). [65] La figura en la parte superior derecha muestra la deshidrogenación e hidrogenación del par 12H-NEC y NEC. El catalizador estándar para NEC a 12H-NEC se basa en Ru y Rh. La selectividad de la hidrogenación puede alcanzar el 97% a 7 MPa y 130 °C-150 °C. [56] Aunque los N-heterociclos pueden optimizar las propiedades termodinámicas desfavorables de los cicloalcanos, muchos problemas permanecen sin resolver, como el alto costo, la alta toxicidad y las barreras cinéticas, etc. [56]
Los líquidos iónicos de imidazolio, como las sales de alquil(aril)-3-metilimidazolio N-bis(trifluorometanosulfonil)imidato, pueden agregar de forma reversible entre 6 y 12 átomos de hidrógeno en presencia de catalizadores clásicos de nanopartículas de Pd/C o Ir0 y pueden utilizarse como materiales alternativos para dispositivos de almacenamiento de hidrógeno a bordo. Estas sales pueden contener hasta 30 g L −1 de hidrógeno a presión atmosférica. [66]
El ácido fórmico es un material de almacenamiento de hidrógeno muy eficaz, aunque su densidad de H 2 es baja. Se ha generado hidrógeno libre de monóxido de carbono en un rango de presión muy amplio (1–600 bar). Un sistema catalítico homogéneo basado en catalizadores de rutenio solubles en agua descompone selectivamente HCOOH en H 2 y CO 2 en solución acuosa. [67] Este sistema catalítico supera las limitaciones de otros catalizadores (por ejemplo, poca estabilidad, tiempos de vida catalíticos limitados, formación de CO) para la descomposición del ácido fórmico, lo que lo convierte en un material de almacenamiento de hidrógeno viable. [68] Y el coproducto de esta descomposición, el dióxido de carbono, se puede utilizar como vector de hidrógeno hidrogenándolo de nuevo a ácido fórmico en un segundo paso. La hidrogenación catalítica de CO 2 se ha estudiado durante mucho tiempo y se han desarrollado procedimientos eficientes. [69] [70] El ácido fórmico contiene 53 g L −1 de hidrógeno a temperatura ambiente y presión atmosférica. En peso, el ácido fórmico puro almacena 4,3 % en peso de hidrógeno. El ácido fórmico puro es un líquido con un punto de inflamación de 69 °C (cf. gasolina −40 °C, etanol 13 °C). El ácido fórmico al 85% no es inflamable.
El amoníaco (NH3 ) libera H2 en un reformador catalítico apropiado. El amoníaco proporciona altas densidades de almacenamiento de hidrógeno como líquido con una presurización suave y restricciones criogénicas: también se puede almacenar como líquido a temperatura y presión ambiente cuando se mezcla con agua. El amoníaco es el segundo producto químico más producido en el mundo y existe una gran infraestructura para fabricarlo, transportarlo y distribuirlo. El amoníaco se puede reformar para producir hidrógeno sin residuos nocivos, o se puede mezclar con combustibles existentes y, en las condiciones adecuadas, quemarse de manera eficiente. Como no hay carbono en el amoníaco, no se producen subproductos de carbono, lo que hace de esta posibilidad una opción "neutral en carbono" para el futuro. El amoníaco puro se quema mal a las presiones atmosféricas que se encuentran en los calentadores de agua y estufas a gas natural. Bajo compresión en un motor de automóvil, es un combustible adecuado para motores de gasolina ligeramente modificados. El amoníaco es un combustible alternativo adecuado porque tiene una densidad energética de 18,6 MJ/kg a NTP y subproductos de combustión libres de carbono. [71]
El amoniaco tiene varios desafíos para su adaptación generalizada como material de almacenamiento de hidrógeno. El amoniaco es un gas tóxico con un olor potente a temperatura y presión estándar. [72] Además, se necesitan avances en la eficiencia y escalabilidad de la descomposición del amoniaco para la viabilidad comercial, ya que las membranas de las celdas de combustible son muy sensibles al amoniaco residual y las técnicas de descomposición actuales tienen bajas tasas de rendimiento. [73] Se puede utilizar una variedad de metales de transición para catalizar la reacción de descomposición del amoniaco, siendo el más eficaz el rutenio . Esta catálisis funciona a través de la quimisorción , donde la energía de adsorción de N 2 es menor que la energía de reacción de disociación. [74] La purificación del hidrógeno se puede lograr de varias formas. El hidrógeno se puede separar del amoniaco sin reaccionar utilizando una membrana permeable selectiva al hidrógeno. [75] También se puede purificar a través de la adsorción de amoniaco, que puede quedar atrapado de forma selectiva debido a su polaridad. [76]
En septiembre de 2005, químicos de la Universidad Técnica de Dinamarca anunciaron un método para almacenar hidrógeno en forma de amoníaco saturado en una pastilla de sal. Afirman que será un método de almacenamiento económico y seguro. [77] [ necesita actualización ]
La hidracina se descompone en la célula para formar nitrógeno e hidrógeno . [78] Los hidruros de silicio y los hidruros de germanio también son candidatos a materiales de almacenamiento de hidrógeno, ya que pueden estar sujetos a una reacción energéticamente favorecida para formar dímeros unidos covalentemente con pérdida de una molécula de hidrógeno. [79] [80]
Antes de 1980, se investigaron varios compuestos para el almacenamiento de hidrógeno, incluidos los borohidruros complejos o aluminohidruros y las sales de amonio. Estos hidruros tienen un rendimiento teórico superior de hidrógeno limitado a aproximadamente el 8,5% en peso. Entre los compuestos que contienen solo B, N y H (tanto iones positivos como negativos), los ejemplos representativos incluyen: aminaboranos, amoniatos de hidruro de boro, complejos de hidrazina-borano y octahidrotriboratos o tetrahidroboratos de amonio. De estos, los aminaboranos (y especialmente el borano de amoniaco ) se han investigado ampliamente como portadores de hidrógeno. Durante las décadas de 1970 y 1980, el Ejército y la Marina de los EE. UU. financiaron esfuerzos destinados a desarrollar compuestos generadores de gas de hidrógeno/deuterio para su uso en los láseres químicos HF/DF y HCl y en los láseres dinámicos de gas. Las formulaciones anteriores de generación de gas de hidrógeno usaban aminaboranos y sus derivados. La ignición de los boranos de amina forma nitruro de boro (BN) y gas hidrógeno. Además del borano de amoniaco (H 3 BNH 3 ), otros generadores de gas incluyen el diamoniato de diborano, H 2 B(NH 3 ) 2 BH 4 . [ cita requerida ]
En este caso, el hidrógeno permanece en formas físicas, es decir, como gas, fluido supercrítico, adsorbato o inclusiones moleculares. Se consideran las limitaciones teóricas y los resultados experimentales [81] en relación con la capacidad volumétrica y gravimétrica de los microrrecipientes de vidrio, los medios microporosos y nanoporosos, así como las exigencias de seguridad y tiempo de recarga. Debido a que el hidrógeno es la molécula más pequeña, se escapa fácilmente de los contenedores y durante la transferencia de un contenedor a otro, y el hidrógeno filtrado tiene un efecto de calentamiento global 11,6 veces más fuerte que el CO₂. [82]
Las zeolitas son materiales de aluminosilicato microporosos y altamente cristalinos . Como presentan estructuras de jaula y túnel, ofrecen el potencial para la encapsulación de gases no polares como el H 2 . En este sistema, el hidrógeno se fisisorbe en la superficie de los poros de la zeolita a través de un mecanismo de adsorción que implica que el hidrógeno sea forzado hacia los poros bajo presión y baja temperatura. [83] Por lo tanto, de manera similar a otros materiales porosos, su capacidad de almacenamiento de hidrógeno depende del área superficial BET , el volumen de poro, la interacción del hidrógeno molecular con las superficies internas de los microporos y las condiciones de trabajo como la presión y la temperatura. [84]
Las investigaciones muestran que el diámetro del canal también es uno de los parámetros que determinan esta capacidad, especialmente a alta presión. En este caso, un material eficaz debe presentar un gran volumen de poros y un diámetro del canal cercano al diámetro cinético de la molécula de hidrógeno (d H = 2,89 Å). [83]
La siguiente tabla muestra la absorción de hidrógeno de varias zeolitas a la temperatura del nitrógeno líquido (77 K):
Los carbones activados son materiales de carbono amorfos altamente porosos con una gran área superficial aparente. La fisisorción de hidrógeno se puede aumentar en estos materiales aumentando el área superficial aparente y optimizando el diámetro de poro a alrededor de 7 Å. [86] Estos materiales son de particular interés debido al hecho de que se pueden fabricar a partir de materiales de desecho, como colillas de cigarrillos, que han demostrado un gran potencial como materiales precursores para materiales de almacenamiento de hidrógeno de alta capacidad. [87] [88]
El grafeno puede almacenar hidrógeno de manera eficiente. El H2 se suma a los enlaces dobles y forma el grafeno . El hidrógeno se libera al calentarlo a 450 °C. [89] [90]
Se han propuesto portadores de hidrógeno basados en carbono nanoestructurado (como buckyballs de carbono y nanotubos ). Sin embargo, el contenido de hidrógeno asciende a aproximadamente 3,0-7,0 % en peso a 77 K, lo que está lejos del valor establecido por el Departamento de Energía de los EE. UU. (6 % en peso en condiciones casi ambientales). [ cita requerida ]
Para realizar materiales de carbono como tecnologías efectivas de almacenamiento de hidrógeno, los nanotubos de carbono (CNT) se han dopado con MgH 2 . [10] El hidruro metálico ha demostrado tener una capacidad de almacenamiento teórica (7,6 % en peso) que cumple con el requisito del Departamento de Energía de los Estados Unidos de 6 % en peso, pero tiene aplicaciones prácticas limitadas debido a su alta temperatura de liberación. El mecanismo propuesto implica la creación de canales de difusión rápida por CNT dentro de la red de MgH 2 . Las sustancias de fulereno son otros nanomateriales carbonosos que se han probado para el almacenamiento de hidrógeno en este centro. Las moléculas de fulereno están compuestas por una estructura de jaula cerrada C 60 , que permite la hidrogenación de los carbonos de doble enlace que conducen a un isómero C 60 H 60 teórico con un contenido de hidrógeno de 7,7 % en peso. Sin embargo, la temperatura de liberación en estos sistemas es alta (600 °C).
Los marcos metalorgánicos representan otra clase de materiales porosos sintéticos que almacenan hidrógeno y energía a nivel molecular. Los MOF son estructuras híbridas inorgánicas-orgánicas altamente cristalinas que contienen grupos de metales o iones (unidades de construcción secundarias) como nodos y ligandos orgánicos como enlaces. Cuando las moléculas huésped (disolvente) que ocupan los poros se eliminan durante el intercambio de disolvente y el calentamiento al vacío, se puede lograr la estructura porosa de los MOF sin desestabilizar el marco y las moléculas de hidrógeno se adsorberán en la superficie de los poros por fisisorción. En comparación con las zeolitas tradicionales y los materiales de carbono porosos, los MOF tienen una cantidad muy alta de poros y área de superficie que permiten una mayor absorción de hidrógeno en un volumen determinado. Por lo tanto, los intereses de investigación sobre el almacenamiento de hidrógeno en MOF han ido creciendo desde 2003, cuando se introdujo el primer almacenamiento de hidrógeno basado en MOF. Dado que existen infinitas variaciones geométricas y químicas de los MOF basadas en diferentes combinaciones de SBU y enlaces, muchas investigaciones exploran qué combinación proporcionará la máxima absorción de hidrógeno mediante la variación de materiales de iones metálicos y enlaces. [ cita requerida ]
La temperatura, la presión y la composición de los MOF pueden influir en su capacidad de almacenamiento de hidrógeno. La capacidad de adsorción de los MOF es menor a mayor temperatura y mayor a menor temperatura. Con el aumento de la temperatura, la fisisorción disminuye y la quimisorción aumenta. [91] Para MOF-519 y MOF-520, el calor isostérico de adsorción disminuyó con el aumento de la presión. [92] Para MOF-5, la captación de hidrógeno gravimétrica y volumétrica aumentó con el aumento de la presión. [91] La capacidad total puede no ser consistente con la capacidad utilizable en condiciones de oscilación de presión. Por ejemplo, MOF-5 e IRMOF-20, que tienen la mayor capacidad volumétrica total, muestran la menor capacidad volumétrica utilizable. [93] La capacidad de absorción se puede aumentar mediante la modificación de la estructura. Por ejemplo, la captación de hidrógeno de PCN-68 es mayor que la de PCN-61. [94] Los marcos aromáticos porosos (PAF-1), que se conocen como un material de área superficial alta, pueden lograr un área superficial mayor mediante dopaje. [95]
Existen muchas formas diferentes de modificar los MOF, como los catalizadores MOF, los híbridos MOF, los MOF con centros metálicos y el dopaje. Los catalizadores MOF tienen una gran área superficial, porosidad y capacidad de almacenamiento de hidrógeno. Sin embargo, los centros metálicos activos son bajos. Los híbridos MOF tienen una mayor área superficial, porosidad, capacidad de carga y capacidad de almacenamiento de hidrógeno. Sin embargo, no son estables y carecen de centros activos. El dopaje en los MOF puede aumentar la capacidad de almacenamiento de hidrógeno, pero puede haber un efecto estérico y los metales inertes tienen una estabilidad inadecuada. Puede haber formación de poros interconectados y baja resistencia a la corrosión en los MOF con centros metálicos, mientras que pueden tener una buena energía de enlace y una estabilidad mejorada. Estas ventajas y desventajas para los diferentes tipos de MOF modificados muestran que los híbridos MOF son más prometedores debido a la buena capacidad de control en la selección de materiales para una gran área superficial, porosidad y estabilidad. [91]
En 2006, los químicos lograron concentraciones de almacenamiento de hidrógeno de hasta 7,5 % en peso en MOF-74 a una temperatura baja de 77 K. [ 96] [97] En 2009, los investigadores alcanzaron 10 % en peso a 77 bar (1117 psi) y 77 K con MOF NOTT-112. [98] La mayoría de los artículos sobre almacenamiento de hidrógeno en MOF informan la capacidad de absorción de hidrógeno a una temperatura de 77 K y una presión de 1 bar porque estas condiciones están comúnmente disponibles y la energía de enlace entre el hidrógeno y el MOF a esta temperatura es grande en comparación con la energía de vibración térmica. Variar varios factores como el área de superficie, el tamaño de poro, la concatenación, la estructura del ligando y la pureza de la muestra puede dar como resultado diferentes cantidades de absorción de hidrógeno en MOF.
En 2020, los investigadores informaron que NU-1501-Al, una estructura metalorgánica ultraporosa (MOF) basada en grupos trinucleares de metal, produjo "impresionantes rendimientos de almacenamiento gravimétrico y volumétrico para hidrógeno y metano", con una capacidad de suministro de hidrógeno de 14,0 % p/p, 46,2 g/litro. [99] [100]
El almacenamiento criocomprimido de hidrógeno es la única tecnología que cumple con los objetivos del DOE para 2015 en cuanto a eficiencia volumétrica y gravimétrica (ver "CcH2" en la diapositiva 6 en [101] ).
Además, otro estudio ha demostrado que la criocompresión presenta interesantes ventajas en términos de costos: el costo de propiedad (precio por milla) y el costo del sistema de almacenamiento (precio por vehículo) son en realidad los más bajos en comparación con cualquier otra tecnología (ver la tercera fila en la diapositiva 13 de [102] ).
Al igual que el almacenamiento líquido, el criocomprimido utiliza hidrógeno frío (20,3 K y ligeramente superior) para alcanzar una alta densidad energética. Sin embargo, la principal diferencia es que, cuando el hidrógeno se calienta debido a la transferencia de calor con el entorno ("evaporación"), el tanque puede alcanzar presiones mucho más altas (hasta 350 bares en comparación con un par de bares para el almacenamiento líquido). Como consecuencia, lleva más tiempo antes de que el hidrógeno tenga que ventilarse y, en la mayoría de las situaciones de conducción, el automóvil utiliza suficiente hidrógeno para mantener la presión muy por debajo del límite de ventilación. [ cita requerida ]
En consecuencia, se ha demostrado que se puede lograr una gran autonomía con un tanque criocomprimido: se recorrieron más de 650 millas (1050 km) con un tanque lleno montado en un motor alimentado con hidrógeno de un Toyota Prius . [103] Todavía se están realizando investigaciones para estudiar y demostrar todo el potencial de la tecnología. [104]
A partir de 2010, el Grupo BMW ha iniciado una exhaustiva validación a nivel de componentes y sistemas del almacenamiento de vehículos criocomprimidos en su camino hacia un producto comercial. [105]
El H2 enjaulado en un hidrato de clatrato se informó por primera vez en 2002, pero requiere presiones muy altas para ser estable. En 2004, los investigadores demostraron que se podían formar hidratos sólidos que contenían H2 a temperatura ambiente y decenas de bares añadiendo pequeñas cantidades de sustancias promotoras como THF . [106] [107] Estos clatratos tienen una densidad máxima teórica de hidrógeno de alrededor del 5 % en peso y 40 kg/ m3 .
Un equipo de científicos rusos, israelíes y alemanes han desarrollado en colaboración una tecnología innovadora basada en matrices de capilares de vidrio para la infusión segura, el almacenamiento y la liberación controlada de hidrógeno en aplicaciones móviles. [108] [109] La tecnología C.En ha alcanzado los objetivos del Departamento de Energía de los Estados Unidos (DOE) para 2010 para sistemas de almacenamiento de hidrógeno a bordo. [110] Los objetivos del DOE para 2015 se pueden alcanzar utilizando capilares de vidrio flexibles y un método criocomprimido de almacenamiento de hidrógeno. [111]
Las microesferas de vidrio huecas (HGM) se pueden utilizar para el almacenamiento y la liberación controlados de hidrógeno. Las HGM con un diámetro de 1 a 100 μm, una densidad de 1,0 a 2,0 gm/cc y una pared porosa con aberturas de 10 a 1000 angstroms se consideran para el almacenamiento de hidrógeno. Las ventajas de las HGM para el almacenamiento de hidrógeno son que no son tóxicas, ligeras, baratas, reciclables, reversibles, se manipulan fácilmente en condiciones atmosféricas, se pueden almacenar en un tanque y el hidrógeno que contienen no es explosivo. [112] Cada una de estas HGM es capaz de contener hidrógeno hasta 150 MPa sin la pesadez y el volumen de un gran tanque presurizado. Todas estas cualidades son favorables en aplicaciones vehiculares. Más allá de estas ventajas, las HGM se consideran una posible solución de hidrógeno debido a que la difusividad del hidrógeno tiene una gran dependencia de la temperatura. A temperatura ambiente, la difusividad es muy baja y el hidrógeno queda atrapado en la HGM. La desventaja de los HGM es que para llenar y desgasificar el hidrógeno de manera efectiva, la temperatura debe ser de al menos 300 °C, lo que aumenta significativamente el costo operativo del HGM en el almacenamiento de hidrógeno. [113] La alta temperatura se puede atribuir en parte a que el vidrio es un aislante y tiene una baja conductividad térmica ; esto dificulta la difusión del hidrógeno y, posteriormente, se requiere una temperatura más alta para lograr la capacidad de almacenamiento deseada.
Para que esta tecnología sea económicamente viable para su uso comercial, se están realizando investigaciones para aumentar la eficiencia de la difusión de hidrógeno a través de los HGM. Un estudio realizado por Dalai et al. buscó aumentar la conductividad térmica del HGM mediante la dopación del vidrio con cobalto . Al hacerlo, aumentaron la conductividad térmica de 0,0072 a 0,198 W/mK con un 10 % en peso de Co. Sin embargo, solo se observaron aumentos en la adsorción de hidrógeno hasta un 2 % en peso de Co (0,103 W/mK) a medida que el óxido metálico comenzó a cubrir los poros en la cubierta de vidrio. Este estudio concluyó con una capacidad de almacenamiento de hidrógeno de 3,31 % en peso con un 2 % en peso de Co a 200 °C y 10 bar. [112]
Un estudio realizado por Rapp y Shelby buscó aumentar la tasa de liberación de hidrógeno a través de la desgasificación fotoinducida en HGM dopados en comparación con los métodos de calentamiento convencionales. El vidrio se dopó con metales ópticamente activos para interactuar con la luz infrarroja de alta intensidad . El estudio descubrió que el vidrio de borosilicato 7070 dopado con 0,5 % en peso de Fe3O4 tuvo un aumento de liberación de hidrógeno proporcional a la intensidad de la lámpara infrarroja. Además de las mejoras en la difusividad solo por infrarrojos, las reacciones entre el hidrógeno y el vidrio dopado con hierro aumentaron la relación Fe2 + /Fe3 +, lo que aumentó la absorción infrarroja y, por lo tanto, aumentó aún más el rendimiento de hidrógeno. [114]
A partir de 2020, el progreso logrado en el estudio de los HGM ha aumentado su eficiencia, pero aún está lejos de alcanzar los objetivos del Departamento de Energía para esta tecnología. Las temperaturas de operación tanto para la adsorción como para la liberación de hidrógeno son la mayor barrera para la comercialización . [115]
A diferencia de las aplicaciones móviles, la densidad del hidrógeno no es un gran problema para las aplicaciones estacionarias. En cuanto a las aplicaciones móviles, las estacionarias pueden utilizar tecnología establecida:

El almacenamiento subterráneo de hidrógeno [118] es la práctica de almacenar hidrógeno en cavernas , domos de sal y campos de petróleo y gas agotados. ICI ha almacenado grandes cantidades de hidrógeno gaseoso en cavernas durante muchos años sin ninguna dificultad. [119] El almacenamiento subterráneo de grandes cantidades de hidrógeno líquido puede funcionar como almacenamiento de energía de la red . La eficiencia de ida y vuelta es de aproximadamente el 40% (frente al 75-80% para la hidroeléctrica bombeada (PHES) ), y el costo es ligeramente más alto que la hidroeléctrica bombeada, si solo se requiere un número limitado de horas de almacenamiento. [120] Otro estudio al que se hace referencia en un documento de trabajo del personal europeo encontró que para el almacenamiento a gran escala, la opción más barata es el hidrógeno a 140 €/MWh para 2000 horas de almacenamiento utilizando un electrolizador, almacenamiento en cavernas de sal y una planta de energía de ciclo combinado. [117] : 15 El proyecto europeo Hyunder [121] indicó en 2013 que para el almacenamiento de energía eólica y solar se requieren 85 cavernas adicionales, ya que no pueden cubrirse con sistemas PHES y CAES . [122] Un estudio de caso alemán sobre el almacenamiento de hidrógeno en cavernas de sal encontró que si el excedente de energía alemán (7% de la generación renovable variable total para 2025 y 20% para 2050) se convirtiera en hidrógeno y se almacenara bajo tierra, estas cantidades requerirían unas 15 cavernas de 500.000 metros cúbicos cada una para 2025 y unas 60 cavernas para 2050, lo que corresponde aproximadamente a un tercio del número de cavernas de gas que operan actualmente en Alemania. [123] En los EE. UU., Sandia Labs está realizando investigaciones sobre el almacenamiento de hidrógeno en campos de petróleo y gas agotados, que podrían absorber fácilmente grandes cantidades de hidrógeno producido de manera renovable, ya que existen alrededor de 2,7 millones de pozos agotados. [124]
El almacenamiento subterráneo de hidrógeno es la práctica de almacenar hidrógeno en cavernas , [125] [126] domos de sal y campos de petróleo / gas agotados . [127] [128] Grandes cantidades de hidrógeno gaseoso se han almacenado en cavernas durante muchos años. [129] [ verificación fallida – ver discusión ] [ ¿ fuente poco confiable? ] El almacenamiento de grandes cantidades de hidrógeno bajo tierra en domos de sal extraídos por solución , [130] acuíferos , [131] cavernas de roca excavadas o minas puede funcionar como almacenamiento de energía de la red , [132] esencial para la economía del hidrógeno . [133] Al usar un turboexpansor, las necesidades de electricidad para el almacenamiento comprimido a 200 bar ascienden al 2,1% del contenido energético. [134]
La terminal Chevron Phillips Clemens en Texas ha almacenado hidrógeno desde la década de 1980 en una caverna de sal extraída por disolución. El techo de la caverna está a unos 850 m (2800 pies) bajo tierra. La caverna es un cilindro con un diámetro de 49 m (160 pies), una altura de 300 m (1000 pies) y una capacidad de hidrógeno utilizable de 30,2 × 10 6 m 3 (1066 millones de pies cúbicos ), o 2520 toneladas métricas (2480 toneladas largas; 2780 toneladas cortas). [135]
Las cavernas de sal se crean artificialmente inyectando agua de la superficie en un pozo en la sal de roca, donde la sal de roca es un material policristalino hecho de NaCl, halita. Por lo general, se eligen lugares como domos de sal o sal estratificada para la creación de cavernas de sal. Las cavernas de sal pueden alcanzar una profundidad máxima de 2000 m y una capacidad máxima de volumen de 1 000 000 m3. La frecuencia de los ciclos de inyección y extracción varía entre 10 y 12 ciclos por año. Y la tasa de fuga es de alrededor del 1%. [136] [137]
Debido a las propiedades fisicoquímicas de la sal de roca, las cavernas de sal presentan múltiples ventajas. Las características clave son el bajo contenido de agua, la baja porosidad y permeabilidad, y su inercia química hacia el hidrógeno. [138] La permeabilidad es un parámetro clave en el almacenamiento subterráneo de hidrógeno, que afecta su capacidad de sellado. Aunque los estudios han encontrado que la dilatación y la fractura extensional pueden causar un aumento significativo de la permeabilidad, la recristalización del cristal de sal de roca, que es un proceso de curación de los límites de grano, puede contribuir a su rigidez mecánica y recuperación de la permeabilidad. [139] Sus propiedades plásticas previenen la formación y propagación de fracturas y lo protegen de perder su estanqueidad, lo que es particularmente importante para el almacenamiento de hidrógeno. [138] Algunas de las desventajas de las cavernas de sal incluyen una menor capacidad de almacenamiento, una gran cantidad de agua necesaria y el efecto de la corrosión. Se necesita gas de colchón para evitar el deslizamiento debido a la caída de presión al retirar gas del depósito. Aunque la necesidad de gas de colchón es relativamente pequeña, alrededor del 20%, el costo operativo aún puede sumarse cuando se trabaja con una mayor capacidad de almacenamiento. El costo es otra gran preocupación, ya que los costos de construcción y operación aún son altos. [137] [140]
Aunque la gente tiene experiencia en el almacenamiento de gas natural, el almacenamiento de hidrógeno es mucho más complejo. Factores como la difusividad del hidrógeno en sólidos provocan restricciones en el almacenamiento en cavernas de sal. La actividad microbiana es objeto de una amplia investigación en todo el mundo debido a su impacto en la pérdida de hidrógeno. Como resultado del metabolismo bacteriano de las bacterias metanogénicas, se consume dióxido de carbono e hidrógeno y se produce metano, lo que conduce a la pérdida de hidrógeno almacenado en las cavernas de sal. [141] [140]
Una caverna de 800 m de altura y 50 m de diámetro puede contener hidrógeno equivalente a 150 GWh. [147] [148]
Power to gas es una tecnología que convierte la energía eléctrica en un combustible gaseoso . Hay dos métodos: el primero es utilizar la electricidad para dividir el agua e inyectar el hidrógeno resultante en la red de gas natural; el segundo método, menos eficiente, se utiliza para convertir el dióxido de carbono y el hidrógeno en metano (ver gas natural ) mediante electrólisis y la reacción de Sabatier . Una tercera opción es combinar el hidrógeno mediante electrólisis con una fuente de carbono (ya sea dióxido de carbono o monóxido de carbono del biogás , de procesos industriales o mediante dióxido de carbono capturado directamente en el aire ) mediante biometanización , [149] [150] donde los biometanógenos (arqueas) consumen dióxido de carbono e hidrógeno y producen metano dentro de un entorno anaeróbico. Este proceso es muy eficiente, ya que las arqueas se auto-replican y solo requieren calor de bajo grado (60 °C) para realizar la reacción.
SoCalGas también ha logrado otro proceso para convertir el dióxido de carbono del biogás crudo en metano en un solo paso electroquímico, lo que representa un método más simple para convertir el exceso de electricidad renovable en gas natural almacenable. [151]
El Reino Unido ha completado los estudios y se está preparando para empezar a inyectar hidrógeno en la red de gas, ya que anteriormente la red transportaba "gas de ciudad", que es un gas compuesto en un 50% por hidrógeno y metano formado a partir de carbón. La auditora KPMG descubrió que convertir el Reino Unido al gas hidrógeno podría resultar entre 150.000 y 200.000 millones de libras más barato que rehacer las instalaciones eléctricas de los hogares británicos para que utilicen calefacción eléctrica alimentada por fuentes con menos emisiones de carbono. [152]
La energía excedente o la energía fuera de horas punta generada por generadores eólicos o paneles solares se puede utilizar para equilibrar la carga en la red eléctrica. Utilizando el sistema de gas natural existente para hidrógeno, el fabricante de pilas de combustible Hydrogenics y el distribuidor de gas natural Enbridge se han asociado para desarrollar un sistema de conversión de energía a gas en Canadá. [153]
Almacenamiento de hidrógeno mediante tuberías en las que se utiliza una red de gas natural para el almacenamiento de hidrógeno. Antes de cambiar al gas natural , las redes de gas alemanas funcionaban con gas de ciudad , que en su mayor parte (60-65%) consistía en hidrógeno. La capacidad de almacenamiento de la red alemana de gas natural es de más de 200.000 GW·h, lo que es suficiente para varios meses de demanda energética. En comparación, la capacidad de todas las centrales eléctricas de almacenamiento por bombeo alemanas asciende a solo unos 40 GW·h. El transporte de energía a través de una red de gas se realiza con mucha menos pérdida (<0,1%) que en una red eléctrica (8%). El uso de las tuberías de gas natural existentes para el hidrógeno fue estudiado por NaturalHy [154]
La portabilidad es uno de los mayores desafíos en la industria automotriz , donde los sistemas de almacenamiento de alta densidad son problemáticos debido a preocupaciones de seguridad. Los tanques de alta presión pesan mucho más que el hidrógeno que pueden contener. Por ejemplo, en el Toyota Mirai 2014 , un tanque lleno contiene solo un 5,7 % de hidrógeno, y el resto del peso es el tanque. [155]
Las densidades del sistema suelen ser aproximadamente la mitad de las del material de trabajo, por lo que, mientras que un material puede almacenar un 6 % en peso de H2 , un sistema de trabajo que utilice ese material puede alcanzar solo un 3 % en peso cuando se considera el peso de los tanques, el equipo de control de temperatura y presión, etc. [ cita requerida ]
Debido a sus características de combustión limpia, el hidrógeno es una alternativa de combustible limpio para la industria automotriz. El combustible basado en hidrógeno podría reducir significativamente las emisiones de gases de efecto invernadero como CO2 , SO2 y NOx . Tres problemas para el uso de celdas de combustible de hidrógeno (HFC) son la eficiencia, el tamaño y el almacenamiento seguro a bordo del gas. Otras desventajas importantes de esta tecnología emergente involucran problemas de costo, operabilidad y durabilidad, que aún necesitan ser mejorados con respecto a los sistemas existentes. Para abordar estos desafíos, se ha propuesto el uso de nanomateriales como una opción alternativa a los sistemas tradicionales de almacenamiento de hidrógeno. El uso de nanomateriales podría proporcionar un sistema de mayor densidad y aumentar la autonomía de conducción hacia el objetivo establecido por el DOE de 300 millas. Los materiales carbonosos como los nanotubos de carbono y los hidruros metálicos son el foco principal de la investigación. Actualmente se están considerando para sistemas de almacenamiento a bordo debido a su versatilidad, multifuncionalidad, propiedades mecánicas y bajo costo con respecto a otras alternativas. [156]
La introducción de nanomateriales en los sistemas de almacenamiento de hidrógeno a bordo puede suponer un importante punto de inflexión en la industria del automóvil. Sin embargo, el almacenamiento no es el único aspecto de la pila de combustible al que pueden contribuir los nanomateriales. Diferentes estudios han demostrado que las propiedades de transporte y catalíticas de las membranas de Nafion utilizadas en los HFC se pueden mejorar con nanopartículas de TiO2 / SnO2 . [156] El aumento del rendimiento se debe a una mejora en la cinética de división del hidrógeno debido a la actividad catalítica de las nanopartículas. Además, este sistema presenta un transporte más rápido de protones a través de la pila, lo que convierte a los HFC con membranas compuestas de nanopartículas en una alternativa prometedora.
Un grupo de investigación de la Universidad Metropolitana de Manchester (Reino Unido) ha introducido otra aplicación de los nanomateriales en la división del agua utilizando electrodos serigrafiados que consisten en un material similar al grafeno . [157] Se han desarrollado sistemas similares utilizando técnicas fotoelectroquímicas .
El aumento de la presión del gas mejora la densidad energética por volumen, lo que permite que los tanques de los contenedores sean más pequeños. El material estándar para almacenar hidrógeno presurizado en remolques tubulares es el acero (no existe ningún problema de fragilización por hidrógeno con el gas hidrógeno). Los tanques hechos de plástico reforzado con fibras de carbono y vidrio, como los que se encuentran en los camiones Toyota Marai y Kenworth, deben cumplir con las normas de seguridad. Pocos materiales son adecuados para los tanques, ya que el hidrógeno, al ser una molécula pequeña, tiende a difundirse a través de muchos materiales poliméricos. El almacenamiento de hidrógeno a bordo más común en los vehículos de 2020 fue el hidrógeno a una presión de 700 bar = 70 MPa. El costo energético de comprimir el hidrógeno a esta presión es significativo. [ cita requerida ]
Los gasoductos presurizados siempre están hechos de acero y funcionan a presiones mucho más bajas que los remolques tubulares.
Como alternativa, se puede utilizar hidrógeno líquido o hidrógeno granizado con una mayor densidad energética volumétrica. Sin embargo, el hidrógeno líquido es criogénico y hierve a 20,268 K (−252,882 °C o −423,188 °F). El almacenamiento criogénico reduce el peso, pero requiere grandes energías de licuefacción . El proceso de licuefacción, que implica pasos de presurización y enfriamiento, consume mucha energía. [158] El hidrógeno licuado tiene una densidad energética por volumen menor que la gasolina en aproximadamente un factor de cuatro, debido a la baja densidad del hidrógeno líquido: en realidad, hay más átomos de hidrógeno oxidables en un litro de gasolina (116 gramos) que en un litro de hidrógeno líquido puro (71 gramos). Como cualquier otro líquido a temperaturas criogénicas , los tanques de almacenamiento de hidrógeno líquido también deben estar bien aislados para minimizar la evaporación.
Japón cuenta con una instalación de almacenamiento de hidrógeno líquido (LH2) en una terminal en Kobe, y se esperaba que recibiera el primer envío de hidrógeno líquido a través de un transportador LH2 en 2020. [159] El hidrógeno se licúa reduciendo su temperatura a -253 °C, de forma similar al gas natural licuado (GNL), que se almacena a -162 °C. Se puede lograr una pérdida de eficiencia potencial del 12,79 %, o 4,26 kWh/kg de 33,3 kWh/kg. [160]
El almacenamiento subterráneo de hidrógeno es la práctica de almacenar hidrógeno en cavernas , domos de sal y campos de petróleo y gas agotados. ICI ha almacenado grandes cantidades de hidrógeno gaseoso en cavernas durante muchos años sin ninguna dificultad. [161] El almacenamiento subterráneo de grandes cantidades de hidrógeno líquido puede funcionar como almacenamiento de energía de la red . La eficiencia de ida y vuelta es de aproximadamente el 40% (frente al 75-80% de la energía hidroeléctrica bombeada (PHES) ), y el costo es ligeramente más alto que el de la energía hidroeléctrica bombeada. [162]
Otro estudio al que se hace referencia en un documento de trabajo europeo concluyó que, para el almacenamiento a gran escala, la opción más barata es el hidrógeno a 140 €/MWh para 2000 horas de almacenamiento utilizando un electrolizador, un almacenamiento en cavernas de sal y una planta de energía de ciclo combinado. [163] El proyecto europeo Hyunder [164] indicó en 2013 que para el almacenamiento de energía eólica y solar se requieren 85 cavernas adicionales, ya que no pueden cubrirse con los sistemas PHES y CAES . [165]
Un estudio de caso alemán sobre el almacenamiento de hidrógeno en cavernas de sal concluyó que si el excedente de energía alemán (7% de la generación renovable variable total para 2025 y 20% para 2050) se convirtiera en hidrógeno y se almacenara bajo tierra, estas cantidades requerirían unas 15 cavernas de 500.000 metros cúbicos cada una para 2025 y unas 60 cavernas para 2050, lo que corresponde aproximadamente a un tercio del número de cavernas de gas que funcionan actualmente en Alemania. [166] En los EE. UU., Sandia Labs está realizando investigaciones sobre el almacenamiento de hidrógeno en yacimientos de petróleo y gas agotados, que podrían absorber fácilmente grandes cantidades de hidrógeno producido de manera renovable, ya que existen alrededor de 2,7 millones de pozos agotados. [167]
El campo de investigación de los materiales de almacenamiento de hidrógeno es vasto y cuenta con decenas de miles de artículos publicados. [168] Según los artículos del período 2000 a 2015 recopilados de Web of Science y procesados en el software bibliométrico VantagePoint ® , se constituyó una revisión cienciométrica de la investigación en materiales de almacenamiento de hidrógeno. Según la literatura, la energía del hidrógeno pasó por un tipo de desarrollo de ciclo exagerado en la década de 2000. La investigación en materiales de almacenamiento de hidrógeno creció a tasas crecientes de 2000 a 2010. Después, el crecimiento continuó pero a tasas decrecientes, y se alcanzó una meseta en 2015. Si observamos la producción de cada país, existe una división entre los países que después de 2010 inclinándose hacia una producción constante o ligeramente decreciente, como los países de la Unión Europea, los EE. UU. y Japón, y aquellos cuya producción continuó creciendo hasta 2015, como China y Corea del Sur. Los países con más publicaciones fueron China, la UE y los Estados Unidos, seguidos de Japón. China mantuvo la posición de liderazgo durante todo el período y tuvo una mayor participación de publicaciones sobre materiales de almacenamiento de hidrógeno en su producción total de investigación. [169]
Entre las clases de materiales, los materiales más investigados fueron los de estructura metalorgánica, seguidos de los hidruros simples. Se identificaron tres comportamientos típicos:
Sin embargo, las tecnologías de fisisorción actuales aún están lejos de comercializarse. Los estudios experimentales se llevan a cabo para muestras pequeñas de menos de 100 g. [170] Las tecnologías descritas requieren alta presión y/o bajas temperaturas como norma. Por lo tanto, en su estado actual de la técnica, estas técnicas no se consideran una tecnología novedosa independiente, sino un tipo de complemento valioso para los métodos actuales de compresión y licuefacción .
Los procesos de fisisorción son reversibles, ya que no interviene energía de activación y la energía de interacción es muy baja. En materiales como estructuras metalorgánicas , carbonos porosos, zeolitas, clatratos y polímeros orgánicos, el hidrógeno se fisisorbe en la superficie de los poros. En estas clases de materiales, la capacidad de almacenamiento de hidrógeno depende principalmente del área superficial y del volumen de los poros. La principal limitación del uso de estos sorbentes como materiales de almacenamiento de H 2 es la débil energía de interacción de van der Waals entre el hidrógeno y la superficie de los sorbentes. Por lo tanto, muchos de los materiales basados en fisisorción tienen altas capacidades de almacenamiento a la temperatura del nitrógeno líquido y a altas presiones, pero sus capacidades se vuelven muy bajas a temperatura y presión ambiente. [ cita requerida ]
Los LOHC , sistemas de almacenamiento de hidrógeno orgánico líquido, son una técnica prometedora para el futuro del almacenamiento de hidrógeno. Los LOHC son compuestos orgánicos que pueden absorber y liberar hidrógeno a través de reacciones químicas . Estos compuestos se caracterizan por el hecho de que pueden cargarse y descargarse con cantidades considerables de hidrógeno en un proceso cíclico. En principio, todos los compuestos insaturados (moléculas orgánicas con enlaces dobles o triples CC ) pueden absorber hidrógeno durante la hidrogenación . Esta técnica garantiza que la liberación de compuestos a la atmósfera se evite por completo en el almacenamiento de hidrógeno. Por lo tanto, los LOHC son una forma atractiva de proporcionar energía eólica y solar para aplicaciones de movilidad en forma de moléculas portadoras de energía líquida con densidades de almacenamiento de energía y manejabilidad similares a los combustibles fósiles actuales. [171] [ fuente obsoleta ]
la situación es mucho peor, porque antes de que el hidrógeno pueda transportarse a cualquier parte, necesita ser comprimido o licuado. Para licuarlo, debe refrigerarse a una temperatura de -253 °C (20 grados por encima del cero absoluto). A estas temperaturas, las leyes fundamentales de la termodinámica hacen que los refrigeradores sean extremadamente ineficientes. Como resultado, alrededor del 40 por ciento de la energía del hidrógeno debe gastarse para licuarlo. Esto reduce el contenido de energía neta real de nuestro combustible a 792 kcal. Además, debido a que es un líquido criogénico, se podría esperar que se pierda aún más energía a medida que el hidrógeno hierve al calentarse por el calor que se filtra desde el ambiente exterior durante el transporte y el almacenamiento.