El hidruro de aluminio (también conocido como alano y alumano ) es un compuesto inorgánico con la fórmula Al H 3 . El alano y sus derivados son parte de una familia de reactivos reductores comunes en la síntesis orgánica basada en hidruros del grupo 13 . [1] En solución, típicamente en solventes etéreos como tetrahidrofurano o éter dietílico , el hidruro de aluminio forma complejos con bases de Lewis y reacciona selectivamente con grupos funcionales orgánicos particulares (por ejemplo, con ácidos carboxílicos y ésteres sobre haluros orgánicos y grupos nitro ), y aunque no es un reactivo de elección, puede reaccionar con enlaces múltiples carbono-carbono (es decir, a través de hidroaluminización ). Dada su densidad, y con un contenido de hidrógeno del orden del 10% en peso, [2] algunas formas de alano son, a partir de 2016, [3] candidatos activos para almacenar hidrógeno y, por lo tanto, para la generación de energía en aplicaciones de celdas de combustible, incluidos los vehículos eléctricos. [ no verificado en el cuerpo ] A partir de 2006 se observó que se necesitaba más investigación para identificar una forma eficiente y económica de revertir el proceso, regenerando el alano a partir del producto de aluminio gastado.
El hidruro de aluminio sólido, o alano, es incoloro y no volátil, y en su forma reactiva más común es una especie altamente polimerizada (es decir, tiene múltiples unidades AlH 3 que están autoasociadas); se funde con descomposición a 110 °C. [4] Si bien no es espontáneamente inflamable, los sólidos y soluciones de alano requieren precauciones en su uso similares a las de otros hidruros metálicos altamente inflamables , y deben manipularse y almacenarse con la exclusión activa de la humedad. El alano se descompone al exponerse al aire (principalmente debido a la humedad adventicia), aunque la pasivación (en este caso, lo que permite el desarrollo de un revestimiento superficial inerte) disminuye en gran medida la velocidad de descomposición de las preparaciones de alano. [ no verificado en el cuerpo ]
El alano es un sólido incoloro y no volátil que se funde con la descomposición a 110 °C; [4] Las muestras suficientemente grandes se pueden calentar aún más para completar la descomposición a 150 °C. [5] Sin embargo, la forma sólida a menudo se presenta como un sólido blanco que puede teñirse de gris (con la disminución del tamaño de partícula del reactivo o el aumento de los niveles de impurezas). [ cita requerida ] Esta coloración surge de una fina capa de pasivación superficial de óxido o hidróxido de aluminio. [ cita requerida ]
En condiciones de laboratorio comunes, el alano es "altamente polimérico", estructuralmente. [4] Esto a veces se indica con la fórmula (AlH 3 ) n , donde n no se especifica. [6] [ fuente no primaria necesaria ] Las preparaciones de alano se disuelven en tetrahidrofurano (THF) o éter dietílico (éter), [4] a partir del cual precipitan alótropos puros. [7] [ fuente no primaria necesaria ]
Estructuralmente, el alano puede adoptar numerosas formas polimórficas . En 2006, se conocían "al menos 7 fases de AlH 3 no solvatadas ": α-, α'-, β-, γ-, ε- y ζ-alanos; [2] posteriormente se descubrieron los δ- y θ-alanos. [ cita requerida ] Cada uno tiene una estructura diferente, siendo el α-alano el polimorfo más estable térmicamente. [ cita requerida ] Por ejemplo, cristalográficamente , el α-alano adopta una morfología cúbica o romboédrica, mientras que el α'-alano forma cristales aciculares y el γ-alano forma haces de agujas fusionadas. [ cita requerida ] Se ha determinado la estructura cristalina del α-alano, y presenta átomos de aluminio rodeados por seis átomos de hidrógeno orientados octaédricamente que forman puentes con otros seis átomos de aluminio (ver tabla), donde las distancias Al-H son todas equivalentes (172 pm) y el ángulo Al-H-Al es 141°. [8]
Cuando los β- y γ-alanos se producen juntos, se convierten en α-alano al calentarse, mientras que los δ-, ε- y θ-alanos se producen en otras condiciones de cristalización; aunque son menos estables térmicamente, los polimorfos δ-, ε- y θ-alanos no se convierten en α-alano al calentarse. [7] [ se necesita una mejor fuente ]
En condiciones especiales, se pueden preparar y estudiar alanos no poliméricos (es decir, formas moleculares de este). Se ha aislado el AlH 3 monomérico a baja temperatura en una matriz de gas noble sólida donde se demostró que es planar. [10] La forma dimérica, Al 2 H 6 , se ha aislado en hidrógeno sólido y es isoestructural con diborano ( B 2 H 6 ) y digalano ( Ga 2 H 6 ). [11] [12] [13]
El alano no es espontáneamente inflamable. [14] Aun así, se recomiendan "una manipulación y precauciones similares a las que se toman para el Li[AlH 4 ] " (el reactivo químico, hidruro de litio y aluminio ), ya que su "reactividad [es] comparable" a la de este reactivo reductor relacionado. [4] Para estos reactivos, tanto las preparaciones en soluciones como los sólidos aislados son "altamente inflamables y deben almacenarse en ausencia de humedad". [15] Las guías de laboratorio recomiendan el uso del alano dentro de una campana extractora de humos . [4] [ ¿ Por qué? ] Los sólidos de este tipo de reactivo llevan recomendaciones de manipulación "en una bolsa de guantes o una caja seca ". [15] Después del uso, los recipientes de la solución suelen sellarse herméticamente con un enjuague concomitante con gas inerte para excluir el oxígeno y la humedad del aire ambiente. [15]
La pasivación [ aclaración necesaria ] disminuye en gran medida la tasa de descomposición asociada con las preparaciones de alano. [ cita requerida ] Sin embargo, el alano pasivado conserva una clasificación de riesgo de 4.3 (sustancias químicas que, en contacto con el agua, emiten gases inflamables). [16]
Se cree que las reducciones de alano se producen a través de un complejo de coordinación intermedio , con aluminio unido al grupo funcional parcialmente reducido, y liberado cuando la reacción sufre extinción prótica . Si el sustrato también está fluorado , el intermedio puede explotar si se expone a un punto caliente por encima de los 60 °C. [17]
Los hidruros de aluminio y varios complejos derivados se conocen desde hace mucho tiempo. [18] Su primera síntesis se publicó en 1947, y se asignó una patente para la síntesis en 1999. [19] [20] El hidruro de aluminio se prepara tratando hidruro de litio y aluminio con tricloruro de aluminio . [21] El procedimiento es complejo: se debe prestar atención a la eliminación del cloruro de litio .
La solución de éter de alano requiere un uso inmediato, ya que el material polimérico precipita rápidamente en forma de sólido. Se sabe que las soluciones de hidruro de aluminio se degradan después de 3 días. El hidruro de aluminio es más reactivo que el Li[AlH 4 ] . [7]
Existen otros métodos para la preparación de hidruro de aluminio:
Varios grupos han demostrado que el alano se puede producir electroquímicamente . [22] [23] [24] [25] [26] Se han patentado diferentes métodos de producción electroquímica de alano. [27] [28] La generación electroquímica de alano evita las impurezas de cloruro. Se discuten dos posibles mecanismos para la formación de alano en la celda electroquímica de Clasen que contiene THF como disolvente, hidruro de sodio y aluminio como electrolito, un ánodo de aluminio y un alambre de hierro (Fe) sumergido en mercurio (Hg) como cátodo. El sodio forma una amalgama con el cátodo de Hg evitando reacciones secundarias y el hidrógeno producido en la primera reacción podría capturarse y reaccionar nuevamente con la amalgama de sodio y mercurio para producir hidruro de sodio. El sistema de Clasen no produce pérdida de material de partida. Para los ánodos insolubles, ocurre la reacción 1, mientras que para los ánodos solubles, se espera la disolución anódica de acuerdo con la reacción 2:
En la reacción 2, el ánodo de aluminio se consume, lo que limita la producción de hidruro de aluminio para una celda electroquímica determinada.
Se ha demostrado la cristalización y recuperación de hidruro de aluminio a partir de alano generado electroquímicamente. [25] [26]
El α- AlH 3 se puede producir por hidrogenación de aluminio a 10 GPa y 600 °C (1112 °F). La reacción entre el hidrógeno licuado produce α- AlH 3 que se puede recuperar en condiciones ambientales. [29]
AlH 3 forma fácilmente aductos con bases de Lewis fuertes . Por ejemplo, se forman complejos 1:1 y 1:2 con trimetilamina . El complejo 1:1 es tetraédrico en la fase gaseosa, [30] pero en la fase sólida es dimérico con centros de hidrógeno puente, (N(CH 3 ) 3 Al(μ-H)) 2 . [31] El complejo 1:2 adopta una estructura bipiramidal trigonal . [30] Algunos aductos (por ejemplo, dimetiletilamina alano, (CH 3 CH 2 )(CH 3 ) 2 N·AlH 3 ) se descomponen térmicamente para dar aluminio y pueden tener uso en aplicaciones de MOCVD . [32]
Su complejo con éter dietílico se forma según la siguiente estequiometría:
La reacción con hidruro de litio en éter produce hidruro de litio y aluminio (alanato de litio, tetrahidruroaluminato de litio):
Alanatos análogos (por ejemplo, Na
3AlH
6, Ca(AlH
4))
2, SrAlH
5) existen con otros metales alcalinos, alcalinotérreos y algunos otros. [33] Li
3AlH
6Está bajo investigación como material para el ánodo de celdas de iones de litio.
En química orgánica, el hidruro de aluminio se utiliza principalmente para la reducción de grupos funcionales. [34] En muchos sentidos, la reactividad del hidruro de aluminio es similar a la del hidruro de litio y aluminio . El hidruro de aluminio reducirá aldehídos , cetonas , ácidos carboxílicos , anhídridos , cloruros de ácido , ésteres y lactonas a sus alcoholes correspondientes . Las amidas , nitrilos y oximas se reducen a sus aminas correspondientes .
En términos de selectividad de grupos funcionales, el alano difiere de otros reactivos hidruros. Por ejemplo, en la siguiente reducción de ciclohexanona, el hidruro de litio y aluminio da una relación trans:cis de 1,9:1, mientras que el hidruro de aluminio da una relación trans:cis de 7,3:1. [35]

El alano permite la hidroximetilación de ciertas cetonas (es decir, el reemplazo de C−H por C−CH 2 OH en la posición alfa ). [36] La cetona en sí no se reduce ya que está "protegida" como su enolato.
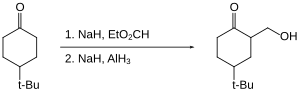
Los organohalogenuros se reducen lentamente o no se reducen en absoluto con el hidruro de aluminio. Por lo tanto, los grupos funcionales reactivos, como los ácidos carboxílicos, pueden reducirse en presencia de haluros. [37]
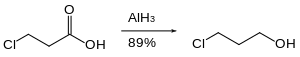
Los grupos nitro no se reducen con hidruro de aluminio. Asimismo, el hidruro de aluminio puede lograr la reducción de un éster en presencia de grupos nitro. [38]

El hidruro de aluminio se puede utilizar en la reducción de acetales a dioles semiprotegidos. [39]

El hidruro de aluminio también se puede utilizar en la reacción de apertura del anillo de epóxido como se muestra a continuación. [40]

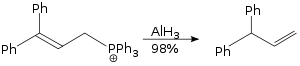
La reacción de reordenamiento alílico llevada a cabo utilizando hidruro de aluminio es una reacción S N 2 y no es estéricamente exigente. [41]
El hidruro de aluminio reducirá el dióxido de carbono a metano con el calentamiento: [ cita requerida ]
De manera similar a la hidroboración , el hidruro de aluminio puede, en presencia de tetracloruro de titanio , agregarse a través de enlaces múltiples . [42] [43] Cuando el enlace múltiple en cuestión es un alcohol propargílico , los resultados son compuestos de alquenilaluminio . [44]

En su forma pasivada, el alano es un candidato activo para almacenar hidrógeno y se puede utilizar para la generación eficiente de energía a través de aplicaciones de celdas de combustible, incluidos vehículos eléctricos y de celdas de combustible y otras aplicaciones de energía liviana. [45] El AlH3 contiene hasta un 10,1% de hidrógeno en peso (a una densidad de 1,48 gramos por mililitro), [2] o el doble de la densidad de hidrógeno del H2 líquido . [ cita requerida ] A partir de 2006, el AlH3 se describió como un candidato para el cual "se requeriría más investigación para desarrollar un proceso eficiente y económico para regenerarlo a partir del polvo de Al gastado". [2] [ necesita actualización ]
El alano también es un aditivo potencial para el combustible sólido para cohetes y para composiciones explosivas y pirotécnicas [ cita requerida ] debido a su alto contenido de hidrógeno y baja temperatura de deshidrogenación. [45] En su forma no pasivada, el alano también es un aditivo prometedor para el combustible para cohetes , capaz de generar ganancias de eficiencia de impulso de hasta un 10%. [46] Sin embargo, el AlH 3 puede degradarse cuando se almacena a temperatura ambiente, y algunas de sus formas cristalinas tienen "poca compatibilidad" con algunos componentes del combustible. [45]
El alano calentado libera gas hidrógeno y produce una película muy fina de metal de aluminio. [5]
{{cite journal}}: CS1 maint: publicación periódica sin título ( enlace )