La cilindrospermopsina (abreviada como CYN o CYL ) es una cianotoxina producida por una variedad de cianobacterias de agua dulce . [1] La CYN es un derivado policíclico del uracilo que contiene grupos guanidino y sulfato . También es zwitteriónico , lo que lo hace altamente soluble en agua . La CYN es tóxica para el tejido hepático y renal y se cree que inhibe la síntesis de proteínas y modifica covalentemente el ADN y/o el ARN . No se sabe si la cilindrospermopsina es un carcinógeno , pero parece no tener actividad iniciadora de tumores en ratones. [2]
La CYN se descubrió por primera vez después de un brote de una enfermedad misteriosa en Palm Island , Queensland , Australia . El brote se atribuyó a una floración de Cylindrospermopsis raciborskii en el suministro de agua potable local, y posteriormente se identificó la toxina. El análisis de la toxina condujo a una estructura química propuesta en 1992, que se revisó después de lograr la síntesis en 2000. Se han aislado o sintetizado varios análogos de la CYN, tanto tóxicos como no tóxicos.
C. raciborskii se ha observado principalmente en áreas tropicales , sin embargo también se ha descubierto recientemente en regiones templadas de Australia , América del Norte , América del Sur , Nueva Zelanda y Europa . [3] Sin embargo, la cepa productora de CYN de C. raciborskii no se ha identificado en Europa, varias otras especies de cianobacterias que se encuentran en todo el continente son capaces de sintetizarlo. [3]
En 1979, 138 habitantes de Palm Island , Queensland , Australia , fueron ingresados en el hospital con diversos síntomas de gastroenteritis . Todos ellos eran niños; además, 10 adultos se vieron afectados pero no fueron hospitalizados. Los síntomas iniciales, que incluían dolor abdominal y vómitos , se parecían a los de la hepatitis ; los síntomas posteriores incluyeron insuficiencia renal y diarrea sanguinolenta . El análisis de orina reveló altos niveles de proteínas , cetonas y azúcar en muchos pacientes, junto con sangre y urobilinógeno en menor cantidad. El análisis de orina, junto con la microscopía fecal y la detección de venenos , no pudieron proporcionar un vínculo estadístico con los síntomas. Todos los pacientes se recuperaron en un plazo de 4 a 26 días, y en ese momento no había una causa aparente para el brote. Las ideas iniciales sobre la causa incluían la mala calidad del agua y la dieta, sin embargo, ninguna fue concluyente, y la enfermedad se denominó "Enfermedad misteriosa de Palm Island". [4]
En ese momento, se advirtió que este brote coincidió con una grave floración de algas en el suministro de agua potable local, y poco después la atención se centró en la presa en cuestión. Un estudio epidemiológico de esta "enfermedad misteriosa" confirmó más tarde que la presa Solomon estaba implicada, ya que los que enfermaron habían utilizado agua de la presa. Se hizo evidente que un tratamiento reciente de la floración de algas con sulfato de cobre causó la lisis de las células de las algas, liberando una toxina en el agua. [5] Un estudio de la presa reveló que las floraciones periódicas de algas fueron causadas predominantemente por tres cepas de cianobacterias : dos del género Anabaena y Cylindrospermopsis raciborskii , previamente desconocidas en aguas australianas. [6] Un bioensayo en ratones de las tres demostró que, aunque las dos cepas de Anabaena no eran tóxicas, C. raciborskii era altamente tóxica. [7] El aislamiento posterior del compuesto responsable condujo a la identificación de la toxina cilindrospermopsina. [8]
Un informe posterior propuso que la causa de la enfermedad era el exceso de cobre en el agua. La dosis excesiva se debía a que se habían contratado contratistas que no estaban cualificados para controlar las algas y que ofrecían los costes más bajos. [9]
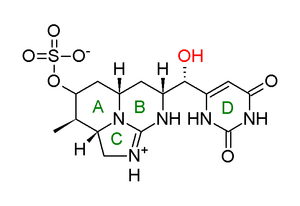
El aislamiento de la toxina utilizando cianobacterias cultivadas a partir de la cepa original de Palm Island se logró mediante filtración en gel de un extracto acuoso , seguido de HPLC de fase inversa . La elucidación de la estructura se logró mediante experimentos de espectrometría de masas (MS) y resonancia magnética nuclear (NMR), y se propuso una estructura (que luego se demostró ligeramente incorrecta) (Figura 1). [8]
Esta molécula casi correcta posee un grupo guanidina tricíclico (anillos A, B y C), junto con un anillo de uracilo (D). La naturaleza zwitteriónica de la molécula hace que sea altamente soluble en agua, ya que la presencia de áreas cargadas dentro de la molécula crea un efecto dipolar , adecuado para el solvente polar . La sensibilidad de las señales clave en el espectro de RMN a pequeños cambios en el pH sugirió que el anillo de uracilo existe en una relación tautomérica ceto / enol , donde una transferencia de hidrógeno da como resultado dos estructuras distintas (Figura 2). Originalmente se propuso que un enlace de hidrógeno entre los grupos uracilo y guanidina en el tautómero enol haría que esta fuera la forma dominante. [8]

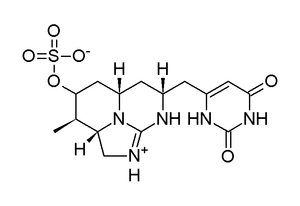
Se identificó un segundo metabolito de C. raciborskii a partir de extractos de cianobacterias tras la observación de un pico frecuente que acompañaba al de CYN durante experimentos con UV y MS. El análisis por métodos de MS y RMN concluyó que a este nuevo compuesto le faltaba el oxígeno adyacente al anillo de uracilo, y se lo denominó desoxicilindrospermopsina (Figura 3). [10]
En 1999, un epímero de CYN, llamado 7-epiciclindrospermopsina (epiCYN), también fue identificado como un metabolito menor de Aphanizomenon ovalisporum . Esto ocurrió mientras se aislaba CYN de cianobacterias tomadas del lago Kinneret en Israel . [11] La estructura propuesta de esta molécula difería de CYN solo en la orientación del grupo hidroxilo adyacente al anillo de uracilo (Figura 4).

Los enfoques sintéticos para CYN comenzaron con el anillo de piperidina (A) y progresaron hasta la anulación de los anillos B y C. [12] La primera síntesis total de CYN se informó en 2000 a través de un proceso de 20 pasos. [13]
Las mejoras en los métodos sintéticos condujeron a una revisión de la estereoquímica del CYN en 2001. Un proceso sintético que controlaba cada uno de los seis centros estereogénicos del epiCYN estableció que las asignaciones originales tanto del CYN como del epiCYN eran, de hecho, una inversión de las estructuras correctas. [14] Un enfoque alternativo de White y Hansen respaldó estas configuraciones absolutas (Figura 5). [15] En el momento de esta asignación correcta, se sugirió que la forma enol no era dominante. [14]
Uno de los factores clave asociados con la toxicidad de la CYN es su estabilidad . Aunque se ha descubierto que la toxina se degrada rápidamente en un extracto de algas cuando se expone a la luz solar , es resistente a la degradación por cambios de pH y temperatura , y no muestra degradación ni en la forma sólida pura ni en agua pura. Como resultado, en agua turbia e inmóvil la toxina puede persistir durante largos períodos, y aunque el agua hirviendo matará a las cianobacterias, es posible que no elimine la toxina. [16]
Hawkins et al . demostraron los efectos tóxicos del CYN mediante un bioensayo en ratones, utilizando un extracto de la cepa original de Palm Island. Los ratones envenenados de forma aguda mostraron anorexia , diarrea y respiración jadeante . Los resultados de la autopsia revelaron hemorragias en los pulmones , hígados , riñones , intestino delgado y glándulas suprarrenales . La histopatología reveló necrosis relacionada con la dosis de los hepatocitos , acumulación de lípidos y formación de trombos de fibrina en los vasos sanguíneos del hígado y los pulmones, junto con necrosis variable de las células epiteliales en áreas de los riñones. [7]
Un bioensayo más reciente en ratones sobre los efectos de la cilindrospermopsina reveló un aumento del peso del hígado, tanto con dosis letales como no letales; además, los hígados se volvieron de color oscuro. Se observó una necrosis extensa de los hepatocitos en los ratones a los que se administró una dosis letal, y también se observó algún daño localizado en los ratones a los que se administró una dosis no letal. [17]
Una estimación inicial de la toxicidad del CYN en 1985 fue que una LD 50 a las 24 horas era de 64 ± 5 mg de cultivo liofilizado/kg de peso corporal del ratón en inyección intraperitoneal . [7] Un experimento adicional en 1997 midió la LD 50 como 52 mg/kg a las 24 horas y 32 mg/kg a los 7 días, sin embargo, los datos sugirieron que otro compuesto tóxico estaba presente en el aislado de células sonicadas utilizado; [18] las predicciones hechas por Ohtani et al. [8] sobre la toxicidad de 24 horas fueron considerablemente más altas, y se propuso que otro metabolito estaba presente para explicar el nivel de toxicidad de 24 horas relativamente bajo medido. [18]
Dado que la vía más probable de absorción de CYN por parte de los seres humanos es la ingestión, se llevaron a cabo experimentos de toxicidad oral en ratones. Se encontró que la DL50 oral era de 4,4-6,9 mg de CYN/kg y, además de cierta ulceración de la mucosa gástrica esofágica , los síntomas eran compatibles con los de la dosificación intraperitoneal. El contenido del estómago incluía material de cultivo , lo que indicaba que estas cifras de DL50 podrían estar sobreestimadas. [19]
Otra forma de exposición al CYN está relacionada con las alteraciones del microbioma intestinal causadas por los edulcorantes artificiales. Un estudio que incluía aspartamo realizado en Cedars-Sinai en Los Ángeles por el Dr. Ruchi Mathur detectó CYN en el duodeno en niveles cuatro veces superiores a los valores basales en los usuarios de aspartamo, junto con alteraciones en las especies bacterianas. [20]
Se informó que los cambios patológicos asociados con el envenenamiento por CYN se dieron en cuatro etapas distintas: inhibición de la síntesis de proteínas , proliferación de membranas , acumulación de lípidos dentro de las células y, finalmente, muerte celular . El examen de los hígados de ratones extirpados en la autopsia mostró que, con la inyección intraperitoneal de CYN, después de 16 horas, los ribosomas del retículo endoplasmático rugoso (rER) se habían desprendido y, a las 24 horas, se había producido una marcada proliferación de los sistemas de membrana del retículo endoplasmático liso y el aparato de Golgi . A las 48 horas, se habían acumulado pequeñas gotitas de lípidos en los cuerpos celulares y, a las 100 horas, los hepatocitos en los lobulillos hepáticos estaban destruidos más allá de su función. [21]
Se ha demostrado que el proceso de inhibición de la síntesis de proteínas es irreversible, sin embargo, no es concluyente el método de citotoxicidad del compuesto. Froscio et al . propusieron que el CYN tiene al menos dos modos de acción separados: la inhibición de la síntesis de proteínas informada previamente y un método aún no claro de causar muerte celular. Se ha demostrado que las células pueden sobrevivir durante largos períodos (hasta 20 horas) con un 90% de inhibición de la síntesis de proteínas y aún mantener la viabilidad. [22] Dado que el CYN es citotóxico en un plazo de 16 a 18 horas [23], se ha sugerido que otros mecanismos son la causa de la muerte celular.
El citocromo P450 se ha visto implicado en la toxicidad del CYN, ya que el bloqueo de la acción del P450 reduce la toxicidad del CYN. [24] Se ha propuesto que un metabolito (o metabolitos) del CYN derivado del P450 activado es la principal causa de toxicidad. [22] Shaw et al . demostraron que la toxina podía metabolizarse in vivo , lo que daba como resultado metabolitos unidos en el tejido hepático, y que el daño era más frecuente en los hepatocitos de rata que en otros tipos de células. [25]
Debido a la estructura de CYN, que incluye grupos sulfato , guanidina y uracilo , se ha sugerido que CYN actúa sobre el ADN o el ARN . Shaw et al . informaron sobre la unión covalente de CYN o sus metabolitos al ADN en ratones, [25] y también se ha observado la rotura de la cadena de ADN. [26] Humpage et al. también apoyaron esto y, además, postularon que CYN (o un metabolito) actúa sobre el huso o los centrómeros durante la división celular , induciendo la pérdida de cromosomas completos . [27]
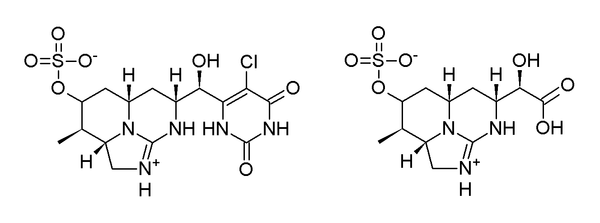
El grupo uracilo de CYN se ha identificado como un farmacóforo de la toxina. En dos experimentos, el átomo de hidrógeno vinílico en el anillo de uracilo se reemplazó con un átomo de cloro para formar 5-clorocilindrospermopsina, y el grupo uracilo se truncó a un ácido carboxílico , para formar ácido cilindrospérmico (Figura 6). Ambos productos se evaluaron como no tóxicos , incluso a 50 veces la LD 50 de CYN. [28] En la determinación previa de la estructura de la desoxicilindrospermopsina, se realizó una evaluación de toxicidad del compuesto. Los ratones inyectados intraperitonealmente con cuatro veces la dosis letal media de 5 días de CYN no mostraron efectos tóxicos. Como se demostró que este compuesto era relativamente abundante, se concluyó que este análogo era comparativamente no tóxico. [10] Dado que tanto CYN como epiCYN son tóxicos, [11] el grupo hidroxilo en el puente de uracilo puede considerarse necesario para la toxicidad. Hasta el momento, no se han comparado las toxicidades relativas de CYN y epiCYN.
El grupo de genes biosintéticos de cilindrospermopsina (BGC) se describió a partir de Cylindrospermopsis raciborskii AWT205 en 2008. [29]

Desde el brote de Palm Island, se han identificado varias otras especies de cianobacterias que producen CYN: Anabaena bergii , Anabaena lapponica , [30] Aphanizomenon ovalisporum , [31] Umezakia natans , [32] Raphidiopsis curvata . [33] y Aphanizomenon issatschenkoi . [34] En Australia, existen tres cianobacterias tóxicas principales: Anabaena circinalis , especies de Microcystis y C. raciborskii . De estas, la última, que produce CYN, ha atraído una atención considerable, no solo debido al brote de Palm Island, sino también porque la especie se está extendiendo a áreas más templadas . Anteriormente, las algas se clasificaban solo como tropicales , sin embargo, recientemente se han descubierto en regiones templadas de Australia, Europa , [3] América del Norte y del Sur , [6] y también Nueva Zelanda . [35]
En agosto de 1997, tres vacas y diez terneros murieron por envenenamiento con cilindrospermopsina en una granja en el noroeste de Queensland. Se analizó una presa cercana que contenía una floración de algas y se identificó C. raciborskii . El análisis por HPLC / espectrometría de masas reveló la presencia de CYN en una muestra de la biomasa . Una autopsia de uno de los terneros informó un hígado y una vesícula biliar hinchados , junto con hemorragias del corazón y el intestino delgado . El examen histológico del tejido hepático fue consistente con lo informado en ratones afectados por CYN. [17] Este fue el primer informe de C. raciborskii que causó mortalidad en animales en Australia.
En 1997 se evaluó el efecto de una floración de C. raciborskii en un estanque de acuicultura en Townsville , Australia. El estanque contenía cangrejos de río Redclaw , junto con una población de peces arco iris del lago Eacham para controlar el exceso de alimento. El análisis reveló que el agua contenía CYN tanto extracelular como intracelular , y que los cangrejos de río lo habían acumulado principalmente en el hígado pero también en el tejido muscular . El examen del contenido intestinal reveló células cianobacterianas , lo que indica que los cangrejos de río habían ingerido toxina intracelular. Un experimento con un extracto de la floración mostró que también era posible absorber toxina extracelular directamente en los tejidos. Tal bioacumulación , particularmente en la industria de la acuicultura, era motivo de preocupación, especialmente cuando los humanos eran los usuarios finales del producto. [36]
El impacto de las floraciones de cianobacterias se ha evaluado en términos económicos . En diciembre de 1991, la mayor floración de algas del mundo se produjo en Australia, donde se vieron afectados 1.000 km del río Darling - Barwon . [37] Se perdieron un millón de días-persona de agua potable, y los costos directos incurridos ascendieron a más de 1,3 millones de dólares australianos. Además, también se perdieron 2.000 días-persona de recreación, y el costo económico se estimó en 10 millones de dólares australianos, después de tener en cuenta las industrias afectadas indirectamente, como el turismo , el alojamiento y el transporte . [38]
Los métodos actuales incluyen cromatografía líquida acoplada a espectrometría de masas ( LC-MS ), [39] [40] bioensayo en ratones, [41] ensayo de inhibición de la síntesis de proteínas y análisis HPLC-PDA (Photo Diode Array) de fase inversa. Se ha desarrollado un ensayo de síntesis de proteínas libres de células que parece ser comparable al HPLC-MS. [20]
{{cite journal}}: Mantenimiento CS1: fecha y año ( enlace )