El ADN-Z es una de las muchas estructuras de doble hélice posibles del ADN . Se trata de una estructura de doble hélice levógira en la que la hélice se enrolla hacia la izquierda en un patrón en zigzag, en lugar de hacia la derecha, como la forma más común del ADN-B . Se cree que el ADN-Z es una de las tres estructuras de doble hélice biológicamente activas junto con el ADN-A y el ADN-B .
El ADN levógiro fue propuesto por primera vez por Robert Wells y sus colegas como la estructura de un polímero repetitivo de inosina - citosina . [1] Observaron un espectro de dicroísmo circular "inverso" para dichos ADN, e interpretaron esto incorrectamente como que las hebras se enrollaban unas sobre otras de manera levógira. La relación entre el ADN-Z y el ADN-B más conocido fue indicada por el trabajo de Pohl y Jovin, [2] quienes demostraron que el dicroísmo circular ultravioleta del poli(dG-dC) estaba casi invertido en una solución de cloruro de sodio 4 M y que la estructura del poli d(I–C)·poli d(I–C) era de hecho una conformación de ADN-D dextrógira. La sospecha de que esto era el resultado de una conversión de ADN-B a ADN-Z fue confirmada al examinar los espectros Raman de estas soluciones y los cristales de ADN-Z. [3] Posteriormente, se publicó una estructura cristalina de "Z-ADN" que resultó ser la primera estructura de rayos X de un solo cristal de un fragmento de ADN (un hexámero de ADN autocomplementario d(CG) 3 ). Se resolvió como una doble hélice levógira con dos cadenas antiparalelas que se mantenían unidas por pares de bases Watson-Crick (véase cristalografía de rayos X ). Fue resuelta por Andrew HJ Wang , Alexander Rich y colaboradores en 1979 en el MIT . [4] La cristalización de una unión de B a Z-ADN en 2005 [5] proporcionó una mejor comprensión del papel potencial que desempeña el Z-ADN en las células. Siempre que se forma un segmento de Z-ADN, debe haber uniones B–Z en sus dos extremos, que lo interconectan con la forma B del ADN que se encuentra en el resto del genoma .
En 2007, la versión ARN del ADN-Z, Z-ARN , fue descrita como una versión transformada de una doble hélice de ARN-A en una hélice levógira. [6] La transición del ARN-A al ARN-Z, sin embargo, ya fue descrita en 1984. [7]
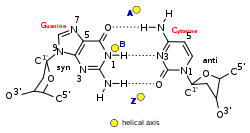
El ADN-Z es bastante diferente de las formas dextrógiras. De hecho, el ADN-Z se compara a menudo con el ADN-B para ilustrar las principales diferencias. La hélice del ADN-Z es levógira y tiene una estructura que repite cada dos pares de bases. Los surcos mayor y menor, a diferencia del ADN-A y B, muestran poca diferencia en anchura. La formación de esta estructura es generalmente desfavorable, aunque ciertas condiciones pueden promoverla; como la secuencia alternante de purina - pirimidina (especialmente poli(dGC) 2 ), superenrollamiento negativo del ADN o alta sal y algunos cationes (todo a temperatura fisiológica, 37 °C y pH 7,3–7,4). El ADN-Z puede formar una unión con el ADN-B (llamada "caja de unión B a Z") en una estructura que implica la extrusión de un par de bases. [8] La conformación del ADN-Z ha sido difícil de estudiar porque no existe como una característica estable de la doble hélice. En cambio, se trata de una estructura transitoria que ocasionalmente es inducida por la actividad biológica y luego desaparece rápidamente. [9]
Es posible predecir la probabilidad de que una secuencia de ADN forme una estructura de ADN-Z. P. Shing Ho escribió en 1984 en el MIT un algoritmo para predecir la propensión del ADN a pasar de la forma B a la forma Z, ZHunt . [10] Este algoritmo fue desarrollado posteriormente por Tracy Camp , P. Christoph Champ, Sandor Maurice y Jeffrey M. Vargason para el mapeo de todo el genoma del ADN-Z (con Ho como investigador principal). [11]
Desde el descubrimiento y la cristalización del ADN-Z en 1979, la configuración ha dejado a los científicos desconcertados sobre la vía y el mecanismo desde la configuración del ADN-B a la configuración del ADN-Z. [12] El cambio conformacional del ADN-B a la estructura del ADN-Z era desconocido a nivel atómico, pero en 2010, las simulaciones por computadora realizadas por Lee et al. pudieron determinar computacionalmente que la propagación por pasos de una transición de B a Z proporcionaría una barrera de energía más baja que el mecanismo concertado previamente hipotetizado. [13] Dado que esto se demostró computacionalmente, la vía aún necesitaría ser probada experimentalmente en el laboratorio para una mayor confirmación y validez, en lo que Lee et al. afirma específicamente en su artículo de revista: "El resultado [computacional] actual podría probarse mediante experimentos de FRET de molécula única (smFRET) en el futuro". [13] En 2018, la vía del ADN-B al ADN-Z se demostró experimentalmente utilizando ensayos smFRET. [14] Esto se realizó midiendo los valores de intensidad entre los colorantes fluorescentes donantes y aceptores, también conocidos como fluoróforos , en relación entre sí a medida que intercambian electrones, mientras están etiquetados en una molécula de ADN. [15] [16] Las distancias entre los fluoróforos podrían usarse para calcular cuantitativamente los cambios en la proximidad de los colorantes y los cambios conformacionales en el ADN. Una proteína de unión de alta afinidad al ADN-Z , hZαADAR1, [17] se utilizó en concentraciones variables para inducir la transformación del ADN-B al ADN-Z. [14] Los ensayos smFRET revelaron un estado de transición B*, que se formó a medida que la unión de hZαADAR1 se acumulaba en la estructura del ADN-B y la estabilizaba. [14] Este paso se produce para evitar una alta energía de unión, en la que se permite que la estructura del ADN-B experimente un cambio conformacional a la estructura del ADN-Z sin un cambio importante y disruptivo en la energía. Este resultado coincide con los resultados computacionales de Lee et al. que demuestran que el mecanismo es escalonado y que su propósito es proporcionar una barrera de energía más baja para el cambio conformacional de la configuración del ADN-B a la del ADN-Z. [13] Contrariamente a la noción anterior, las proteínas de unión en realidad no estabilizan la conformación del ADN-Z después de que se forma, sino que en realidad promueven la formación del ADN-Z directamente a partir de la conformación B*, que se forma mediante la unión de la estructura del ADN-B por proteínas de alta afinidad. [14]
En estudios de tres enfermedades mendelianas raras bien caracterizadas, la discromatosis simétrica hereditaria (OMIM: 127400), el síndrome de Aicardi-Goutières (OMIM: 615010) y la distonía/necrosis estriatal bilateral, se ha confirmado un papel biológico del Z-ADN en la regulación de las respuestas al interferón tipo I. Las familias con transcriptoma ADAR haploide permitieron mapear las variantes Zα directamente a la enfermedad, mostrando que la información genética está codificada en el ADN tanto por la forma como por la secuencia. [18] Un papel en la regulación de las respuestas al interferón tipo I en el cáncer también está respaldado por los hallazgos de que el 40% de un panel de tumores dependían de la enzima ADAR para la supervivencia. [19]
En estudios anteriores, el ADN-Z se relacionó tanto con la enfermedad de Alzheimer como con el lupus eritematoso sistémico . Para demostrarlo, se realizó un estudio sobre el ADN encontrado en el hipocampo de cerebros normales, moderadamente afectados por la enfermedad de Alzheimer y gravemente afectados por la enfermedad de Alzheimer. Mediante el uso del dicroísmo circular , este estudio mostró la presencia de ADN-Z en el ADN de los gravemente afectados. [20] En este estudio también se encontró que las principales porciones del ADN moderadamente afectado estaban en la conformación intermedia BZ. Esto es significativo porque a partir de estos hallazgos se concluyó que la transición del ADN-B al ADN-Z depende de la progresión de la enfermedad de Alzheimer. [20] Además, el ADN-Z está asociado con el lupus eritematoso sistémico (LES) a través de la presencia de anticuerpos naturales. Se encontraron cantidades significativas de anticuerpos anti-ADN-Z en pacientes con LES y no estaban presentes en otras enfermedades reumáticas. [21] Hay dos tipos de estos anticuerpos. Mediante radioinmunoensayo, se encontró que uno interactúa con las bases expuestas en la superficie del ADN-Z y el ADN desnaturalizado, mientras que el otro interactúa exclusivamente con la estructura en zigzag del ADN-Z. De manera similar a lo que se encontró en la enfermedad de Alzheimer, los anticuerpos varían según la etapa de la enfermedad, con anticuerpos máximos en las etapas más activas del LES.
Se cree comúnmente que el Z-ADN proporciona alivio de tensión torsional durante la transcripción , y está asociado con superenrollamiento negativo . [5] [22] Sin embargo, mientras que el superenrollamiento está asociado tanto con la transcripción como con la replicación del ADN, la formación del Z-ADN está vinculada principalmente a la tasa de transcripción . [23]
Un estudio del cromosoma humano 22 mostró una correlación entre las regiones formadoras de Z-ADN y las regiones promotoras del factor nuclear I. Esto sugiere que la transcripción en algunos genes humanos puede estar regulada por la formación de Z-ADN y la activación del factor nuclear I. [11]
Se ha demostrado que las secuencias de ADN-Z aguas arriba de las regiones promotoras estimulan la transcripción. El mayor aumento de la actividad se observa cuando la secuencia de ADN-Z se coloca tres vueltas helicoidales después de la secuencia promotora . Además, utilizando la técnica de reticulación de nucleasas microcócicas, [24] es poco probable que el ADN-Z forme nucleosomas , que a menudo se ubican antes y/o después de una secuencia formadora de ADN-Z. Debido a esta propiedad, se plantea la hipótesis de que el ADN-Z codifica el límite en la ubicación de los nucleosomas. Dado que la ubicación de los nucleosomas influye en la unión de los factores de transcripción , se cree que el ADN-Z regula la tasa de transcripción. [24]
Desarrollado detrás de la vía de la ARN polimerasa a través de superenrollamiento negativo, se ha demostrado que el Z-ADN formado a través de la transcripción activa aumenta la inestabilidad genética, creando una propensión a la mutagénesis cerca de los promotores. [25] Un estudio sobre Escherichia coli encontró que las deleciones de genes ocurren espontáneamente en regiones de plásmidos que contienen secuencias formadoras de Z-ADN. [26] En células de mamíferos, se encontró que la presencia de tales secuencias produce grandes deleciones de fragmentos genómicos debido a roturas de doble cadena cromosómicas . Ambas modificaciones genéticas se han relacionado con las translocaciones de genes encontradas en cánceres como la leucemia y el linfoma , ya que las regiones de rotura en las células tumorales se han trazado alrededor de secuencias formadoras de Z-ADN. [25] Sin embargo, las deleciones más pequeñas en plásmidos bacterianos se han asociado con el deslizamiento de la replicación , mientras que las deleciones más grandes asociadas con células de mamíferos son causadas por la reparación de unión de extremos no homóloga , que se sabe que es propensa a errores. [25] [26]
El efecto tóxico del bromuro de etidio (EtBr) sobre los tripanosomas es causado por el cambio de su ADN cinetoplastídeo a la forma Z. El cambio es causado por la intercalación de EtBr y el posterior aflojamiento de la estructura del ADN que conduce al desenrollado del ADN, el cambio a la forma Z y la inhibición de la replicación del ADN. [27]
El primer dominio que se une al Z-ADN con alta afinidad se descubrió en ADAR1 utilizando un enfoque desarrollado por Alan Herbert. [28] [29] Los estudios cristalográficos y de RMN confirmaron los hallazgos bioquímicos de que este dominio se unía al Z-ADN de una manera no específica de la secuencia. [30] [31] [32] Se identificaron dominios relacionados en varias otras proteínas a través de la homología de secuencia . [29] La identificación del dominio Zα proporcionó una herramienta para otros estudios cristalográficos que conducen a la caracterización del Z-ARN y la unión B–Z. Los estudios biológicos sugirieron que el dominio de unión al Z-ADN de ADAR1 puede localizar esta enzima que modifica la secuencia del ARN recién formado en sitios de transcripción activa. [33] [34] Un papel para Zα, Z-ADN y Z-ARN en la defensa del genoma contra la invasión de retroelementos Alu en humanos ha evolucionado hasta convertirse en un mecanismo para la regulación de las respuestas inmunes innatas al dsARN. Las mutaciones en Zα son la causa de interferonopatías humanas como el síndrome de Aicardi-Goutières mendeliano. [35] [18] Además, se ha demostrado que los dominios Zα se localizan en los gránulos de estrés debido a su capacidad innata para unirse a los ácidos nucleicos. Además, los diferentes dominios Zα se unen a la conformación Z del ácido nucleico de forma diferente, lo que proporciona vías importantes para la selección de dianas específicas en el descubrimiento de fármacos.
A medida que se ha investigado más a fondo el Z-ADN, se ha descubierto que la estructura del Z-ADN puede unirse a las proteínas de unión al Z-ADN a través de las fuerzas de van der Waals y los enlaces de hidrógeno . [36] Un ejemplo de una proteína de unión al Z-ADN es la proteína E3L de la viruela vaccinia , que es un producto del gen E3L e imita una proteína de mamífero que se une al Z-ADN. [37] [38] La proteína E3L no solo tiene afinidad por el Z-ADN, sino que también se ha descubierto que desempeña un papel en el nivel de gravedad de la virulencia en ratones causada por el virus de la viruela vaccinia, un tipo de poxvirus . Dos componentes críticos de la proteína E3L que determinan la virulencia son el extremo N y el extremo C. El extremo N está formado por una secuencia similar a la del dominio Zα, también llamado dominio z-alfa de la adenosina desaminasa , mientras que el extremo C está compuesto por un motivo de unión al ARN bicatenario. [37] A través de la investigación realizada por Kim, Y. et al. en el Instituto Tecnológico de Massachusetts, se demostró que reemplazar el extremo N de la proteína E3L con una secuencia del dominio Zα, que contiene 14 residuos de unión al ADN-Z similares a E3L, tuvo poco o ningún efecto sobre la patogenicidad del virus en ratones. [37] Por el contrario, Kim, Y. et al. también encontraron que eliminar los 83 residuos del extremo N de E3L resultó en una disminución de la virulencia. Esto respalda su afirmación de que el extremo N que contiene los residuos de unión al ADN-Z es necesario para la virulencia. [37] En general, estos hallazgos muestran que los residuos de unión al Z-ADN similares dentro del extremo N de la proteína E3L y el dominio Zα son los factores estructurales más importantes que determinan la virulencia causada por el virus vaccinia, mientras que los residuos de aminoácidos que no participan en la unión al Z-ADN tienen poco o ningún efecto. Una implicación futura de estos hallazgos incluye la reducción de la unión al Z-ADN de E3L en las vacunas que contienen el virus vaccinia, de modo que se puedan minimizar las reacciones negativas al virus en los seres humanos. [37]
Además, Alexander Rich y Jin-Ah Kwon descubrieron que E3L actúa como un transactivador para los genes humanos IL-6, NF-AT y p53. Sus resultados muestran que las células HeLa que contienen E3L habían aumentado la expresión de los genes humanos IL-6, NF-AT y p53 y las mutaciones puntuales o deleciones de ciertos residuos de aminoácidos de unión al Z-ADN disminuyeron esa expresión. [36] Específicamente, se encontró que las mutaciones en Tyr 48 y Pro 63 reducían la transactivación de los genes mencionados anteriormente, como resultado de la pérdida de los enlaces de hidrógeno y las fuerzas de dispersión de London entre E3L y el Z-ADN. [36] En general, estos resultados muestran que la disminución de los enlaces e interacciones entre el Z-ADN y las proteínas de unión al Z-ADN disminuye tanto la virulencia como la expresión génica, lo que demuestra la importancia de tener enlaces entre el Z-ADN y la proteína de unión a E3L.