El pirrol es un compuesto orgánico aromático heterocíclico , un anillo de cinco miembros con la fórmula C 4 H 4 NH . [3] Es un líquido volátil incoloro que se oscurece fácilmente al exponerse al aire. Los derivados sustituidos también se denominan pirroles, por ejemplo, N - metilpirrol, C 4 H 4 NCH 3 . El porfobilinógeno , un pirrol trisustituido, es el precursor biosintético de muchos productos naturales como el hemo . [4]
Los pirroles son componentes de macrociclos más complejos, incluidos los porfirinógenos y los productos derivados de ellos, incluidas las porfirinas del hemo , las clorinas , las bacterioclorinas y las clorofilas . [5]
El pirrol es un líquido volátil incoloro que se oscurece fácilmente al exponerse al aire y generalmente se purifica por destilación inmediatamente antes de su uso. [6] El pirrol tiene un olor a nuez. El pirrol es un heterociclo aromático de 5 miembros , como el furano y el tiofeno . A diferencia del furano y el tiofeno, tiene un dipolo en el que el extremo positivo se encuentra del lado del heteroátomo, con un momento dipolar de 1,58 D. En CDCl3 , tiene desplazamientos químicos en 6,68 (H2, H5) y 6,22 (H3, H4). El pirrol es una base extremadamente débil para una amina, con un ácido conjugado p K a de −3,8 . El catión pirrolio más estable termodinámicamente (C4H6N + ) se forma por protonación en la posición 2. La sustitución del pirrol por sustituyentes alquilo proporciona una molécula más básica; por ejemplo, el tetrametilpirrol tiene un ácido conjugado p K a de +3,7. El pirrol también es débilmente ácido en la posición N–H, con un p K a de 16,5. Como ácido de Lewis que forma enlaces de hidrógeno, se clasifica como un ácido duro y el modelo ECW enumera sus parámetros de acidez como E A = 1,38 y C A = 0,68.
El pirrol tiene carácter aromático porque los pares solitarios de electrones en el átomo de nitrógeno están parcialmente deslocalizados en el anillo, creando un sistema aromático 4 n + 2 (ver la regla de Hückel ). En términos de su aromaticidad, la del pirrol es modesta en relación con el benceno , pero comparable a los heterociclos relacionados tiofeno y furano . Las energías de resonancia del benceno, pirrol, tiofeno y furano son, respectivamente, 152, 88, 121 y 67 kJ/mol (36, 21, 29 y 16 kcal/mol). [7] La molécula es plana.
El pirrol fue detectado por primera vez por F. F. Runge en 1834, como un componente del alquitrán de hulla . [8] En 1857, fue aislado del pirolizado de hueso . Su nombre proviene del griego pyrrhos ( πυρρός , "rojizo, ardiente"), de la reacción utilizada para detectarlo: el color rojo que imparte a la madera cuando se humedece con ácido clorhídrico . [9]

El pirrol en sí no se produce de forma natural, pero muchos de sus derivados se encuentran en una variedad de cofactores y productos naturales . Las moléculas comunes producidas naturalmente que contienen pirroles incluyen vitamina B 12 , pigmentos biliares como la bilirrubina y la biliverdina , y las porfirinas del hemo , clorofila , clorinas , bacterioclorinas y porfirinógenos. [5] Otros metabolitos secundarios que contienen pirrol incluyen PQQ, makaluvamina M, rianodina, rhazinilam, lamellarina, prodigiosina, mirmicarina y esceptrina. La síntesis de hemina que contiene pirrol, sintetizada por Hans Fischer , fue reconocida con el Premio Nobel.
El pirrol es un componente del humo del tabaco y puede contribuir a sus efectos tóxicos. [10]
El pirrol se prepara industrialmente mediante el tratamiento del furano con amoníaco en presencia de catalizadores ácidos sólidos , como SiO 2 y Al 2 O 3 . [9]

El pirrol también se puede formar por deshidrogenación catalítica de pirrolidina. [ cita requerida ]
Se han descrito varias síntesis del anillo de pirrol. [11] Tres rutas dominan, [12] pero existen muchos otros métodos.
La síntesis de pirrol de Hantzsch es la reacción de β-cetoésteres ( 1 ) con amoníaco (o aminas primarias) y α-halocetonas ( 2 ) para dar pirroles sustituidos ( 3 ). [13] [14]

La síntesis de pirrol de Knorr implica la reacción de una α-aminocetona o un α-amino-β-cetoéster con un compuesto de metileno activado. [15] [16] [ 17] El método implica la reacción de una α- aminocetona ( 1 ) y un compuesto que contiene un grupo metileno α a (unido al siguiente carbono a) un grupo carbonilo ( 2 ). [18]

En la síntesis de pirrol de Paal-Knorr, un compuesto 1,4-dicarbonílico reacciona con amoníaco o una amina primaria para formar un pirrol sustituido. [19] [20]

Los pirroles de la reacción de Van Leusen se producen por reacción de isocianuro de tosilmetilo (TosMIC) con una enona en presencia de una base, en una adición de Michael . Luego, una 5- endociclación forma el anillo de 5 miembros, que reacciona para eliminar el grupo tosilo. El último paso es la tautomerización al pirrol. [ cita requerida ]
Mediante la síntesis de Barton-Zard , un isocianoacetato reacciona con un nitroalqueno en una adición 1,4, seguida de una ciclización 5 - endo - dig , eliminación del grupo nitro y tautomerización . [21]

Los materiales de partida en la síntesis de pirrol de Piloty-Robinson, llamada así por Gertrude y Robert Robinson y Oskar Piloty , son dos equivalentes de un aldehído y una hidrazina . [22] [23] El producto es un pirrol con sustituyentes en las posiciones 3 y 4. El aldehído reacciona con la diamina para formar una di-imina intermedia ( R−C=N−N=C−R). En el segundo paso, tiene lugar una transposición sigmatrópica [3,3] entre. La adición de ácido clorhídrico conduce al cierre del anillo y la pérdida de amoníaco para formar el pirrol. El mecanismo fue desarrollado por los Robinson.
En una modificación, el propionaldehído se trata primero con hidrazina y luego con cloruro de benzoilo a altas temperaturas y con la ayuda de irradiación de microondas : [24]
![Reacción de Piloty-Robinson[24]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bd/Piloty-Robinson_reaction.png/400px-Piloty-Robinson_reaction.png)
Los pirroles con múltiples sustituyentes se han obtenido a partir de la reacción de münchnonas y alquinos . El mecanismo de reacción implica una cicloadición 1,3-dipolar seguida de pérdida de dióxido de carbono mediante un proceso retro- Diels-Alder . Se pueden realizar reacciones similares utilizando azalactonas.
Los pirroles también se pueden preparar mediante ciclización de alquinos con isonitrilos catalizada por plata , donde R 2 es un grupo que atrae electrones y R 1 es un alcano, un grupo arilo o un éster. También se ha observado que los ejemplos de alquinos disustituidos forman el pirrol deseado con un rendimiento considerable. Se propone que la reacción se lleve a cabo a través de un intermedio de acetiluro de plata . Este método es análogo a la química de clic de azida-alquino utilizada para formar azoles.
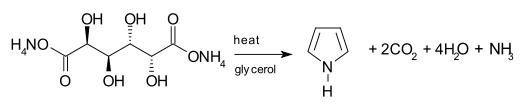
Una vía sintética para obtener pirrol implica la descarboxilación del mucato de amonio , la sal de amonio del ácido múcico . La sal se suele calentar en un sistema de destilación con glicerol como disolvente . [25]
La biosíntesis de los anillos de pirrol comienza con el ácido aminolevulínico (ALA), que se sintetiza a partir de glicina y succinil-CoA . La ALA deshidratasa cataliza la condensación de dos moléculas de ALA a través de una síntesis de anillo de tipo Knorr para formar porfobilinógeno (PBG). Este reacciona posteriormente para formar, por ejemplo, los macrociclos hemo y clorofila . [26]
.
La prolina se deriva biosintéticamente del aminoácido L - glutamato . El glutamato-5-semialdehído se forma primero por la glutamato 5-quinasa (dependiente de ATP) y la glutamato-5-semialdehído deshidrogenasa (que requiere NADH o NADPH). Este puede entonces ciclarse espontáneamente para formar ácido 1-pirrolina-5-carboxílico , que se reduce a prolina por la pirrolina-5-carboxilato reductasa (usando NADH o NADPH), o se convierte en ornitina por la ornitina aminotransferasa , seguida de ciclización por la ornitina ciclodesaminasa para formar prolina. [27]

La prolina se puede utilizar como precursor de pirroles aromáticos en productos naturales secundarios, como las prodigiosinas.

La biosíntesis de prodigiosina [28] [29] implica el acoplamiento convergente de tres anillos de tipo pirrol (marcados como A, B y C en la figura 1) de L -prolina, L -serina, L -metionina, piruvato y 2-octenal.
El anillo A se sintetiza a partir de L -prolina a través de la vía de la sintasa de péptidos no ribosómicos (NRPS) (figura 2), en donde el anillo de pirrolidina de la prolina se oxida dos veces a través de FAD + para producir el anillo de pirrol A.
El anillo A se expande luego a través de la vía de la policétido sintasa para incorporar L -serina al anillo B (figura 3). El fragmento del anillo A se transfiere de la proteína transportadora de peptidilos (PCP) a la proteína transportadora de acilos (ACP) mediante un dominio KS, seguido de la transferencia a malonil-ACP mediante condensación descarboxilativa de Claisen. Este fragmento puede reaccionar entonces con el carbanión enmascarado formado a partir de la descarboxilación mediada por PLP de L -serina, que se cicla en una reacción de deshidratación para producir el segundo anillo de pirrol. Este intermedio se modifica luego por metilación (que incorpora un grupo metilo de L -metionina al alcohol en la posición 6) y oxidación del alcohol primario al aldehído para producir las estructuras centrales del anillo A–B.
Debido a su carácter aromático , el pirrol es difícil de hidrogenar , no reacciona fácilmente como un dieno en las reacciones de Diels-Alder y no experimenta las reacciones habituales de olefina . Su reactividad es similar a la del benceno y la anilina , en el sentido de que es fácil de alquilar y acilar. En condiciones ácidas, los pirroles se oxidan fácilmente a polipirrol , [30] y, por lo tanto, muchos reactivos electrofílicos que se utilizan en la química del benceno no son aplicables a los pirroles. Por el contrario, los pirroles sustituidos (incluidos los pirroles protegidos ) se han utilizado en una amplia gama de transformaciones. [11]
Los pirroles generalmente reaccionan con electrófilos en la posición α (C2 o C5), debido al mayor grado de estabilidad del intermedio protonado.

Los pirroles reaccionan fácilmente con agentes nitrantes (p. ej. HNO3/Ac2O), sulfonantes (Py·SO3) y halogenantes (p. ej. NCS, NBS, Br2, SO2Cl2 y KI / H2O2 ) . [ 31 ] La halogenación generalmente proporciona pirroles polihalogenados , pero se puede realizar una monohalogenación . Como es típico en las adiciones electrofílicas a los pirroles, la halogenación generalmente ocurre en la posición 2, pero también puede ocurrir en la posición 3 por silación del nitrógeno. Este es un método útil para una mayor funcionalización de la posición 3, generalmente menos reactiva. [ cita requerida ]
La acilación ocurre generalmente en la posición 2, mediante el uso de varios métodos. La acilación con anhídridos de ácido y cloruros de ácido puede ocurrir con o sin un catalizador. [32] Los 2-acilpirroles también se obtienen a partir de la reacción con nitrilos, mediante la reacción de Houben-Hoesch . Los aldehídos de pirrol se pueden formar mediante una reacción de Vilsmeier-Haack . [33]
El protón NH en los pirroles es moderadamente ácido con un p K a de 17,5. [34] El pirrol se puede desprotonar con bases fuertes como el butillitio y el hidruro de sodio . [35] El pirrolido alcalino resultante es nucleófilo . El tratamiento de esta base conjugada con un electrófilo como el yodometano da N -metilpirrol.
El pirrol N -metalado puede reaccionar con electrófilos en las posiciones N o C, dependiendo del metal de coordinación. Los enlaces nitrógeno-metal más iónicos (como con litio, sodio y potasio) y más solventes solvatantes conducen a la N -alquilación. Los metales nitrófilos, como MgX, conducen a la alquilación en C (principalmente C2), debido a un mayor grado de coordinación con el átomo de nitrógeno. En los casos de pirroles N -sustituidos, la metalación de los carbonos es más fácil. Los grupos alquilo se pueden introducir como electrófilos o mediante reacciones de acoplamiento cruzado. [ cita requerida ]
La sustitución en C3 se puede lograr mediante el uso de 3-bromopirrol N -sustituido, que se puede sintetizar por bromación de N -sililpirrol con NBS . [ cita requerida ]
Los pirroles pueden sufrir reducciones a pirrolidinas y pirrolinas . [36] Por ejemplo, la reducción de Birch de ésteres y amidas de pirrol produjo pirrolinas, con una regioselectividad que depende de la posición del grupo atractor de electrones. [ cita requerida ]
Los pirroles con sustitución de N pueden sufrir reacciones de cicloadición, como ciclizaciones [4+2], [2+2] y [2+1]. Las ciclizaciones de Diels-Alder pueden ocurrir con el pirrol actuando como un dieno, especialmente en presencia de un grupo atractor de electrones en el nitrógeno. Los vinilpirroles también pueden actuar como dienos. [ cita requerida ]
Los pirroles pueden reaccionar con carbenos , como el diclorocarbeno , en una [2+1]-cicloadición. Con el diclorocarbeno , se forma un intermediario diclorociclopropano, que se descompone para formar 3-cloropiridina (transposición de Ciamician-Dennstedt). [37] [38] [39]
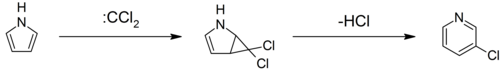
El polipirrol tiene cierto valor comercial. El N -metilpirrol es un precursor del ácido N -metilpirrolcarboxílico, un componente básico de la química farmacéutica. [9] Los pirroles también se encuentran en varios medicamentos, entre ellos atorvastatina , ketorolaco y sunitinib . Los pirroles se utilizan como pigmentos rojos, escarlata y carmín resistentes a la luz. [40] [41]
Los análogos estructurales del pirrol incluyen:
Los derivados del pirrol incluyen el indol , un derivado con un anillo de benceno fusionado .
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite book}}: |journal=ignorado ( ayuda )