En química orgánica , una cicloadición es una reacción química en la que "dos o más moléculas insaturadas (o partes de la misma molécula) se combinan con la formación de un aducto cíclico en el que hay una reducción neta de la multiplicidad de enlaces ". La reacción resultante es una reacción de ciclización . Muchas, pero no todas, las cicloadiciones son concertadas y, por lo tanto, pericíclicas . [1] Las cicloadiciones no concertadas no son pericíclicas. [2] Como una clase de reacción de adición , las cicloadiciones permiten la formación de enlaces carbono-carbono sin el uso de un nucleófilo o electrófilo .
Las cicloadiciones se pueden describir utilizando dos sistemas de notación. Una notación más antigua pero aún común se basa en el tamaño de los arreglos lineales de átomos en los reactivos. Utiliza paréntesis : ( i + j + …) donde las variables son los números de átomos lineales en cada reactivo. El producto es un ciclo de tamaño ( i + j + …) . En este sistema, la reacción estándar de Diels-Alder es una (4 + 2)-cicloadición, la cicloadición 1,3-dipolar es una (3 + 2)-cicloadición y la ciclopropanación de un carbeno con un alqueno es una (2 + 1)-cicloadición. [1]
Una notación más reciente, preferida por la IUPAC, introducida por primera vez por Woodward y Hoffmann , utiliza corchetes para indicar el número de electrones , en lugar de átomos de carbono, involucrados en la formación del producto. En la notación [ i + j + ...], la reacción estándar de Diels-Alder es una [4 + 2]-cicloadición, mientras que la cicloadición 1,3-dipolar también es una [4 + 2]-cicloadición. [1]
Las cicloadiciones térmicas son aquellas cicloadiciones donde los reactantes están en el estado electrónico fundamental. Usualmente tienen (4 n + 2) electrones π participando en el material de partida, para algún entero n . Estas reacciones ocurren por razones de simetría orbital en un sentido suprafacial -suprafacial ( estereoquímica syn / syn ) en la mayoría de los casos. También se han reportado muy pocos ejemplos de reacciones antarafacial -antarafacial ( estereoquímica anti / anti ). Hay algunos ejemplos de cicloadiciones térmicas que tienen 4 n electrones π (por ejemplo la [2 + 2]-cicloadición). Estas proceden en un sentido suprafacial-antarafacial ( estereoquímica syn / anti ), como las reacciones de cicloadición de derivados de cetena y aleno , en las que el conjunto ortogonal de orbitales p permite que la reacción proceda a través de un estado de transición cruzado , aunque el análisis de estas reacciones como [ π 2 s + π 2 a ] es controvertido. También se ha informado que los alquenos tensados, como los derivados del trans -ciclohepteno, reaccionan de manera antarafacial en reacciones de [2 + 2]-cicloadición.
Doering (en una comunicación personal con Woodward ) descubrió que el heptafulvaleno y el tetracianoetileno pueden reaccionar en una cicloadición suprafacial-antarafacial [14 + 2]. Este resultado fue confirmado y ampliado posteriormente por Erden y Kaufmann, quienes informaron sobre la cicloadición suprafacial-antarafacial del heptafulvaleno con N -feniltriazolindiona. [3]

Las cicloadiciones en las que participan electrones π 4n también pueden ocurrir por activación fotoquímica . Aquí, un componente tiene un electrón promovido del HOMO (enlace π) al LUMO ( antienlace π* ). La simetría orbital es entonces tal que la reacción puede proceder de manera suprafacial-suprafacial. Un ejemplo es la reacción de DeMayo . Otro ejemplo se muestra a continuación, la dimerización fotoquímica del ácido cinámico . [4] Los dos alquenos trans reaccionan cabeza con cola, y los isómeros aislados se denominan ácidos truxílicos .
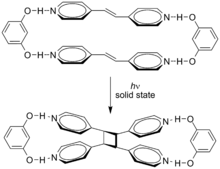
Los efectos supramoleculares pueden influir en estas cicloadiciones. La cicloadición de trans -1,2-bis(4-piridil)eteno está dirigida por resorcinol en estado sólido con un rendimiento del 100 % . [5]
Algunas cicloadiciones en lugar de enlaces π funcionan a través de anillos de ciclopropano tensos , ya que estos tienen un carácter π significativo. Por ejemplo, un análogo de la reacción de Diels-Alder es la reacción del cuadriciclano - DMAD :
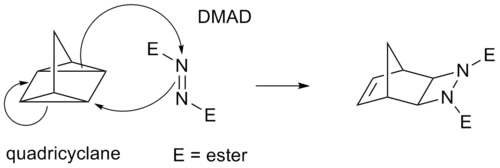
En la notación de cicloadición (i+j+...), i y j se refieren al número de átomos que intervienen en la cicloadición. En esta notación, una reacción de Diels-Alder es una cicloadición (4+2) y una adición 1,3-dipolar, como el primer paso de la ozonólisis, es una cicloadición (3+2). Sin embargo, la notación preferida por la IUPAC , con [i+j+...], tiene en cuenta los electrones y no los átomos. En esta notación, tanto la reacción DA como la reacción dipolar se convierten en una cicloadición [4+2]. La reacción entre el norbornadieno y un alquino activado es una cicloadición [2+2+2].
La reacción de Diels-Alder es quizás la reacción de cicloadición más importante y más enseñada. Formalmente es una reacción de cicloadición [4+2] y existe en una amplia gama de formas, incluyendo la reacción de Diels-Alder de demanda inversa de electrones , la reacción de Diels-Alder de hexadehidro y la trimerización de alquino relacionada . La reacción también puede realizarse en sentido inverso en la reacción de retro-Diels-Alder .
Se conocen reacciones que involucran heteroátomos, incluidas la reacción aza-Diels-Alder y la reacción imina Diels-Alder .
La reacción de cicloadición de Huisgen es una cicloadición (2+3).
La cicloadición de nitrona-olefina es una cicloadición (3+2).
Las reacciones queletrópicas son una subclase de cicloadiciones. La característica distintiva clave de las reacciones queletrópicas es que en uno de los reactivos, ambos enlaces nuevos se forman con el mismo átomo. El ejemplo clásico es la reacción del dióxido de azufre con un dieno .
Existen otras reacciones de cicloadición: cicloadiciones [4+3] , cicloadiciones [6+4] , fotocicloadiciones [2+2] , cicloadiciones centradas en metales y fotocicloadiciones [4+4].
Las cicloadiciones suelen tener análogos radicales catalizados por metales y escalonados , pero no son, estrictamente hablando, reacciones pericíclicas. Cuando en una cicloadición intervienen intermediarios cargados o radicales o cuando el resultado de la cicloadición se obtiene en una serie de pasos de reacción, a veces se las denomina cicloadiciones formales para distinguirlas de las verdaderas cicloadiciones pericíclicas.
Un ejemplo de una cicloadición formal [3+3] entre una enona cíclica y una enamina catalizada por n -butillitio es una reacción en cascada de adición 1,2 / enamina de Stork : [6]
![Una cicloadición formal intermolecular [3+3] entre un cloruro de iminio cíclico y ciclopentenona.](http://upload.wikimedia.org/wikipedia/commons/thumb/5/53/3%2B3_cycloaddition_-_cyclic_iminium_to_cyclic_enone.svg/500px-3%2B3_cycloaddition_-_cyclic_iminium_to_cyclic_enone.svg.png)
Los catalizadores de hierro diiminopiridina contienen un ligando activo redox en el que el átomo central de hierro puede coordinarse con dos enlaces dobles de olefina simples y no funcionalizados. El catalizador puede escribirse como una resonancia entre una estructura que contiene electrones desapareados con el átomo central de hierro en el estado de oxidación II, y una en la que el hierro está en el estado de oxidación 0. Esto le da la flexibilidad para participar en la unión de los enlaces dobles a medida que experimentan una reacción de ciclización, generando una estructura de ciclobutano a través de la eliminación reductora CC; alternativamente, se puede producir una estructura de ciclobuteno mediante la eliminación de beta-hidrógeno. La eficiencia de la reacción varía sustancialmente según los alquenos utilizados, pero el diseño racional del ligando puede permitir la expansión del rango de reacciones que se pueden catalizar. [7] [8]