
La celulasa ( EC 3.2.1.4; nombre sistemático 4-β- D -glucano 4-glucanohidrolasa ) es una de varias enzimas producidas principalmente por hongos , bacterias y protozoos que catalizan la celulólisis , la descomposición de la celulosa y de algunos polisacáridos relacionados :
El nombre también se utiliza para cualquier mezcla o complejo natural de varias de estas enzimas, que actúan en serie o sinérgicamente para descomponer el material celulósico.
Las celulasas descomponen la molécula de celulosa en monosacáridos ("azúcares simples") como la β- glucosa , o polisacáridos y oligosacáridos más cortos . La descomposición de la celulosa tiene una importancia económica considerable, porque hace que un componente importante de las plantas esté disponible para el consumo y el uso en reacciones químicas. La reacción específica involucrada es la hidrólisis de los enlaces 1,4-β- D - glicosídicos en la celulosa, la hemicelulosa , la liquenina y los β- D -glucanos de los cereales . Debido a que las moléculas de celulosa se unen fuertemente entre sí, la celulólisis es relativamente difícil en comparación con la descomposición de otros polisacáridos como el almidón. [2]
La mayoría de los mamíferos tienen una capacidad muy limitada para digerir fibras dietéticas como la celulosa por sí solos. En muchos animales herbívoros, como los rumiantes , como el ganado vacuno y las ovejas, y los fermentadores del intestino posterior , como los caballos, las celulasas son producidas por bacterias simbióticas . Las celulasas endógenas son producidas por unos pocos tipos de animales , como algunas termitas , caracoles [3] [4] [5] y lombrices de tierra .
También se han encontrado celulasas en microalgas verdes ( Chlamydomonas reinhardtii , Gonium pectorale y Volvox carteri ) y sus dominios catalíticos (CD) pertenecientes a la familia GH9 muestran la homología de secuencia más alta con las celulasas endógenas de metazoos. Las celulasas de algas son modulares y consisten en nuevos módulos de unión a carbohidratos (CBM) ricos en cisteína, enlaces ricos en prolina/serina (PS) además de supuestos dominios similares a Ig y desconocidos en algunos miembros. La celulasa de Gonium pectorale consistía en dos CD separados por enlaces y con un CBM C-terminal. [6]
Se conocen varios tipos diferentes de celulasas, que difieren estructuralmente y mecanísticamente. Los sinónimos, derivados y enzimas específicas asociadas con el nombre "celulasa" incluyen endo-1,4-β- D -glucanasa (β-1,4-glucanasa, β-1,4-endoglucano hidrolasa, endoglucanasa D, 1,4-(1,3;1,4)-β- D -glucano 4-glucanohidrolasa), carboximetilcelulosa (CMCase), avicelasa, celudextrinasa , celulasa A, celulosina AP , celulasa alcalina , celulasa A 3 , 9,5 celulasa , celoxilanasa y pancelasa SS . Las enzimas que escinden la lignina se han llamado ocasionalmente celulasas, pero este antiguo uso está en desuso; son enzimas modificadoras de lignina .
Cinco tipos generales de celulasas según el tipo de reacción catalizada:
Dentro de los tipos anteriores también hay tipos progresivos (también conocidos como procesivos) y no progresivos. La celulasa progresiva continuará interactuando con una sola hebra de polisacárido, la celulasa no progresiva interactuará una vez y luego se separará y se conectará con otra hebra de polisacárido.
Se considera que la acción de la celulasa es sinérgica, ya que las tres clases de celulasa pueden producir mucho más azúcar que si se añadieran las tres por separado. Aparte de los rumiantes, la mayoría de los animales (incluidos los humanos) no producen celulasa en sus cuerpos y solo pueden descomponer parcialmente la celulosa mediante la fermentación, lo que limita su capacidad de utilizar energía en el material vegetal fibroso.
La mayoría de las celulasas fúngicas tienen una estructura de dos dominios, con un dominio catalítico y un dominio de unión a celulosa, que están conectados por un enlace flexible. Esta estructura está adaptada para trabajar en un sustrato insoluble y permite que la enzima se difunda bidimensionalmente sobre una superficie de manera similar a una oruga. Sin embargo, también hay celulasas (principalmente endoglucanasas) que carecen de dominios de unión a celulosa.
Tanto la unión de sustratos como la catálisis dependen de la estructura tridimensional de la enzima, que surge como consecuencia del nivel de plegamiento de la proteína . La secuencia de aminoácidos y la disposición de sus residuos que se encuentran dentro del sitio activo, la posición donde se une el sustrato, pueden influir en factores como la afinidad de unión de los ligandos, la estabilización de los sustratos dentro del sitio activo y la catálisis. La estructura del sustrato es complementaria a la estructura precisa del sitio activo de la enzima. Los cambios en la posición de los residuos pueden dar como resultado la distorsión de una o más de estas interacciones. [8] Factores adicionales como la temperatura, el pH y los iones metálicos influyen en las interacciones no covalentes entre la estructura de la enzima. [9] La especie Thermotoga maritima produce celulasas que consisten en 2 láminas β (estructuras proteicas) que rodean una región catalítica central que es el sitio activo. [10] La enzima se clasifica como una endoglucanasa, que escinde internamente los enlaces β-1,4-glicosídicos en las cadenas de celulosa, lo que facilita una mayor degradación del polímero. Distintas especies de la misma familia que T. maritima producen celulasas con diferentes estructuras. [10] Las celulasas producidas por la especie Coprinopsis cinerea constan de siete cadenas de proteínas en forma de túnel cerrado llamado barril β/α. [11] Estas enzimas hidrolizan el sustrato carboximetilcelulosa. La unión del sustrato en el sitio activo induce un cambio en la conformación que permite la degradación de la molécula.
En muchas bacterias, las celulasas in vivo son estructuras enzimáticas complejas organizadas en complejos supramoleculares , los celulosomas . Pueden contener, pero no se limitan a, cinco subunidades enzimáticas diferentes que representan, a saber, endocelulasas, exocelulasas, celobiasas, celulasas oxidativas y fosforilasas de celulosa, en las que solo las exocelulasas y las celobiasas participan en la hidrólisis real del enlace β(1→4). El número de subunidades que componen los celulosomas también puede determinar la tasa de actividad enzimática. [12]
Las celulasas multidominio están muy extendidas entre muchos grupos taxonómicos; sin embargo, las celulasas de bacterias anaeróbicas, que se encuentran en los celulosomas, tienen la arquitectura más compleja, compuesta por diferentes tipos de módulos. Por ejemplo, Clostridium cellulolyticum produce 13 celulasas modulares GH9 que contienen un número y una disposición diferentes de dominio catalítico (CD), módulo de unión a carbohidratos (CBM), dockerina, enlazador y dominio similar a Ig. [13]
El complejo de celulasa de Trichoderma reesei , por ejemplo, comprende un componente denominado C1 (57.000 daltons ) que separa las cadenas de celulosa cristalina, una endoglucanasa (alrededor de 52.000 daltons), una exoglucanasa (alrededor de 61.000 daltons) y una β-glucosidasa (76.000 daltons). [14]
Se han identificado numerosas secuencias "distintivas" conocidas como dockerinas y cohesinas en los genomas de las bacterias que producen celulosomas. Dependiendo de su secuencia de aminoácidos y estructuras terciarias , las celulasas se dividen en clanes y familias. [15]
Las celulasas multimodulares son más eficientes que la enzima libre (con solo CD) debido al sinergismo que se produce por la proximidad entre la enzima y el sustrato celulósico. Las CBM están involucradas en la unión de la celulosa, mientras que los enlaces glicosilados proporcionan flexibilidad a la CD para una mayor actividad y protección de la proteasa, así como una mayor unión a la superficie de la celulosa. [6]


La celulasa se utiliza para el procesamiento comercial de alimentos en el café . Realiza la hidrólisis de la celulosa durante el secado de los granos . Además, las celulasas se utilizan ampliamente en la industria textil y en los detergentes para ropa. También se han utilizado en la industria de la pulpa y el papel para diversos fines, e incluso se utilizan para aplicaciones farmacéuticas. La celulasa se utiliza en la fermentación de biomasa en biocombustibles , aunque este proceso es relativamente experimental en la actualidad. La celulasa se utiliza en medicina como tratamiento para los fitobezoares, una forma de bezoar de celulosa que se encuentra en el estómago humano , y ha demostrado eficacia en la degradación de biopelículas bacterianas polimicrobianas hidrolizando los enlaces glucosídicos β(1-4) dentro de los exopolisacáridos estructurales de la matriz de la sustancia polimérica extracelular (EPS). [17] [18]
Como el sustrato nativo, la celulosa , es un polímero insoluble en agua, los ensayos tradicionales de azúcares reductores que utilizan este sustrato no pueden emplearse para la medición de la actividad de la celulasa. Los científicos analíticos han desarrollado una serie de métodos alternativos.
Se puede utilizar un viscosímetro para medir la disminución de la viscosidad de una solución que contiene un derivado de celulosa soluble en agua, como la carboximetilcelulosa, tras la incubación con una muestra de celulasa. [20] La disminución de la viscosidad es directamente proporcional a la actividad de la celulasa. Si bien estos ensayos son muy sensibles y específicos para la endo -celulasa ( las enzimas de celulasa que actúan como exo -celulasas producen poco o ningún cambio en la viscosidad), están limitados por el hecho de que es difícil definir la actividad en unidades enzimáticas convencionales (micromoles de sustrato hidrolizado o producto producido por minuto).
Los celooligosacáridos de DP inferior (DP2-6) son suficientemente solubles en agua para actuar como sustratos viables para las enzimas celulasas. [21] Sin embargo, como estos sustratos son en sí mismos " azúcares reductores ", no son adecuados para su uso en ensayos tradicionales de azúcares reductores porque generan un alto valor de "blanco". Sin embargo, su hidrólisis mediada por celulasas se puede monitorear mediante métodos de HPLC o IC para obtener información valiosa sobre los requisitos de sustrato de una enzima celulasa en particular.
Los celooligosacáridos se pueden reducir químicamente mediante la acción del borohidruro de sodio para producir sus correspondientes alcoholes de azúcar . Estos compuestos no reaccionan en los ensayos de azúcares reductores, pero sus productos de hidrólisis sí lo hacen. Esto hace que los celooligosacáridos reducidos con borohidruro sean sustratos valiosos para el ensayo de celulasa utilizando ensayos de azúcares reductores tradicionales, como el método de Nelson-Symogyi. [22] [23]
[24]
Estos sustratos se pueden subdividir en dos clases:
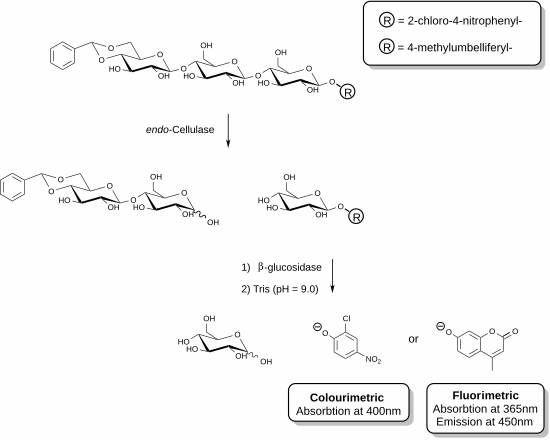
Se han desarrollado nuevos reactivos que permiten la medición específica de la endo -celulasa. [25] [26] Estos métodos implican el uso de sustratos de oligosacáridos funcionalizados en presencia de una enzima auxiliar. En el ejemplo mostrado, una enzima celulasa es capaz de reconocer el fragmento trisacárido de la celulosa y escindir esta unidad. La enzima auxiliar presente en la mezcla de reactivos (β-glucosidasa) actúa entonces para hidrolizar el fragmento que contiene el cromóforo o fluoróforo. El ensayo finaliza con la adición de una solución básica que detiene la reacción enzimática y desprotona el compuesto fenólico liberado para producir la especie de fenolato. La actividad de celulasa de una muestra dada es directamente proporcional a la cantidad de fenolato liberado que se puede medir utilizando un espectrofotómetro. La funcionalización del acetal en el extremo no reductor del sustrato trisacárido evita la acción de la β-glucosidasa auxiliar en el sustrato original.