.jpg/440px-Novel_Coronavirus_SARS-CoV-2_Spike_Protein_(49583626473).jpg)
En virología , una proteína de pico o proteína peplómero es una proteína que forma una gran estructura conocida como pico o peplómero que se proyecta desde la superficie de un virus envuelto . [2] [3] : 29–33 Las proteínas suelen ser glicoproteínas que forman dímeros o trímeros . [3] : 29–33 [4]
El término "peplómero" se refiere a una espícula individual de la superficie viral; colectivamente, la capa de material en la superficie externa del virión se ha denominado "peplos". [5] El término se deriva del griego peplos , "una prenda exterior suelta", [3] "túnica o capa", [6] o "manto de mujer". [5] Los primeros sistemas de taxonomía viral , como el sistema Lwoff - Horne -Tournier propuesto en la década de 1960, utilizaron la apariencia y la morfología de los "peplos" y los peplómeros como características importantes para la clasificación. [5] [7] [8] Más recientemente, el término "peplos" se considera un sinónimo de envoltura viral . [6] : 362
Las espigas o peplómeros son generalmente proyecciones en forma de bastón o maza de la superficie viral. Las proteínas de la espiga son proteínas de membrana con ectodominios externos típicamente grandes , un dominio transmembrana único que ancla la proteína en la envoltura viral y una cola corta en el interior del virión . También pueden formar interacciones proteína-proteína con otras proteínas virales, como las que forman la nucleocápside . [3] : 51–2 Por lo general son glicoproteínas , más comúnmente a través de glicosilación ligada a N que a través de glicosilación ligada a O. [ 3] : 33
Las espigas suelen tener un papel en la entrada viral . Pueden interactuar con los receptores de la superficie celular ubicados en la célula huésped y pueden tener actividad hemaglutinizante como resultado, o en otros casos pueden ser enzimas . [6] : 362 Por ejemplo, el virus de la influenza tiene dos proteínas de superficie con estas dos funciones, hemaglutinina y neuraminidasa . [6] : 329 El sitio de unión para el receptor de la superficie celular generalmente se encuentra en la punta de la espiga. [3] : 33 Muchas proteínas de la espiga son proteínas de fusión de membrana . [9] Al estar expuestas en la superficie del virión, las proteínas de la espiga pueden ser antígenos . [6] : 362
Las espigas o peplómeros pueden ser visibles en imágenes de micrografías electrónicas de virus con envoltura como ortomixovirus , paramixovirus , rabdovirus , filovirus , coronavirus , bunyavirus , arenavirus y retrovirus . [3] : 33
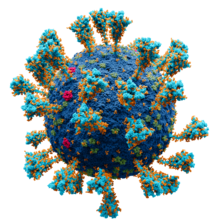
Los coronavirus presentan la proteína de pico de coronavirus , también conocida como proteína S, en sus superficies; S es una proteína de fusión de clase I y es responsable de mediar la entrada viral como el primer paso en la infección viral. [10] Es altamente antigénica y representa la mayoría de los anticuerpos producidos por el sistema inmunológico en respuesta a la infección. Por esta razón, la proteína de pico ha sido el foco del desarrollo de las vacunas COVID-19 en respuesta a la pandemia de COVID-19 causada por el virus SARS-CoV-2 . [11] [12] Un subgénero de los betacoronavirus , conocidos como embecovirus (sin incluir los coronavirus similares al SARS ), tienen una proteína de superficie más corta adicional conocida como hemaglutinina esterasa . [13]
La pandemia de COVID-19 hizo necesaria la identificación de partículas virales en micrografías electrónicas de muestras de tejido de pacientes. Varios informes identificaron erróneamente las estructuras subcelulares normales como coronavirus debido a su parecido superficial con la morfología del coronavirus y porque las espigas distintivas de los coronavirus son evidentes con tinción negativa pero mucho menos visibles en secciones delgadas . [14]
La mayoría de los subgrupos de virus de la gripe tienen dos proteínas de superficie descritas como peplómeros, la neuraminidasa (una enzima ) y la hemaglutinina (también una proteína de fusión de clase I). Algunos, en cambio, tienen una sola proteína hemaglutinina esterasa con ambas funciones. [3] : 356–9
Los retrovirus como el virus de inmunodeficiencia humana (VIH) tienen peplómeros de superficie. [3] : 318–25 Estos son complejos proteicos formados por dos proteínas, gp41 y gp120 , ambas expresadas a partir del gen env , que forman colectivamente un complejo de proteína de pico que media la entrada viral. [15]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )