El poliovirus , el agente causante de la polio (también conocida como poliomielitis), es un serotipo de la especie Enterovirus C , de la familia Picornaviridae . [1] Hay tres serotipos de poliovirus: tipos 1, 2 y 3.
El poliovirus está compuesto por un genoma de ARN y una cápside proteica . El genoma es un genoma de ARN monocatenario de sentido positivo (+ssRNA) que tiene aproximadamente 7500 nucleótidos de largo. [2] La partícula viral tiene aproximadamente 30 nm de diámetro y simetría icosaédrica . Debido a su genoma corto y su composición simple (sólo ARN y una cubierta proteica icosaédrica sin envoltura que lo encapsula ), el poliovirus es ampliamente considerado como el virus significativo más simple. [3]
El poliovirus fue aislado por primera vez en 1909 por Karl Landsteiner y Erwin Popper . [4] La estructura del virus fue dilucidada por primera vez en 1958 mediante difracción de rayos X por un equipo del Birkbeck College dirigido por Rosalind Franklin , [5] [6] mostrando que el virus de la polio tiene simetría icosaédrica. [7]
En 1981, el genoma del poliovirus fue publicado por dos equipos diferentes de investigadores: Vincent Racaniello y David Baltimore en el MIT [8] y Naomi Kitamura y Eckard Wimmer en la Universidad Stony Brook . [9]
La estructura tridimensional del poliovirus fue determinada en 1985 por James Hogle del Instituto de Investigación Scripps mediante cristalografía de rayos X. [10]
El poliovirus es uno de los virus mejor caracterizados y se ha convertido en un sistema modelo útil para comprender la biología de los virus de ARN .
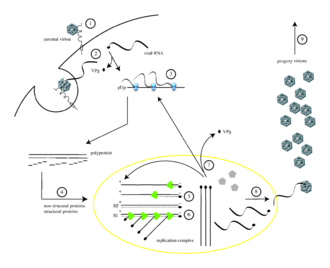
El poliovirus infecta células humanas uniéndose a un receptor similar a una inmunoglobulina , CD155 (también conocido como receptor de poliovirus o PVR) [12] [13] en la superficie celular. [14] La interacción del poliovirus y CD155 facilita un cambio conformacional irreversible de la partícula viral necesaria para la entrada viral. [15] [16] Después de la unión a la membrana de la célula huésped , se pensaba que la entrada del ácido nucleico viral se producía de dos maneras: a través de la formación de un poro en la membrana plasmática a través del cual el ARN luego se "inyecta" en el citoplasma de la célula huésped , o mediante la captación del virus mediante endocitosis mediada por receptores . [17] La evidencia experimental reciente apoya la última hipótesis y sugiere que el poliovirus se une al CD155 y es absorbido por endocitosis. Inmediatamente después de la internalización de la partícula, se libera el ARN viral. [18]
El poliovirus es un virus de ARN de cadena positiva . Por lo tanto, el genoma encerrado dentro de la partícula viral puede usarse como ARN mensajero y ser traducido inmediatamente por la célula huésped. Al entrar, el virus secuestra la maquinaria de traducción de la célula, provocando la inhibición de la síntesis de proteínas celulares a favor de la producción de proteínas específicas del virus. [19] A diferencia de los ARNm de la célula huésped, el extremo 5' del ARN del poliovirus es extremadamente largo (más de 700 nucleótidos) y muy estructurado. Esta región del genoma viral se llama sitio de entrada al ribosoma interno (IRES). Esta región consta de muchas estructuras secundarias y 3 o 4 dominios. El dominio 3 es un elemento de ARN autoplegable que contiene motivos estructurales conservados en varios bucles de tallo estables unidos por dos uniones de cuatro vías. Como IRES consta de muchos dominios, estos dominios en sí constan de muchos bucles que contribuyen a la traducción modificada sin una tapa terminal 5' mediante el secuestro de ribosomas. El bucle de interacción del dominio 3 se conoce como tetrabucle GNRA. Los residuos de adenosinas A180 y A181 en el tetrabucle GUAA forman enlaces de hidrógeno mediante interacciones de emparejamiento de bases no canónicas con los pares de bases de los receptores C230/G242 y G231/C241, respectivamente. [20] Las mutaciones genéticas en esta región previenen la producción de proteínas virales. [21] [22] [23] El primer IRES descubierto se encontró en el ARN del poliovirus. [24]
El ARNm del poliovirus se traduce como un polipéptido largo . Luego, este polipéptido se autoescinde mediante proteasas internas en aproximadamente 10 proteínas virales individuales. No todas las escisiones se producen con la misma eficacia. Por lo tanto, las cantidades de proteínas producidas por la escisión del polipéptido varían: por ejemplo, se producen cantidades más pequeñas de pol 3D que las de las proteínas de la cápside, VP1–4. [25] [26] Estas proteínas virales individuales son: [3] [27]

Después de la traducción, transcripción y replicación del genoma, que implican un solo proceso, se realiza la síntesis de (+)ARN). Para que se replique el ARN (+) infectante, se deben transcribir múltiples copias de ARN (-) y luego usarlas como plantillas para la síntesis de ARN (+). Los intermediarios replicativos (RI), que son una asociación de moléculas de ARN que consisten en un ARN molde y varios ARN en crecimiento de longitud variable, se observan tanto en los complejos de replicación de los ARN (-) como de los ARN (+). Para la síntesis de cada ARN de cadena negativa y positiva, la proteína VPg del poliovirus actúa como cebador. La ARN polimerasa dependiente de ARN del poliovirus agrega dos nucleótidos de uracilo (UU) a la proteína VPg utilizando la cola poli(A) en el extremo 3' del genoma +ssRNA como patrón para la síntesis del ARN antigenómico de cadena negativa. Para iniciar esta síntesis de ARNss, se necesita el hidroxilo de tirosina de VPg. Pero para el inicio de la síntesis de ARN de cadena positiva, se necesita la uridililación de VPg dependiente de CRE. Esto significa que VPg se utiliza nuevamente como cebador, pero esta vez agrega los dos trifosfatos de uridina usando un elemento de replicación que actúa en cis (CRE) como plantilla. [29] [30]
La CRE del poliovirus se identifica como un tallo de pares de bases no logrado y un bucle final que consta de 61 nt. La CRE se encuentra en los enterovirus. Es un elemento estructural de ARN secundario altamente conservado y está alojado en la región codificante de poliproteínas del genoma. El complejo se puede translocar a la región 5' del genoma que no tiene actividad codificante, al menos a 3,7 kb de distancia de la ubicación inicial. Este proceso puede ocurrir sin influir negativamente en la actividad. Las copias CRE no influyen negativamente en la replicación. El proceso de uridililación de VPg que tiene lugar en CRE necesita la presencia de 3CD pro , que es una proteína de unión a ARN. Está adscrito a la CRE directa y específicamente. Gracias a su presencia, VPg puede unir correctamente el CRE y la producción primaria se desarrolla sin problemas. [31]
Algunas de las moléculas de ARN (+) se utilizan como plantillas para una mayor síntesis de ARN (-), algunas funcionan como ARNm y otras están destinadas a ser genomas de viriones descendientes. [25]
En el ensamblaje de nuevas partículas virales (es decir, el empaquetado del genoma de la progenie en una procápside que puede sobrevivir fuera de la célula huésped), que incluye, respectivamente: [32]
El poliovirus completamente ensamblado abandona los confines de su célula huésped mediante lisis [33] de 4 a 6 horas después del inicio de la infección en células de mamífero cultivadas. [34] El mecanismo de liberación viral de la célula no está claro, [2] pero cada célula moribunda puede liberar hasta 10.000 viriones de polio . [34]
Drake demostró que el poliovirus puede sufrir una reactivación multiplicidad. [35] Es decir, cuando los poliovirus se irradiaban con luz ultravioleta y se les permitía sufrir múltiples infecciones de las células huésped, se podía formar una progenie viable incluso con dosis de radiación ultravioleta que inactivaban el virus en infecciones únicas. El poliovirus puede sufrir recombinación genética cuando al menos dos genomas virales están presentes en la misma célula huésped. Kirkegaard y Baltimore [36] presentaron evidencia de que la ARN polimerasa dependiente de ARN (RdRP) cataliza la recombinación mediante un mecanismo de elección de copia en el que la RdRP cambia entre plantillas de ARNss (+) durante la síntesis de cadena negativa. La recombinación en los virus de ARN parece ser un mecanismo adaptativo para reparar el daño del genoma. [37] [38]
El poliovirus es estructuralmente similar a otros enterovirus humanos ( coxsackievirus , echovirus y rinovirus ), que también utilizan moléculas similares a las inmunoglobulinas para reconocer las células huésped y entrar en ellas. [13] El análisis filogenético de las secuencias de ARN y proteínas del poliovirus sugiere que puede haber evolucionado a partir de un ancestro del virus Coxsackie A del grupo C , que surgió a través de una mutación dentro de la cápside. [39] La especiación distintiva del poliovirus probablemente ocurrió como resultado de un cambio en la especificidad del receptor celular de la molécula de adhesión intercelular-1 (ICAM-1), utilizada por los virus Coxsackie A del grupo C, a CD155 ; lo que lleva a un cambio en la patogenicidad y permite que el virus infecte el tejido nervioso.
La tasa de mutación en el virus es relativamente alta incluso para un virus de ARN con una tasa de sustitución sinónima de 1,0 x 10 −2 sustituciones/sitio/año y una tasa de sustitución no sinónima de 3,0 x 10 −4 sustituciones/sitio/año. [40] La distribución de bases dentro del genoma no es aleatoria, siendo la adenosina menos común de lo esperado en el extremo 5' y más alta en el extremo 3'. [41] El uso de codones no es aleatorio: se favorecen los codones que terminan en adenosina y se evitan los que terminan en citosina o guanina . El uso de codones difiere entre los tres genotipos y parece estar impulsado por mutación más que por selección. [42]
Los tres serotipos de poliovirus, PV-1, PV-2 y PV-3, tienen cada uno una proteína de la cápside ligeramente diferente. Las proteínas de la cápside definen la especificidad del receptor celular y la antigenicidad del virus. PV-1 es la forma más común que se encuentra en la naturaleza, pero las tres formas son extremadamente infecciosas . [4] En marzo de 2020, el PV-1 salvaje está altamente localizado en regiones de Pakistán y Afganistán. La certificación de la erradicación de la transmisión autóctona se produjo en septiembre de 2015 para el PV-2 silvestre, después de su última detección en 1999, [43] y en octubre de 2019 para el PV-3 silvestre, después de su última detección en 2012. [44]
Se utilizan cepas específicas de cada serotipo para preparar vacunas contra la polio . La vacuna inactiva contra la polio se prepara mediante la inactivación con formalina de tres cepas de referencia salvajes y virulentas: Mahoney o Brunenders (PV-1), MEF-1/Lansing (PV-2) y Saukett/Leon (PV-3). La vacuna oral contra la polio contiene cepas vivas atenuadas (debilitadas) de los tres serotipos de poliovirus. El paso de las cepas del virus a las células epiteliales del riñón de mono introduce mutaciones en el IRES viral y dificulta (o atenúa) la capacidad del virus para infectar el tejido nervioso. [34]
Los poliovirus se clasificaban anteriormente como una especie distinta perteneciente al género Enterovirus de la familia Picornaviridae . En 2008, se eliminó la especie Poliovirus y los tres serotipos fueron asignados a la especie Enterovirus C humano (más tarde rebautizada como Enterovirus C ), en el género Enterovirus de la familia Picornaviridae . La especie tipo del género Enterovirus se cambió de Poliovirus a Enterovirus C (humano) . [45]
El principal determinante de la infección de cualquier virus es su capacidad para ingresar a una célula y producir partículas infecciosas adicionales. Se cree que la presencia de CD155 define los animales y tejidos que pueden infectarse por el poliovirus. CD155 se encuentra (fuera de los laboratorios) sólo en las células de humanos, primates superiores y monos del Viejo Mundo . Sin embargo, el poliovirus es estrictamente un patógeno humano y no infecta naturalmente a ninguna otra especie (aunque los chimpancés y los monos del Viejo Mundo pueden infectarse experimentalmente). [46]
El gen CD155 parece haber sido objeto de selección positiva . [47] La proteína tiene varios dominios, de los cuales el dominio D1 contiene el sitio de unión del virus de la polio. Dentro de este dominio, 37 aminoácidos son responsables de unirse al virus.
El poliovirus es un enterovirus . La infección se produce por vía fecal-oral , lo que significa que uno ingiere el virus y se produce la replicación viral en el tracto gastrointestinal . [48] El virus se elimina en las heces de personas infectadas. En el 95% de los casos sólo se produce una presencia primaria y transitoria de viremia (virus en el torrente sanguíneo) y la infección por poliovirus es asintomática . En aproximadamente el 5% de los casos, el virus se propaga y se replica en otros sitios como la grasa parda , el tejido reticuloendotelial y el músculo . La replicación viral sostenida causa viremia secundaria y conduce al desarrollo de síntomas menores como fiebre, dolor de cabeza y dolor de garganta. [49] La poliomielitis paralítica ocurre en menos del 1% de las infecciones por poliovirus. La enfermedad paralítica ocurre cuando el virus ingresa al sistema nervioso central (SNC) y se replica en las neuronas motoras dentro de la médula espinal , el tronco del encéfalo o la corteza motora , lo que resulta en la destrucción selectiva de las neuronas motoras que conduce a una parálisis temporal o permanente . Este es un evento muy raro en los bebés, que todavía tienen anticuerpos antipoliovirus adquiridos de sus madres. [50] En casos raros, la poliomielitis paralítica provoca un paro respiratorio y la muerte. En los casos de enfermedad paralítica, con frecuencia se observan dolores y espasmos musculares antes de la aparición de la debilidad y la parálisis. La parálisis suele persistir desde días hasta semanas antes de la recuperación. [51]
En muchos aspectos, se cree que la fase neurológica de la infección es una desviación accidental de la infección gastrointestinal normal . [17] Los mecanismos por los cuales el poliovirus ingresa al SNC no se conocen bien. Se han sugerido tres hipótesis no mutuamente excluyentes para explicar su entrada. Todas las teorías requieren viremia primaria. La primera hipótesis predice que los viriones pasan directamente de la sangre al sistema nervioso central cruzando la barrera hematoencefálica independientemente del CD155. [52] Una segunda hipótesis sugiere que los viriones se transportan desde los tejidos periféricos que han sido bañados en la sangre virémica, por ejemplo, el tejido muscular, hasta la médula espinal a través de vías nerviosas mediante transporte axonal retrógrado . [53] [54] [55] Una tercera hipótesis es que el virus se importa al SNC a través de monocitos o macrófagos infectados . [11]
La poliomielitis es una enfermedad del sistema nervioso central. Sin embargo, se cree que CD155 está presente en la superficie de la mayoría o de todas las células humanas. Por tanto, la expresión del receptor no explica por qué el poliovirus infecta preferentemente determinados tejidos. Esto sugiere que el tropismo tisular se determina después de la infección celular. Trabajos recientes han sugerido que la respuesta al interferón tipo I (específicamente la del interferón alfa y beta) es un factor importante que define qué tipos de células apoyan la replicación del poliovirus. [56] En ratones que expresan CD155 (mediante ingeniería genética) pero que carecen del receptor de interferón tipo I, el poliovirus no solo se replica en un repertorio ampliado de tipos de tejidos, sino que estos ratones también pueden infectarse oralmente con el virus. [57]
El poliovirus utiliza dos mecanismos clave para evadir el sistema inmunológico . En primer lugar, puede sobrevivir a las condiciones altamente ácidas del estómago, lo que permite que el virus infecte al huésped y se propague por todo el cuerpo a través del sistema linfático . [3] En segundo lugar, debido a que puede replicarse muy rápidamente, el virus abruma los órganos del huésped antes de que se pueda generar una respuesta inmune. [58] Si se dan detalles en la fase de embargo; Los poliovirus con cañones en la superficie del virión tienen sitios de unión del virus ubicados en bolsas en las bases de los cañones. Los cañones son demasiado estrechos para el acceso de los anticuerpos , por lo que los sitios de unión del virus están protegidos de la vigilancia inmune del huésped, mientras que el resto de la superficie del virión puede mutar para evitar la respuesta inmune del huésped. [59]
Las personas que están expuestas al virus de la polio, ya sea a través de una infección o mediante la inmunización con la vacuna contra la polio , desarrollan inmunidad . En individuos inmunes, los anticuerpos contra el poliovirus están presentes en las amígdalas y el tracto gastrointestinal (específicamente anticuerpos IgA ) y pueden bloquear la replicación del poliovirus; Los anticuerpos IgG e IgM contra el poliovirus pueden prevenir la propagación del virus a las neuronas motoras del sistema nervioso central. [34] La infección por un serotipo de poliovirus no proporciona inmunidad contra los otros serotipos; sin embargo, los segundos ataques dentro del mismo individuo son extremadamente raros. [60]
Aunque los humanos son los únicos huéspedes naturales conocidos del poliovirus, los monos pueden infectarse experimentalmente y se han utilizado durante mucho tiempo para estudiar el poliovirus. En 1990-91, dos laboratorios desarrollaron un modelo de poliomielitis en animales pequeños. Se diseñaron ratones para expresar un receptor humano del poliovirus (hPVR). [61] [62]
A diferencia de los ratones normales, los ratones transgénicos con receptor de poliovirus (TgPVR) son susceptibles al poliovirus inyectado por vía intravenosa o intramuscular y cuando se inyecta directamente en la médula espinal o el cerebro . [63] Tras la infección, los ratones TgPVR muestran signos de parálisis que se asemejan a los de la poliomielitis en humanos y monos, y el sistema nervioso central de los ratones paralizados es histocitoquímicamente similar al de los humanos y los monos. Este modelo de ratón de infección por poliovirus humano ha demostrado ser una herramienta invaluable para comprender la biología y patogenicidad del poliovirus. [64]
Se han estudiado bien tres tipos distintos de ratones TgPVR: [65]
Recientemente, se desarrolló un cuarto modelo de ratón TgPVR. Estos ratones "cPVR" portan ADNc de hPVR , impulsado por un promotor de β- actina , y han demostrado ser susceptibles al poliovirus por vía intracerebral, intramuscular e intranasal. Además, estos ratones son capaces de desarrollar la forma bulbar de polio tras la inoculación intranasal. [66]
El desarrollo del ratón TgPVR ha tenido un profundo efecto en la producción de la vacuna oral contra la polio (OPV). Anteriormente, el control de la seguridad de la OPV debía realizarse con monos, porque sólo los primates son susceptibles al virus. En 1999, la Organización Mundial de la Salud aprobó el uso del ratón TgPVR como método alternativo para evaluar la eficacia de la vacuna contra el poliovirus tipo 3. En 2000, se aprobó el modelo de ratón para pruebas de vacunas contra los poliovirus tipo 1 y tipo 2. [67]

En 1981, Racaniello y Baltimore utilizaron tecnología de ADN recombinante para generar el primer clon infeccioso de un virus de ARN animal, el poliovirus. Se introdujo ADN que codifica el genoma de ARN del poliovirus en células de mamíferos cultivadas y se produjo poliovirus infeccioso. [68] La creación del clon infeccioso impulsó la comprensión de la biología del poliovirus y se ha convertido en una tecnología estándar utilizada para estudiar muchos otros virus.
En 2002, el grupo de Eckard Wimmer en la Universidad Stony Brook logró sintetizar poliovirus a partir de su código químico, produciendo el primer virus sintético del mundo. [69] Los científicos primero convirtieron la secuencia de ARN publicada del poliovirus, de 7741 bases de largo, en una secuencia de ADN, ya que el ADN era más fácil de sintetizar. Se obtuvieron fragmentos cortos de esta secuencia de ADN mediante pedido por correo y se ensamblaron. Luego, una empresa de síntesis genética ensambló el genoma viral completo . Se incorporaron diecinueve marcadores al ADN sintetizado para poder distinguirlo del poliovirus natural. Se utilizaron enzimas para convertir el ADN nuevamente en ARN, su estado natural. Luego se utilizaron otras enzimas para traducir el ARN en un polipéptido, produciendo una partícula viral funcional. Todo este minucioso proceso duró dos años. El virus sintético recién creado se inyectó en ratones transgénicos PVR para determinar si la versión sintética era capaz de causar enfermedades. El virus sintético pudo replicarse, infectar y causar parálisis o muerte en ratones. Sin embargo, la versión sintética era entre 1.000 y 10.000 veces más débil que el virus original, probablemente debido a uno de los marcadores añadidos. [70]
En los primeros ensayos clínicos se probó una modificación del poliovirus, llamada PVSRIPO , como posible tratamiento contra el cáncer. [71] [ necesita actualización ]