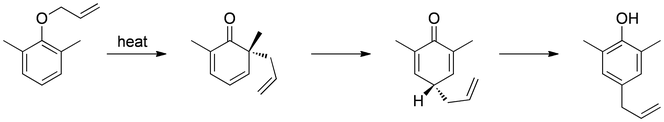
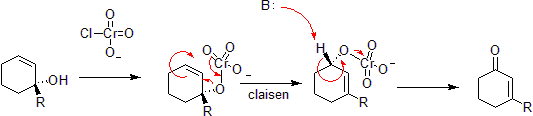
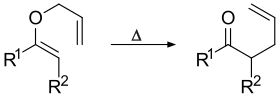Transposición de Claisen
La transposición de Claisen (que no debe confundirse con la condensación de Claisen) es una reacción química orgánica pericíclica, que forma enlaces carbono-carbono.
El calentamiento de un alil vinil éter iniciará una reordenación sigmatropica [3,3] para dar un carbonilo γ, δ-insaturado.
Se ha demostrado que los reactivos de organoaluminio trivalentes, como el trimetilaluminio, aceleran esta reacción.
Las cetenas sustituidas con halógeno (R1, R2) se usan a menudo en esta reacción por su alta electrofilicidad.
Se han desarrollado numerosos métodos reductores para la eliminación de los α-haloésteres, amidas y tioésteres resultantes.
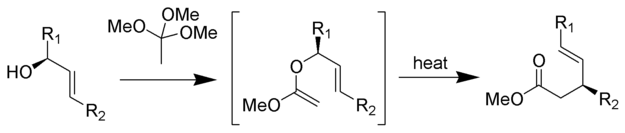
[19][20][21][22][23] La transposición de Eschenmoser-Claisen se lleva a cabo calentando alcoholes alílicos en presencia de N, N-dimetilacetamida dimetil acetal para formar una amida γ, δ-insaturada.
[34][35] Un catión iminio puede servir como uno de los residuos con enlace π en la transposición.
Los iones de acilamonio son altamente selectivos para los enolatos Z en condiciones leves.
[43][44] La enzima corismato mutasa (EC 5.4.99.5) cataliza la reorganización de Claisen del corismato a prefenato, un intermediario clave en la ruta biosintética hacia la síntesis de fenilalanina y tirosina.