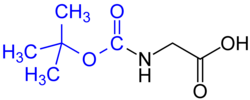
Grupo protector
Siempre reaccionará con los grupos carbonilo, y esto no puede evitarse de ninguna forma.
Cuando se requiere la reducción de un éster y a la vez existe en la molécula un grupo carbonilo no éster, tiene que impedirse el ataque de los iones hidruro (donados por el LiAlH4) al grupo carbonilo.
Esto se puede hacer, por ejemplo, convirtiendo el grupo carbonilo en un acetal, que no reacciona con los hidruros.
[3] Como una prueba del concepto, la deprotección ortogonal se demuestra en una transesterificación fotoquímica por trimetilsilidiazometano, utilizando el efecto cinético isotópico:[4] Debido a este efecto, el rendimiento cuántico para la desprotección del grupo éster de la derecha está reducido y permanece intacto.
[5] En térmicos prácticos, su uso añade dos pasos (protección y desprotección) a la síntesis, en los cuales (ya sea en uno o en ambos) se puede reducir considerablemente el rendimiento de la reacción.