Fosforilación oxidativa
Los tres complejos se asocian en supercomplejos para canalizar las moléculas transportadoras de electrones, la coenzima Q y el citocromo c, haciendo más eficiente el proceso.
En vertebrados, y posiblemente en todo el reino animal, se genera un ATP por cada 2,7 protones translocados.
[7] En un principio la propuesta fue muy controvertida, pero fue aceptada lentamente y finalmente Mitchell recibió el Premio Nobel de Química en 1978 por su teoría.
Estas enzimas son como una batería, ya que realizan trabajo, para llevar corriente a través del circuito.
Estos procesos utilizan moléculas de transferencia tanto solubles como unidas a proteínas.
Los electrones se desplazan largas distancias a través de las proteínas saltando entre las cadenas que forman estos cofactores.
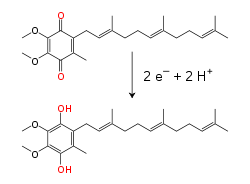
[26] Esto ocurre por efecto túnel, el cual es rápido sobre distancias menores a 1,4−9 m.[27] Muchos procesos bioquímicos catabólicos, tales como la glucólisis, el ciclo de Krebs y la beta oxidación, producen la coenzima reducida NADH.
La membrana crestal está enriquecida en los componentes de estos complejos, aproximadamente en un 70 % del total.
El primer paso consiste en la transferencia de dos electrones desde el NADH a la Flavina mononucleótido en la subunidad NDFUV1.
[36] El lugar donde se une la quinona, entre las subunidades hidrofóbica e hidrofílica parece tener la suficiente holgura para aceptar una gran variedad de bloqueantes.
[45] El resto de subunidades del complejo I mitocondrial, llamadas «accesorias», o «supernumerarias», varía en su número según las especies, tienen funciones enzimáticas aparentemente no relacionadas con la transducción energética, y su función no se comprende completamente.
El ensamblaje de la enzima es muy complejo y no conocido en su totalidad, produciéndose patologías si surgen defectos.
[52] Otra función no convencional del complejo II es observada en el parásito que provoca la malaria Plasmodium falciparum.
[56][57] En plantas, la oxidorreductasa ETF-Q también es importante en la respuesta que permite la supervivencia por extensos periodos de oscuridad.
[59] Estas enzimas no transportan protones, y por ello, reducen ubiquinona sin alterar el gradiente electroquímico a través de la membrana interna.
Las ventajas que se obtienen por estas rutas más cortas no son del todo conocidas.
[64][65] Las rutas alternativas podrían, por lo tanto, aumentar la resistencia de los organismos ante daños, reduciendo el estrés oxidativo.
El modelo original sobre como los complejos de la cadena respiratoria están organizados era que estos difundían libremente en la membrana mitocondrial.
[75] Sin embargo, datos recientes sugieren que los complejos podrían formar estructuras de alto orden llamadas supercomplejos o "respirasomas.
"[76] En este modelo varios complejos existen como conjuntos organizados de enzimas que interaccionan entre ellas.
Por ejemplo, las bacterias nitrificantes tales como Nitrobacter oxidan nitrito a nitrato, donando electrones al oxígeno.
[86] Este problema es solucionado utilizando una nitrito oxidorreductasa para producir la suficiente fuerza protón motriz como para hacer funcionar la cadena de transporte de electrones en sentido inverso, haciendo que el complejo I genere NADH.
[89] Esta flexibilidad es posible porque diferentes oxidasas y reductasas utilizan las mismas reservas de ubiquinona.
[84] Por ello es que estas cadenas respiratorias tienen un diseño modular fácilmente intercambiable con otros conjuntos de enzimas.
[90] ATP sintasa, también llamada complejo V, es la enzima final del proceso de la fosforilación oxidativa.
Las estimaciones del número de protones necesarios para sintetizar una molécula de ATP oscilan entre tres y cuatro,[92][93] y algunos investigadores sugieren que las células pueden variar esta proporción, para ajustarse a diferentes condiciones.
Esta reacción de fosforilación es un equilibrio, que puede ser cambiado alterando la fuerza protón motriz.
[91] Es más, en la cercanamente relacionada proteína H+-ATPasa tipo vacuolar, la misma reacción es usada para acidificar los compartimentos celulares, bombeando protones e hidrolizando ATP.
Estas subunidades son incapaces de rotar debido al brazo lateral que actúa como un estátor.
[109] Esta respiración rápida produce calor, y es particularmente importante como una vía para mantener la temperatura corporal en la hibernación de los animales, aunque estas proteínas pueden también tener una función más general en la respuesta de las células al estrés oxidativo.

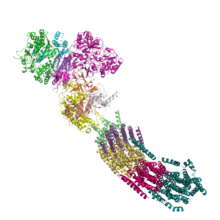
El modelo actual cubre algunos problemas suscitados por el anterior. En primer lugar, todos los componentes activos de la cadena de transporte de electrones se encuentran exclusivamente en las crestas mitocondriales y formando supercomplejos, en la imagen representado por el supercomplejo I 1 III 2 IV 1 . Esto permite canalizar de unos complejos a otros las moléculas de transferencia de electrones. Previamente se pensaba que difundían libremente. En segundo lugar, la diferencia de pH , uno de los componentes de la fuerza protón-motriz junto con el potencial de membrana ( Δ Ψ ) es de tan sólo 0,55 unidades, equivalente a 32 m V , insuficiente para impulsar la fosforilación. Sin embargo, existen circunstancias locales que aumentan este pH en un factor de 2 unidades. En primer lugar, la ATP sintasa forma dímeros y filas que comban y dan forma a la cresta mitocondrial, haciendo que el espacio interno tenga tan sólo 20 ± 4 nm . El espacio entre la membrana interna y externa es menor, de 12 ± 2,5 nm , pero cuenta con poros lo suficientemente grandes como para estar en equilibrio con el citoplasma. Los protones se concentran gracias al « efecto superficie » y al rápido flujo desde las fuentes de protones a los sumideros. :V