Metal de transición
Los metales de transición son aquellos elementos químicos que están situados en la parte central del sistema periódico, en el constante bloque D, cuya principal característica es la inclusión en su configuración electrónica del orbital d, parcialmente lleno de electrones.Solo se forman unas pocas especies transitorias de estos elementos que dan lugar a iones con una subcapa d parcialmente completa.Por ejemplo mercurio (I) solo se encuentra como Hg22+, el cual no forma un ion aislado con una subcapa parcialmente llena, por lo que los tres elementos son inconsistentes con la definición anterior.El elemento 112 podría también ser excluido aunque sus propiedades de oxidación no son observadas debido a su naturaleza radioactiva.Y así sucesivamente; este fenómeno se le llama "Transición electrónica".Sc e Y en el grupo 3 también se reconocen generalmente como metales de transición.Sin embargo, esto da como resultado una división del bloque d en dos porciones bastante desiguales.[7][14][15] Esta clasificación se basa en similitudes en el comportamiento químico (aunque esta similitud en su mayoría solo existe entre los lantánidos) y define 15 elementos en cada una de las dos series, aunque corresponden al relleno de un f subcapa, que solo puede contener 14 electrones.(Lr es una excepción donde el electrón d se reemplaza por un electrón p, pero la diferencia de energía es lo suficientemente pequeña como para que en un entorno químico a menudo muestre ocupación d de todos modos).Los elementos del grupo 12 Zn, Cd y Hg pueden, por lo tanto, bajo ciertos criterios, ser clasificados como metales de post-transición en este caso.Debido a su estructura, los metales de transición forman muchos iones y complejos coloreados.Por ejemplo el MnO4− (Mn en el estado de oxidación 7+) es un compuesto violeta, mientras que Mn2+ es rosado pálido.Cuando un ion con ligandos absorbe luz algunos electrones son promovidos a un orbital de mayor energía.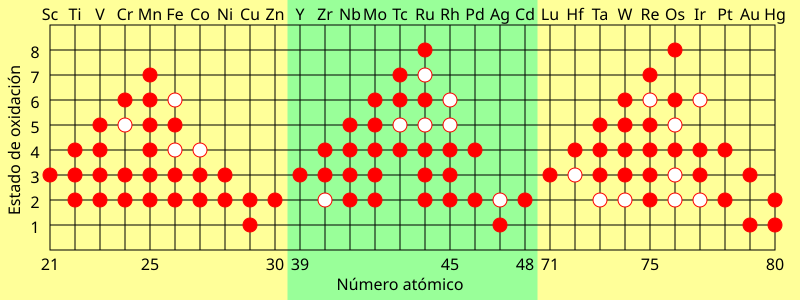
Un círculo lleno representa el estado de oxidación común, un anillo de centro blanco representa uno menos común (menos favorable energéticamente).
