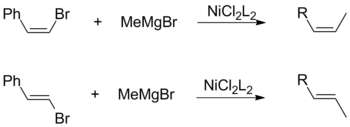Acoplamiento de Kumada
A pesar del desarrollo posterior de reacciones alternativas (Suzuki, Sonogashira, Stille, etc), el acoplamiento de Kumada se sigue empleando en muchas aplicaciones sintéticas, incluida la producción a escala industrial de aliskiren, un medicamento para la hipertensión, y politiofenos, útiles en dispositivos electrónicos orgánicos.
[6] Sin embargo, estos primeros enfoques produjeron bajos rendimientos debido a la formación sustancial de productos de homoacoplamiento, donde se acoplan dos especies idénticas.
[7] Posteriormente, se han desarrollado muchas técnicas de acoplamiento adicionales, que culminaron con el reconocimiento del Premio Nobel de Química en 2010 a Eiichi Negishi, Akira Suzuki y Richard Heck por sus contribuciones al campo.
Inicialmente, el catalizador de Pd(0) rico en electrones (1) se inserta en el enlace R-X del haluro orgánico.
La transmetalación posterior con el reactivo de Grignard forma un complejo heteroorganometálico (3).
[9] En general, el mecanismo aún puede describirse como análogo al esquema de paladio: Sin embargo, bajo ciertas condiciones de reacción, el mecanismo no logra explicar todas las observaciones.
El examen realizado por Vicic y sus colaboradores, utilizando el ligando de terpiridina tridentado identificó intermediarios de un ciclo catalítico de Ni(II)-Ni(I)-Ni(III),[10] lo que sugiere un esquema más complicado.