Uremia es el término que designa los altos niveles de urea en la sangre. La urea es uno de los componentes principales de la orina . Puede definirse como un exceso en la sangre de productos finales del metabolismo de aminoácidos y proteínas , como la urea y la creatinina , que normalmente se excretarían en la orina. El síndrome urémico puede definirse como la manifestación clínica terminal de la insuficiencia renal (también llamada insuficiencia renal ). [1] Son los signos, síntomas y resultados de las pruebas de laboratorio que resultan de una función excretora, reguladora y endocrina inadecuada de los riñones. [2] Tanto la uremia como el síndrome urémico se han utilizado indistintamente para denotar una concentración plasmática de urea muy alta que es el resultado de la insuficiencia renal. [1] La primera denotación se utilizará en el resto del artículo.
La azoemia es una afección similar, menos grave, con niveles elevados de urea, en la que la anomalía se puede medir químicamente, pero aún no es tan grave como para producir síntomas. La uremia describe las manifestaciones patológicas y sintomáticas de la azoemia grave. [1]
No existe un momento específico para la aparición de uremia en personas con pérdida progresiva de la función renal . Las personas con una función renal inferior al 50 % (es decir, una tasa de filtración glomerular [TFG] entre 50 y 60 ml/min) y mayores de 30 años pueden tener uremia en cierto grado. Esto significa que aproximadamente 8 millones de personas en los Estados Unidos con una TFG de menos de 60 ml/min tienen síntomas urémicos. [3] Los síntomas, como la fatiga, pueden ser muy vagos, lo que dificulta el diagnóstico de deterioro de la función renal. El tratamiento puede ser mediante diálisis o un trasplante de riñón , aunque algunos pacientes optan por buscar el control de los síntomas y la atención conservadora en su lugar. [3]
Los signos clásicos de uremia son: debilidad progresiva y fatiga fácil, pérdida de apetito debido a náuseas y vómitos, atrofia muscular , temblores, función mental anormal, respiración superficial frecuente y acidosis metabólica . Sin intervención mediante diálisis o trasplante de riñón, la uremia debido a insuficiencia renal progresará y causará estupor , coma y muerte. [2] Debido a que la uremia es principalmente una consecuencia de la insuficiencia renal, sus signos y síntomas a menudo ocurren concomitantemente con otros signos y síntomas de insuficiencia renal. [ cita requerida ]
La tasa de filtración glomerular (TFG) mide la cantidad de plasma en mililitros que se filtra a través de los riñones cada minuto. A medida que la TFG disminuye, el pronóstico empeora. Algunos de los efectos pueden revertirse, aunque sea temporalmente, con diálisis. [ cita requerida ]
Las personas en diálisis adquieren lo que se conoce como "síndrome residual". [5] El síndrome residual es una enfermedad que no pone en peligro la vida y que se manifiesta como efectos tóxicos que causan muchos de los mismos signos y síntomas que presenta la uremia. Hay varias hipótesis sobre por qué está presente el síndrome residual. Son: la acumulación de solutos de gran peso molecular que están mal dializados (p. ej., β 2 -microglobulina ); la acumulación de solutos de pequeño peso molecular unidos a proteínas que están mal dializados (p. ej., p-cresulfato y indoxil sulfato ); la acumulación de solutos dializables que se eliminan de forma incompleta (p. ej., solutos secuestrados como el fosfato en las células o eliminación insuficiente de otros solutos más tóxicos); fenómenos indirectos como la carbamilación de proteínas, la calcificación tisular o un efecto tóxico del desequilibrio hormonal (p. ej., la hormona paratiroidea ) y; los efectos tóxicos de la diálisis en sí (p. ej., eliminación de vitaminas o minerales importantes desconocidos). [5] [6] La diálisis aumenta la esperanza de vida, pero los pacientes pueden tener una función más limitada. Tienen limitaciones físicas que incluyen deterioro del equilibrio, la velocidad de la marcha y las funciones sensoriales. También tienen deterioro cognitivo como deterioro de la atención, la memoria y el desempeño de tareas de orden superior. [3] Los pacientes han sido mantenidos más de tres décadas en diálisis, pero las tasas de mortalidad y hospitalizaciones promedio son altas. Además, la rehabilitación y la calidad de vida de los pacientes son deficientes. [3] [5]
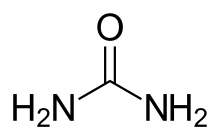
Las afecciones que provocan un aumento de la urea en sangre se dividen en tres categorías diferentes: prerrenales, renales y posrenales. [ cita requerida ]
La azotemia prerrenal puede ser causada por una disminución del flujo sanguíneo a través de los riñones (por ejemplo, presión arterial baja , insuficiencia cardíaca congestiva , shock , sangrado , deshidratación ) o por una mayor producción de urea en el hígado a través de una dieta alta en proteínas o un mayor catabolismo proteico (por ejemplo, estrés, fiebre, enfermedad grave, terapia con corticosteroides o sangrado gastrointestinal). [1]
Las causas renales pueden atribuirse a una disminución de la función renal. Entre ellas se encuentran la insuficiencia renal aguda y crónica , la glomerulonefritis aguda y crónica , la necrosis tubular y otras enfermedades renales . [1]
Las causas posrenales pueden deberse a una disminución en la eliminación de urea. Estas pueden deberse a una obstrucción del flujo urinario, como por cálculos, tumores de vejiga o próstata, o una infección grave. [1]
Una historia clínica y un examen físico detallados y precisos ayudarán a determinar si la uremia es aguda o crónica . En los casos de uremia aguda, se pueden identificar y eliminar las causas, lo que aumenta la probabilidad de recuperación de la función renal normal si se trata correctamente. [7]
Las pruebas primarias que se realizan para el diagnóstico de uremia son un panel metabólico básico con calcio y fósforo séricos para evaluar el GFR , el nitrógeno ureico en sangre y la creatinina, así como los niveles séricos de potasio , fosfato , calcio y sodio . La principal anomalía es un GFR muy bajo (<30 ml/min). La uremia mostrará elevación tanto de urea como de creatinina, potasio probablemente elevado, fosfato alto y sodio normal o ligeramente alto, así como niveles de calcio probablemente deprimidos. Como evaluación básica, un médico también evaluará la anemia y las funciones tiroidea y paratiroidea . La anemia crónica puede ser un signo ominoso de insuficiencia renal establecida. Los paneles tiroideos y paratiroideos ayudarán a evaluar cualquier síntoma de fatiga, así como a determinar las anomalías del calcio en relación con la uremia frente a una enfermedad prolongada o no relacionada del metabolismo del calcio. [ cita requerida ]
Una alternativa puede ser la recolección de orina de 24 horas para determinar el aclaramiento de creatinina, aunque no es una prueba muy precisa debido al procedimiento de recolección. Otra prueba de laboratorio que se debe considerar es el análisis de orina con examen microscópico para detectar la presencia de proteínas, cilindros, sangre y pH . [7]
La prueba más fiable para determinar la TFG es el aclaramiento de iotalamato . Sin embargo, puede resultar prohibitivamente costosa y requerir mucho tiempo. Los laboratorios clínicos generalmente calculan la TFG con la fórmula de modificación de la dieta en la enfermedad renal (MDRD) o la fórmula de Cockcroft-Gault . [7]
Además, los estudios de coagulación pueden indicar un tiempo de sangrado prolongado con valores por lo demás normales. [ cita requerida ]
La uremia hace que el cuerpo retenga muchos compuestos diferentes. Si los riñones no funcionan correctamente, estos compuestos pueden acumularse hasta alcanzar niveles peligrosos. Se han identificado más de 90 compuestos diferentes. Algunos de ellos pueden ser tóxicos para el organismo. [ cita requerida ]
Las toxinas urémicas son compuestos biológicamente activos que se retienen debido a una insuficiencia renal. [4] Muchas sales urémicas también pueden ser toxinas urémicas. [ cita requerida ]
La urea fue uno de los primeros metabolitos identificados. Su eliminación está directamente relacionada con la supervivencia del paciente, pero su efecto sobre el cuerpo aún no está claro. Sin embargo, no es seguro que los síntomas actualmente asociados con la uremia sean realmente causados por el exceso de urea, ya que un estudio mostró que los síntomas urémicos se aliviaron al iniciar la diálisis, incluso cuando se agregó urea al dializado para mantener el nivel de nitrógeno ureico en sangre en aproximadamente 90 mg por decilitro (es decir, aproximadamente 32 mmol por litro). [3] La urea podría ser el precursor de moléculas más tóxicas, pero es más probable que el daño causado al cuerpo se deba a una combinación de diferentes compuestos que pueden actuar como inhibidores enzimáticos o alterar el transporte de membrana . [2] El sulfato de indoxilo es una de las toxinas urémicas mejor caracterizadas. Se ha demostrado que el sulfato de indoxilo agrava la inflamación vascular en la aterosclerosis al modular el comportamiento de los macrófagos . [8] [9]
Muchas funciones reguladoras del cuerpo se ven afectadas. La regulación de los líquidos corporales, la retención de sal, la excreción de ácidos y metabolitos nitrogenados se ven afectadas y pueden fluctuar ampliamente. La regulación de los líquidos corporales se ve afectada debido a la falta de excreción de líquidos o debido a la pérdida de líquidos por vómitos o diarrea. La regulación de la sal se ve afectada cuando la ingesta de sal es baja o el volumen vascular es inadecuado. La excreción de ácidos y metabolitos nitrogenados se ve afectada con la pérdida de la función renal. [2]
La urea se cristalizó e identificó entre 1797 y 1808. [11] Se planteó la hipótesis de que la urea era la fuente de amoníaco urinario durante esta época y se confirmó en 1817. Se planteó la hipótesis de que el exceso de urea podía provocar trastornos específicos. Más tarde, en 1821, se confirmó que el cuerpo producía urea y que se excretaba por los riñones. [11] En 1827, la urea se sintetizó por primera vez en el laboratorio, lo que confirmó la composición de la urea y la convirtió en la primera sustancia biológica sintetizada. En 1856, la urea se produjo in vitro mediante la oxidación de proteínas. Fue en 1827 cuando Henri Dutrochet sembró la idea de la diálisis con el descubrimiento de separar moléculas más pequeñas de moléculas más grandes a través de una membrana semipermeable. [11] Fue en 1829 y 1831 cuando se obtuvieron pruebas convincentes de que en ciertos pacientes, la urea en sangre estaba elevada. También sugirieron que esto podía causar daños. Investigaciones posteriores sugirieron que los trastornos neurológicos importantes, como el coma y las convulsiones, no se correlacionaban con los hallazgos físicos, que incluían un edema generalizado del cerebro. Esto sugirió que la uremia era una forma de envenenamiento de la sangre. [11] En 1851, ET Frerich describió el síndrome urémico clínico y sugirió que una toxicidad era el mecanismo de su causa. Fue en 1856 cuando J. Picard desarrolló un método sensible para medir de forma reproducible la urea en sangre. Pudo detectar una disminución del 40% de la concentración de urea entre la arteria renal y la vena renal. Este trabajo solidificó el hecho de que la insuficiencia renal coincidía con un aumento de la urea en sangre. Fue J. Picard junto con el trabajo de ET Frerich lo que popularizó el término uremia . [11]
Los síntomas orales de uremia se pueden encontrar en hasta el 90% de los pacientes renales. Los pacientes pueden presentar sabor y olor a amoníaco en la boca, estomatitis , gingivitis , disminución del flujo salival, xerostomía y parotiditis. [12]
Uno de los primeros síntomas de la insuficiencia renal es el hedor urémico . Es un olor a amoníaco en la boca causado por la alta concentración de urea en la saliva que posteriormente se descompone en amoníaco. [12] A medida que aumenta el nivel de nitrógeno ureico en sangre (BUN), el paciente puede desarrollar estomatitis urémica. La estomatitis urémica aparece como una pseudomembrana o ulceraciones francas con enrojecimiento y una capa pultácea en la boca. Estas lesiones podrían estar relacionadas con un nivel alto de BUN >150 mg/dl y desaparecer espontáneamente cuando el nivel de BUN se reduce con tratamiento médico. Se cree que es causado por la pérdida de resistencia tisular y la incapacidad de soportar influencias traumáticas. [12] Además de eso, el paciente puede desarrollar una manifestación rara que es el escarcha urémica . Es una placa blanca que se encuentra en la piel o en la boca, es causada por cristales de urea residuales que quedan en la superficie epitelial después de la transpiración y la evaporación de la saliva o como resultado de un flujo salival reducido. [12] La xerostomía es un hallazgo oral común, que resulta de una combinación de afectación directa de las glándulas salivales, inflamación química, deshidratación y respiración bucal. [12] Puede deberse a una ingesta restringida de líquidos, un efecto adverso de la terapia farmacológica o una baja tasa de salivación. [13] A veces se puede observar hinchazón salival. [12]
En pacientes con enfermedad renal, a veces se puede notar palidez de la mucosa oral debido a la anemia causada por la reducción de la eritropoyetina. La uremia puede conducir a una alteración de la agregación plaquetaria. Esta situación, combinada con el uso de heparina y otros anticoagulantes en hemodiálisis, hace que los pacientes se vuelvan predispuestos a equimosis , petequias y hemorragias en la cavidad oral. [13] También puede conducir a mucositis y glositis que pueden provocar dolor e inflamación de la lengua y la mucosa oral. Además, los pacientes también pueden experimentar sensaciones gustativas alteradas, disgeusia y estar predispuestos a infecciones bacterianas y candidiasis. La candidiasis es más frecuente en pacientes con trasplante renal debido a la inmunosupresión generalizada. [13]
En niños con enfermedad renal, se ha observado hipoplasia del esmalte de la dentición primaria y permanente. Las anomalías del desarrollo dental se correlacionan con la edad en la que se producen las alteraciones metabólicas. Por ejemplo, la hipoplasia del esmalte en forma de decoloración blanca o marrón de los dientes primarios se observa comúnmente en niños pequeños con enfermedad renal de aparición temprana. [13] La mala higiene bucal, una dieta rica en carbohidratos, el debilitamiento relacionado con la enfermedad, el esmalte hipoplásico, la baja tasa de flujo salival y la medicación a largo plazo contribuyen a aumentar el riesgo de formación de caries . [13] Sin embargo, los pacientes suelen tener una baja actividad de caries, especialmente en los niños. [12] Esto se debe a la presencia de saliva altamente tamponada y alcalina causada por la alta concentración de nitrógeno ureico y fosfato en la saliva. El pH salival generalmente estará por encima del nivel de pH crítico para que se produzca la desmineralización del esmalte y esto ayuda a prevenir la formación de caries. [13] Además de eso, el estrechamiento pulpar y las calcificaciones son un hallazgo frecuente en pacientes con enfermedad renal. [13] En los pacientes que reciben diálisis, las náuseas y los vómitos resultantes del tratamiento de diálisis pueden provocar una erosión dental grave . [12]
En el tratamiento de pacientes con insuficiencia renal, el odontólogo debe recopilar una historia clínica completa, prestando especial atención a las enfermedades relacionadas con la enfermedad renal en etapa terminal, los fármacos con las dosis prescritas, los parámetros sanguíneos, el momento y el tipo de diálisis realizada. [14] Estos aspectos se pueden discutir directamente con el nefrólogo cuando sea necesario. Cualquier modificación de los fármacos u otros aspectos del tratamiento debe ser previamente acordada con el nefrólogo. [15]
El examen dental de estos pacientes consiste en una evaluación completa no invasiva de los tejidos dentales, periodontales y mucosos, con radiografías para ayudar en el proceso de diagnóstico. Se deben interceptar todos los focos potenciales de infección; estos incluyen lesiones periodontales y endodónticas, raíces residuales, terceros molares parcialmente erupcionados y mal posicionados, periimplantitis y lesiones mucosas. Cuando se sospecha periodontitis, se debe registrar un cuadro periodontal. Los aparatos de ortodoncia se pueden mantener si no interfieren con la higiene bucal. [14]
La uremia es una enfermedad frecuente en pacientes sometidos a diálisis por insuficiencia renal. En el caso de los pacientes sometidos a hemodiálisis, es importante determinar el programa de tratamiento. El tratamiento dental debe iniciarse al día siguiente de la hemodiálisis por varias razones: no hay acumulación de toxinas urémicas en la sangre y no hay heparina circulante. El tratamiento no debe iniciarse el mismo día de la hemodiálisis, ya que los pacientes suelen sentirse mal y su sangre está heparinizada, lo que puede provocar un sangrado excesivo. En el caso de los pacientes sometidos a diálisis peritoneal, no existen contraindicaciones para el tratamiento dental, excepto en casos de infecciones peritoneales agudas, en cuyo caso se debe posponer el procedimiento electivo. [12] [15]
Se debe tener especial cuidado al posicionar al paciente, evitando la compresión del brazo con el acceso vascular para hemodiálisis. No se deben realizar inyecciones ni mediciones de presión arterial en un brazo con una fístula arteriovenosa (AV). Si el sitio de la AV está ubicado en una pierna, el paciente debe evitar sentarse durante períodos prolongados, ya que el drenaje venoso puede obstruirse. Durante procedimientos dentales largos, el dentista debe permitir que los pacientes con sitios de AV en las piernas caminen brevemente o permanezcan de pie por un rato cada hora. [ cita requerida ]
En caso de sangrado excesivo, que se observa con frecuencia en la uremia y la insuficiencia renal, se deben utilizar agentes hemostáticos locales y técnicas de cierre primario para controlar el sangrado posoperatorio. Para reducir el sangrado durante y después de un procedimiento, se puede utilizar ácido tranexámico, tanto en forma de enjuague como por vía oral. [12] [15]
Los pacientes sometidos a diálisis están expuestos a numerosas transfusiones y a una inmunosupresión relacionada con la insuficiencia renal, por lo que tienen un mayor riesgo de infección por el virus de la inmunodeficiencia humana (VIH) y los virus de la hepatitis B y C. Es importante adoptar medidas de control de infecciones para evitar la contaminación cruzada en la clínica dental y prevenir el riesgo de exposición del personal dental. [15]
La mayoría de los medicamentos se eliminan del cuerpo al menos parcialmente por el riñón. Debido a la insuficiencia renal, las semividas plasmáticas de los fármacos que normalmente se excretan en la orina se prolongarán, lo que dará lugar a un aumento de la toxicidad. Muchos fármacos que normalmente se administran de forma segura no pueden administrarse a pacientes con función renal reducida. Además, algunos fármacos pueden administrarse, pero la dosis debe reducirse. Sin embargo, en pacientes sometidos a diálisis, se observará una reducción de las semividas plasmáticas de los fármacos. [12] Los antibióticos de las familias de los aminoglucósidos y las tetraciclinas deben evitarse debido a sus nefrotoxicidades. Los antibióticos de elección son las penicilinas, la clindamicina y las cefalosporinas, que pueden administrarse a dosis normales incluso si se amplía el rango terapéutico. [15] Para los analgésicos, el paracetamol es la opción de elección para los casos de dolor episódico. La aspirina se caracteriza por una actividad antiplaquetaria y, por lo tanto, su uso debe evitarse en pacientes urémicos. [15] El desafío en la farmacoterapia para pacientes con enfermedad renal es mantener el nivel terapéutico de un medicamento dentro de un rango estrecho para evitar dosis subterapéuticas y toxicidad. [12]