La estenosis aórtica ( EA o EAo ) es el estrechamiento de la salida del ventrículo izquierdo del corazón (donde comienza la aorta ), de modo que surgen problemas. [1] Puede ocurrir en la válvula aórtica , así como por encima y por debajo de este nivel. [1] Por lo general, empeora con el tiempo. [1] Los síntomas suelen aparecer de forma gradual y, a menudo, primero se produce una disminución de la capacidad para hacer ejercicio. [1] Si se produce insuficiencia cardíaca , pérdida de conciencia o dolor en el pecho relacionado con el corazón debido a la EA, los resultados son peores. [1] La pérdida de conciencia suele producirse al estar de pie o al hacer ejercicio. [1] Los signos de insuficiencia cardíaca incluyen dificultad para respirar, especialmente al acostarse , por la noche o al hacer ejercicio, e hinchazón de las piernas . [1] El engrosamiento de la válvula sin causar obstrucción se conoce como esclerosis aórtica . [1]
Las causas incluyen haber nacido con una válvula aórtica bicúspide y fiebre reumática ; una válvula normal también puede endurecerse con el paso de las décadas debido a la calcificación . [2] [1] Una válvula aórtica bicúspide afecta a aproximadamente el uno o dos por ciento de la población. [1] A partir de 2014, la enfermedad cardíaca reumática ocurre principalmente en el mundo en desarrollo . [1] Los factores de riesgo son similares a los de la enfermedad de la arteria coronaria e incluyen fumar , presión arterial alta , colesterol alto , diabetes y ser hombre. [1] La válvula aórtica generalmente tiene tres valvas y está ubicada entre el ventrículo izquierdo del corazón y la aorta. [1] La EA generalmente produce un soplo cardíaco . [1] Su gravedad se puede dividir en leve, moderada, grave y muy grave, distinguible mediante una ecografía del corazón . [1]
La estenosis aórtica suele controlarse mediante ecografías repetidas. [1] Una vez que se ha vuelto grave, el tratamiento consiste principalmente en una cirugía de reemplazo valvular , siendo el reemplazo valvular aórtico transcatéter (TAVR) una opción en algunos pacientes con alto riesgo de cirugía. [1] Las válvulas pueden ser mecánicas o bioprotésicas , y cada una tiene riesgos y beneficios. [1] Otro procedimiento menos invasivo, la valvuloplastia aórtica con balón (BAV), puede resultar beneficioso, pero solo durante unos meses. [1] Las complicaciones como la insuficiencia cardíaca pueden tratarse de la misma manera que en aquellos con EA leve a moderada. [1] En aquellos con enfermedad grave, se deben evitar varios medicamentos, incluidos los inhibidores de la ECA , la nitroglicerina y algunos betabloqueantes . [1] Se puede utilizar nitroprusiato o fenilefrina en aquellos con insuficiencia cardíaca descompensada dependiendo de la presión arterial. [1] [3]
La estenosis aórtica es la enfermedad cardíaca valvular más común en el mundo desarrollado . [4] Afecta a aproximadamente el 2% de las personas mayores de 65 años. [1] Las tasas estimadas no se conocían en la mayor parte del mundo en desarrollo en 2014. [5] En aquellos que tienen síntomas, sin reparación, la probabilidad de muerte a los cinco años es de aproximadamente el 50% y a los 10 años es de aproximadamente el 90%. [1] La estenosis aórtica fue descrita por primera vez por el médico francés Lazare Rivière en 1663. [6]
Los síntomas relacionados con la estenosis aórtica dependen del grado de estenosis. La mayoría de las personas con estenosis aórtica leve a moderada no presentan síntomas. Los síntomas suelen presentarse en personas con estenosis aórtica grave, aunque también pueden ocurrir en aquellas con estenosis aórtica leve a moderada. Los tres síntomas principales de la estenosis aórtica son pérdida de conciencia , dolor torácico anginoso y falta de aire con la actividad u otros síntomas de insuficiencia cardíaca como falta de aire al estar acostado , episodios de falta de aire por la noche o piernas y pies hinchados . [4] [7] También puede ir acompañada del aspecto característico de " porcelana de Dresde " de palidez con un ligero rubor . [8] [ aclaración necesaria ]
La angina de pecho en el contexto de una insuficiencia cardíaca también aumenta el riesgo de muerte. En las personas con angina de pecho, la tasa de mortalidad a los 5 años es del 50% si no se reemplaza la válvula aórtica. [9]
La angina en el contexto de la EA se produce debido a la hipertrofia ventricular izquierda (HVI), que es causada por la producción constante de mayor presión necesaria para superar el gradiente de presión causado por la EA. Mientras que la capa muscular del ventrículo izquierdo se engrosa, las arterias que irrigan el músculo no se hacen significativamente más largas o más grandes, por lo que el músculo puede no recibir suficiente suministro de sangre para satisfacer sus necesidades de oxígeno. Esta isquemia puede ser evidente por primera vez durante el ejercicio cuando el músculo cardíaco requiere un mayor suministro de sangre para compensar el aumento de la carga de trabajo. El individuo puede quejarse de dolor torácico anginoso con el esfuerzo. La prueba de esfuerzo con o sin imágenes está estrictamente contraindicada en pacientes sintomáticos con estenosis aórtica grave. La prueba de esfuerzo con ejercicio ahora se recomienda en las pautas actuales en pacientes asintomáticos y puede proporcionar un valor pronóstico incremental. [10]
Sin embargo, con el tiempo, el músculo cardíaco requerirá más aporte sanguíneo en reposo del que pueden suministrar las ramas de la arteria coronaria . En este punto, puede haber signos de patrón de tensión ventricular (depresión del segmento ST e inversión de la onda T) en el ECG , lo que sugiere isquemia subendocárdica. El subendocardio es la región más susceptible a la isquemia porque es la más distante de las arterias coronarias epicárdicas. [11]
El síncope (desmayo) por estenosis de la válvula aórtica suele ser consecuencia del esfuerzo. [4] [12] En el contexto de insuficiencia cardíaca, aumenta el riesgo de muerte. En las personas con síncope, la tasa de mortalidad a los tres años es del 50 % si no se reemplaza la válvula aórtica. [13]
No está claro por qué la estenosis aórtica causa síncope. Una teoría es que la EA grave produce un gasto cardíaco casi fijo . [14] Cuando una persona con estenosis aórtica hace ejercicio, su resistencia vascular periférica disminuirá a medida que los vasos sanguíneos de los músculos esqueléticos se dilatan para permitir que los músculos reciban más sangre y puedan hacer más trabajo. Esta disminución de la resistencia vascular periférica normalmente se compensa con un aumento del gasto cardíaco. Dado que las personas con EA grave no pueden aumentar su gasto cardíaco, la presión arterial disminuye y la persona se desmaya debido a la disminución de la perfusión sanguínea al cerebro . [15]
Una segunda teoría es que durante el ejercicio las altas presiones generadas en el ventrículo izquierdo hipertrofiado causan una respuesta vasodepresora, que causa una vasodilatación periférica secundaria que, a su vez, causa una disminución del flujo sanguíneo al cerebro, lo que resulta en pérdida de conciencia. De hecho, en la estenosis aórtica, debido a la obstrucción fija del flujo sanguíneo que sale del corazón, puede ser imposible para el corazón aumentar su gasto para compensar la vasodilatación periférica. [ cita requerida ]
A veces puede intervenir un tercer mecanismo. Debido a la hipertrofia del ventrículo izquierdo en la estenosis aórtica, incluida la consiguiente incapacidad de las arterias coronarias para suministrar sangre de manera adecuada al miocardio (véase "Angina" más adelante), pueden desarrollarse ritmos cardíacos anormales que pueden provocar síncope. [16]
Por último, al menos en la estenosis aórtica calcificada [17] [18] , la calcificación en la válvula aórtica y alrededor de ella puede progresar y extenderse hasta afectar el sistema de conducción eléctrica del corazón . Si eso ocurre, el resultado puede ser un bloqueo cardíaco , una afección potencialmente letal de la cual el síncope puede ser un síntoma. [ cita requerida ]
La insuficiencia cardíaca congestiva (ICC) conlleva un pronóstico grave en las personas con EA. Las personas con ICC atribuible a EA tienen una tasa de mortalidad a los 2 años del 50 % si no se reemplaza la válvula aórtica. [ cita requerida ] La ICC en el contexto de EA se debe a una combinación de hipertrofia ventricular izquierda con fibrosis, disfunción sistólica (una disminución de la fracción de eyección ) y disfunción diastólica (presión de llenado elevada del VI). [4]
En el síndrome de Heyde , la estenosis aórtica se asocia con sangrado gastrointestinal debido a angiodisplasia del colon . [19] Investigaciones recientes han demostrado que la estenosis causa una forma de enfermedad de von Willebrand al descomponer su factor de coagulación asociado (antígeno asociado al factor VIII , también llamado factor de von Willebrand ), [20] debido al aumento de la turbulencia alrededor de la válvula estenótica.
No obstante lo anterior [ aclaración necesaria ] , la Asociación Estadounidense del Corazón cambió sus recomendaciones con respecto a la profilaxis antibiótica para la endocarditis . En concreto, a partir de 2007 se recomienda que dicha profilaxis se limite únicamente a aquellos con válvulas cardíacas protésicas, aquellos con episodios previos de endocarditis y aquellos con ciertos tipos de cardiopatía congénita. [21]
Dado que la válvula aórtica estenosada puede limitar el gasto cardíaco, las personas con estenosis aórtica corren el riesgo de sufrir síncope y presión arterial peligrosamente baja si utilizan cualquiera de los numerosos medicamentos para enfermedades cardiovasculares que a menudo coexisten con la estenosis aórtica. Algunos ejemplos son la nitroglicerina , los nitratos , los inhibidores de la ECA , la terazosina (Hytrin) y la hidralazina . Tenga en cuenta que todas estas sustancias provocan vasodilatación periférica . En circunstancias normales, en ausencia de estenosis aórtica, el corazón puede aumentar su gasto y, por lo tanto, compensar el efecto de los vasos sanguíneos dilatados. Sin embargo, en algunos casos de estenosis aórtica, debido a la obstrucción del flujo sanguíneo que sale del corazón causada por la válvula aórtica estenosada, el gasto cardíaco no se puede aumentar. Puede producirse presión arterial baja o síncope. [ cita requerida ]

La estenosis aórtica es causada con mayor frecuencia por una enfermedad valvular aórtica calcificada progresiva relacionada con la edad (CAVD) (>50% de los casos), con una edad media de 65 a 70 años. CAVD es la acumulación de calcio en las cúspides de la válvula, y esta calcificación causa endurecimiento y estenosis de la válvula. [22] Otra causa importante de estenosis aórtica es la calcificación de una válvula aórtica bicúspide congénita o, más raramente, una válvula aórtica unicúspide congénita. Aquellos con válvulas aórticas unicúspides generalmente necesitan intervención cuando son muy jóvenes, a menudo como recién nacidos. Mientras que aquellos con válvula aórtica bicúspide congénita representan el 30-40% de los que se presentan durante la edad adulta [23] y generalmente se presentan antes (edades 40+ a 50+) que aquellos con válvulas aórticas tricúspides (65+). [7]
La fiebre reumática aguda postinflamatoria es la causa de menos del 10% de los casos. [24] Las causas raras de estenosis aórtica incluyen la enfermedad de Fabry , el lupus eritematoso sistémico , la enfermedad de Paget , los niveles altos de ácido úrico en sangre y la infección . [25]

La válvula aórtica humana normalmente consta de tres cúspides o valvas y tiene una abertura de 3,0-4,0 centímetros cuadrados. [6] [25] Cuando el ventrículo izquierdo se contrae, fuerza la sangre a través de la válvula hacia la aorta y posteriormente al resto del cuerpo. Cuando el ventrículo izquierdo se expande de nuevo, la válvula aórtica se cierra y evita que la sangre de la aorta fluya hacia atrás ( regurgitación ) hacia el ventrículo izquierdo. En la estenosis aórtica, la abertura de la válvula aórtica se estrecha o se constriñe ( estenótica ) (p. ej., debido a la calcificación). La estenosis aórtica degenerativa (la variedad más común) y bicúspide comienzan con daño a las células endoteliales por aumento del estrés mecánico. [7] [25] Se cree que la inflamación está involucrada en las primeras etapas de la patogénesis de la EA y se sabe que sus factores de riesgo asociados promueven la deposición de colesterol LDL y lipoproteína (a) , una sustancia altamente dañina, en la válvula aórtica, causando daño significativo y estenosis con el tiempo. [7] [25] Se produce la infiltración de células inflamatorias (macrófagos, linfocitos T), seguida de la liberación de mediadores inflamatorios como la interleucina-1-beta y el factor de crecimiento transformante beta-1. Posteriormente, los fibroblastos se diferencian en células similares a osteoblastos, lo que da como resultado un depósito anormal de matriz ósea que conduce a calcificación valvular progresiva y estenosis. [26]
Como consecuencia de esta estenosis, el ventrículo izquierdo debe generar una mayor presión con cada contracción para mover eficazmente la sangre hacia la aorta. [4] [27] Inicialmente, el VI genera esta mayor presión engrosando sus paredes musculares (hipertrofia miocárdica). El tipo de hipertrofia que se observa con más frecuencia en la EA se conoce como hipertrofia concéntrica, [4] en la que las paredes del VI están (aproximadamente) igualmente engrosadas.
En las etapas posteriores, el ventrículo izquierdo se dilata, la pared se adelgaza y la función sistólica se deteriora (lo que da como resultado una capacidad reducida para bombear sangre hacia adelante). Morris e Innasimuthu et al. demostraron que una anatomía coronaria diferente está asociada con diferentes enfermedades valvulares. En 2010, se estaba realizando una investigación para ver si una anatomía coronaria diferente podría conducir a un flujo turbulento a nivel de las válvulas que conduce a inflamación y degeneración. [28] [29] [30]
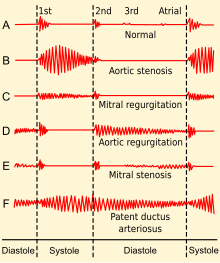

La estenosis aórtica se diagnostica con mayor frecuencia cuando es asintomática y, a veces, se puede detectar durante un examen de rutina del corazón y el sistema circulatorio. Existe buena evidencia que demuestra que ciertas características del pulso periférico pueden determinar el diagnóstico. [31] En particular, puede haber un ascenso lento y/o sostenido del pulso arterial, y el pulso puede ser de bajo volumen. Esto a veces se denomina pulsus parvus et tardus . [12] [24] También puede haber un retraso notable entre el primer ruido cardíaco (en la auscultación ) y el pulso correspondiente en la arteria carótida ("retraso apical-carotídeo"). De manera similar, puede haber un retraso entre la aparición de cada pulso en la arteria braquial (en el brazo) y la arteria radial (en la muñeca). [ cita requerida ]
El primer ruido cardíaco puede ir seguido de un sonido agudo de eyección ("clic de eyección") que se escucha mejor en el borde esternal inferior izquierdo y en el ápex y, por lo tanto, parece estar "dividido". El sonido de eyección, causado por el impacto del flujo de salida del ventrículo izquierdo contra las valvas de la válvula aórtica parcialmente fusionadas, se asocia más comúnmente con una válvula aórtica bicúspide móvil que con una válvula aórtica calcificada inmóvil. La intensidad de este sonido no varía con la respiración, lo que ayuda a distinguirlo del clic de eyección producido por una válvula pulmonar estenótica, que disminuirá ligeramente en intensidad durante la inspiración. [32]
Un soplo sistólico crescendo-decrescendo (es decir, 'eyección') fácilmente audible se escucha más fuerte en el borde esternal superior derecho, en el segundo espacio intercostal derecho , [24] y se irradia a las arterias carótidas bilateralmente. [4] [12] El soplo aumenta con la posición en cuclillas y disminuye con la posición de pie y la contracción muscular isométrica como la maniobra de Valsalva , que ayuda a distinguirlo de la miocardiopatía hipertrófica obstructiva (MCHO). El soplo es más fuerte durante la espiración, pero también se escucha fácilmente durante la inspiración. Cuanto más grave sea el grado de estenosis, más tarde se produce el pico en el crescendo-decrescendo del soplo. [33]
El segundo ruido cardíaco ( A2 ) tiende a disminuir y volverse más suave a medida que la estenosis aórtica se vuelve más grave. [24] Esto es el resultado de la calcificación creciente de la válvula que evita que se cierre de golpe y produzca un sonido agudo y fuerte. Debido al aumento de la presión ventricular izquierda de la válvula aórtica estenótica, con el tiempo el ventrículo puede hipertrofiarse, lo que resulta en disfunción diastólica. Como resultado, puede haber un cuarto ruido cardíaco debido al ventrículo rígido. [12] Con aumentos continuos de la presión ventricular, se producirá dilatación del ventrículo y puede manifestarse un tercer ruido cardíaco. [34]
Por último, la estenosis aórtica suele coexistir con algún grado de insuficiencia aórtica ( regurgitación aórtica ). Por lo tanto, el examen físico en la estenosis aórtica también puede revelar signos de esta última, por ejemplo, un soplo diastólico decreciente temprano. De hecho, cuando están presentes ambas anomalías valvulares, los hallazgos esperados de cualquiera de ellas pueden modificarse o incluso pueden no estar presentes. En cambio, surgen nuevos signos que reflejan la presencia de estenosis e insuficiencia aórticas simultáneas, por ejemplo, pulso bisferiens . [ cita requerida ]
Según un metanálisis , los hallazgos más útiles para diagnosticar estenosis aórtica en el ámbito clínico fueron la lenta tasa de ascenso del pulso carotídeo (el cociente de probabilidad positivo varió entre 2,8 y 130 en los estudios), la intensidad máxima media a tardía del soplo (cociente de probabilidad positivo, 8,0-101) y la disminución de la intensidad del segundo ruido cardíaco (cociente de probabilidad positivo, 3,1-50). [31]
Otros signos periféricos incluyen: [ cita requerida ]
En el caso de estenosis valvular aórtica grave asintomática, las directrices europeas [35] recomiendan mediciones del péptido natriurético tipo B ( BNP ) para ayudar a la estratificación del riesgo y optimizar el momento de la cirugía de reemplazo valvular aórtico . [36] [37] En pacientes con estenosis valvular aórtica asintomática no grave, se ha descubierto que el aumento de los niveles de péptido natriurético cerebral N-terminal ( NT-proBNP ) ajustados por edad y sexo solos y combinados con un aumento del 50 % o más desde el valor inicial se asociaba con un aumento de las tasas de eventos relacionados con la estenosis valvular aórtica ( muerte cardiovascular , hospitalización por insuficiencia cardíaca debido a la progresión de la estenosis valvular aórtica o cirugía de reemplazo valvular aórtico ). [38] En pacientes con estenosis valvular aórtica asintomática no grave y sin enfermedad coronaria evidente, se encontró que el aumento de troponina T (por encima de 14 pg/mL) se asociaba con una mayor tasa de eventos cardíacos isquémicos a 5 años ( infarto de miocardio , intervención coronaria percutánea o cirugía de derivación de la arteria coronaria ). [39]
Aunque la estenosis aórtica no produce ningún hallazgo específico en el electrocardiograma (ECG), a menudo provoca una serie de anomalías electrocardiográficas. Las manifestaciones electrocardiográficas de hipertrofia ventricular izquierda (HVI) son comunes en la estenosis aórtica [7] [12] y surgen como resultado de que la estenosis haya colocado una carga de presión crónicamente alta en el ventrículo izquierdo (siendo la HVI la respuesta esperada a las cargas de presión crónicas en el ventrículo izquierdo sin importar cuál sea la causa). [40]
Como se señaló anteriormente, el proceso de calcificación que ocurre en la estenosis aórtica puede progresar hasta extenderse más allá de la válvula aórtica y entrar en el sistema de conducción eléctrica del corazón . La evidencia de este fenómeno puede incluir, en raras ocasiones, patrones de ECG característicos de ciertos tipos de bloqueo cardíaco, como el bloqueo de la rama izquierda del haz de His . [7]
El cateterismo de la cámara cardíaca proporciona un diagnóstico definitivo, indicando una estenosis grave en un área valvular de <1,0 cm2 ( normalmente alrededor de 3 cm2 ) . [41] Puede medir directamente la presión en ambos lados de la válvula aórtica. El gradiente de presión puede usarse como un punto de decisión para el tratamiento. Es útil en personas sintomáticas antes de la cirugía. [12] El estándar para el diagnóstico de la estenosis aórtica es la prueba no invasiva con ecocardiografía. El cateterismo cardíaco se reserva para los casos en los que existe una discrepancia entre el cuadro clínico y las pruebas no invasivas, debido a los riesgos inherentes al cruce de la válvula aórtica, como el accidente cerebrovascular. [7]
El ecocardiograma (ultrasonido del corazón) es la mejor forma no invasiva de evaluar la anatomía y la función de la válvula aórtica. [42]
El área de la válvula aórtica se puede calcular de forma no invasiva utilizando velocidades de flujo ecocardiográficas. Utilizando la velocidad de la sangre a través de la válvula, se puede calcular el gradiente de presión a través de la válvula mediante la ecuación de continuidad o utilizando la ecuación de Bernoulli modificada :
Gradiente = 4(velocidad)² mmHg
Una válvula aórtica normal tiene un gradiente de sólo unos pocos mmHg. Una disminución del área valvular provoca un aumento del gradiente de presión, y estos parámetros se utilizan para clasificar y calificar la estenosis aórtica como leve, moderada o grave. El gradiente de presión puede ser anormalmente bajo en presencia de estenosis mitral , insuficiencia cardíaca , insuficiencia aórtica coexistente y también cardiopatía isquémica (enfermedad relacionada con la disminución del suministro de sangre y oxígeno que causa isquemia). [43]
El ecocardiograma también puede mostrar hipertrofia ventricular izquierda, válvula aórtica engrosada e inmóvil y raíz aórtica dilatada. [12] Sin embargo, puede parecer engañosamente normal en casos agudos. [24]
Una radiografía de tórax también puede ayudar en el diagnóstico y proporcionar pistas sobre la gravedad de la enfermedad, mostrando el grado de calcificación de la válvula y, en una condición crónica , un ventrículo izquierdo agrandado [12] [24] y la aurícula. [12]
El uso de la puntuación de calcio por TC se está extendiendo como una herramienta diagnóstica para complementar la ecografía en la evaluación de pacientes con estenosis aórtica. [44] [45] La puntuación de calcio de la válvula aórtica mediante tomografía computarizada con múltiples detectores (TC-AVC) se utiliza para cuantificar el grado de calcificación de la válvula aórtica. [46] Según las Guías ESC/EACTS de 2021 para el tratamiento de la cardiopatía valvular, los umbrales recomendados que indican estenosis aórtica grave son > 1200 AU en mujeres y > 2000 AU en hombres. [47]
En general, no es necesario el tratamiento en personas asintomáticas. [12] En casos moderados, se realiza una ecocardiografía cada 1 a 2 años para controlar la progresión, posiblemente complementada con una prueba de esfuerzo cardíaco . [24] En casos graves, se realiza una ecocardiografía cada 3 a 6 meses. [24] Tanto en casos moderados como leves, la persona debe realizar una nueva visita de inmediato o ser admitida para recibir atención hospitalaria si aparece algún síntoma nuevo relacionado. [24] Actualmente no hay opciones terapéuticas disponibles para tratar a las personas con estenosis de la válvula aórtica; sin embargo, estudios en 2014 indicaron que la enfermedad se produce como resultado de procesos celulares activos, lo que sugiere que atacar estos procesos puede conducir a enfoques terapéuticos viables. [48]
Los estudios observacionales demostraron una asociación entre el colesterol reducido con estatinas y una menor progresión, pero un ensayo clínico aleatorizado publicado en 2005 no encontró ningún efecto sobre la estenosis aórtica calcificada. El efecto de las estatinas sobre la progresión de la EA no está claro. Un estudio de 2007 encontró una desaceleración de la estenosis aórtica con rosuvastatina . [7] [49] En 2013 se informó que los ensayos no mostraron ningún beneficio en la desaceleración de la progresión de la EA, [7] pero sí demostraron una disminución de los eventos cardiovasculares isquémicos. [4]
En general, la terapia médica tiene una eficacia relativamente baja en el tratamiento de la estenosis aórtica. [12] Sin embargo, puede ser útil para controlar afecciones coexistentes comunes que se correlacionan con la estenosis aórtica: [50]
La reparación o reconstrucción de la válvula aórtica describe la reconstrucción tanto de la forma como de la función de la válvula aórtica nativa y disfuncional. Se aplica con mayor frecuencia para el tratamiento de la insuficiencia aórtica. También puede ser necesaria para el tratamiento de un aneurisma aórtico, y con menor frecuencia para la estenosis aórtica congénita. [53]
En adultos, la estenosis aórtica grave sintomática generalmente requiere reemplazo valvular aórtico (AVR). [4] Si bien el AVR quirúrgico sigue siendo el tratamiento más eficaz para este proceso patológico y actualmente se recomienda para pacientes después de la aparición de los síntomas, a partir de 2016, [actualizar]los enfoques de reemplazo valvular aórtico incluyeron cirugía a corazón abierto, cirugía cardíaca mínimamente invasiva (MICS) y reemplazo valvular aórtico mínimamente invasivo basado en catéter (percutáneo). [54] [55] [56] Sin embargo, el reemplazo valvular aórtico quirúrgico está bien estudiado y generalmente tiene un pronóstico a largo plazo bueno y bien establecido. [57]
La mayoría de las veces, la válvula aórtica enferma se reemplaza mediante un procedimiento quirúrgico con una válvula mecánica o de tejido. El procedimiento se realiza mediante una cirugía a corazón abierto o, en un número menor pero creciente de casos, mediante un procedimiento de cirugía cardíaca mínimamente invasiva (MICS). [ cita requerida ] El abordaje mínimamente invasivo a través de una minitoracotomía derecha es más beneficioso en pacientes de alto riesgo, como los ancianos, los obesos, aquellos con enfermedad pulmonar obstructiva crónica, enfermedad renal crónica y aquellos que requieren una nueva cirugía. [58] [59]
A nivel mundial, más de 250.000 personas han recibido una intervención de válvula aórtica transcatéter (TAVI). Para las personas que no son candidatas a un reemplazo valvular quirúrgico y la mayoría de los pacientes mayores de 75 años, la TAVI puede ser una alternativa adecuada. [54] [55] Las anomalías de la conducción que requieren la implantación de un marcapasos permanente (MPP) siguen siendo un hallazgo común después de la TAVI debido a la proximidad del sistema de conducción auriculoventricular a la raíz aórtica. [60]
En el caso de los bebés y los niños, también puede ser eficaz la valvuloplastia con balón , en la que se infla un balón para estirar la válvula y permitir un mayor flujo. Sin embargo, en los adultos, por lo general no es eficaz, ya que la válvula tiende a volver a un estado estenosado. El cirujano realizará una pequeña incisión en la parte superior de la pierna de la persona y procederá a insertar el balón en la arteria. Luego, el balón se avanza hasta la válvula y se infla para estirarla y abrirla. [61]
La insuficiencia cardíaca aguda descompensada debido a EA se puede controlar temporalmente con un balón de contrapulsación intraaórtico mientras se realiza la cirugía. [62] En pacientes con presión arterial alta se puede utilizar con cuidado el nitroprusiato . [1] Se puede utilizar fenilefrina en pacientes con presión arterial muy baja. [3]
Si no se trata, la estenosis aórtica sintomática grave tiene un mal pronóstico, con una tasa de mortalidad a los 2 años del 50-60% y una tasa de supervivencia a los 3 años de menos del 30%. [63] El pronóstico después del reemplazo de la válvula aórtica para las personas menores de 65 años es aproximadamente cinco años menor que el de la población general; para las personas mayores de 65 años es aproximadamente el mismo. [57]
Aproximadamente el 2% de las personas mayores de 65 años, el 3% de las personas mayores de 75 años [4] y el 4% de las personas mayores de 85 años tienen estenosis de la válvula aórtica. [64] La prevalencia está aumentando con el envejecimiento de la población en América del Norte y Europa. [65]
Los factores de riesgo que se sabe que influyen en la progresión de la enfermedad de EA incluyen factores similares a los de la enfermedad de la arteria coronaria , como hipertensión, edad avanzada, ser hombre, hiperlipidemia , diabetes mellitus , tabaquismo, síndrome metabólico y enfermedad renal terminal . [4] [7] [25]
La estenosis aórtica fue descrita por primera vez por el médico francés Lazare Rivière en 1663. [6]
En un estudio de 2010 se descubrió que las personas que tomaban bifosfonatos tenían una menor progresión de la estenosis aórtica y algunas retrocedieron. [66] [67] Este hallazgo condujo a múltiples ensayos, que se estaban llevando a cabo en 2012. [actualizar]Las investigaciones posteriores no pudieron confirmar el resultado positivo inicial. [68]
{{cite journal}}: CS1 maint: nombres numéricos: lista de autores ( enlace )