Los tricotecenos son una gran familia de micotoxinas relacionadas químicamente . Son producidos por varias especies de Fusarium , Myrothecium , Trichoderma / Podostroma , Trichothecium , Cephalosporium , Verticimonosporium y Stachybotrys . Químicamente, los tricotecenos son una clase de sesquiterpenos .
Las características estructurales determinantes que causan la actividad biológica de los tricotecenos son el anillo 12,13-epoxi, la presencia de grupos hidroxilo o acetilo en posiciones apropiadas en el núcleo del tricoteceno y la estructura y posición de la cadena lateral. Se producen en muchos granos diferentes, como trigo, avena o maíz, por varias especies de Fusarium, incluidas F. graminearum , F. sporotrichioides , F. poae y F. equiseti .
Algunos mohos que producen micotoxinas tricotecenos, como Stachybotrys chartarum , pueden crecer en ambientes húmedos interiores. Se ha descubierto que los tricotecenos macrocíclicos producidos por S. chartarum pueden transmitirse por el aire y, por lo tanto, contribuir a problemas de salud en los seres humanos. [1] [2] Un hongo venenoso nativo de Japón y China , Podostroma cornu-damae , contiene seis tricotecenos, entre ellos satratoxina H , roridina E y verrucarina.

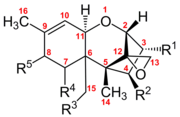
Los tricotecenos son un grupo de más de 150 micotoxinas químicamente relacionadas . [3] Cada tricoteceno muestra una estructura central que consiste en un solo anillo de seis miembros que contiene un solo átomo de oxígeno, flanqueado por dos anillos de carbono. [4] Esta estructura de anillo central contiene un epóxido , o éter tricíclico , en las posiciones de carbono 12,13, así como un doble enlace en las posiciones de carbono 9, 10. [5] Estos dos grupos funcionales son los principales responsables de la capacidad del tricoteceno para inhibir la síntesis de proteínas e incurrir en efectos citotóxicos generales. [6] Cabe destacar que esta estructura central es anfipática y contiene partes polares y no polares. [7] Todos los tricotecenos están relacionados a través de esta estructura común, pero cada uno de ellos también tiene un patrón de sustitución único de grupos funcionales que contienen oxígeno en los posibles sitios de los carbonos 3, 4, 7, 8 y 15. [5] Estos grupos funcionales gobiernan las propiedades de un tricoteceno individual y también sirven como base para el sistema de clasificación más comúnmente utilizado para esta familia de toxinas. Este sistema de clasificación divide la familia de los tricotecenos en cuatro grupos: Tipo A, B, C y D.
Los tricotecenos de tipo A tienen sustituciones de hidroxilo , éster o ningún grupo funcional alrededor de la estructura del anillo central. [4] Ejemplos comunes de estos son el neosolaniol con una sustitución de hidroxilo en el carbono 8 y la toxina T-2 con una sustitución de éster en el carbono 8.
Los tricotecenos de tipo B se clasifican por la presencia de grupos funcionales carbonilo sustituidos alrededor de la estructura del anillo central. [4] Ejemplos comunes de estos incluyen nivalenol y tricoteceno, que tienen un grupo funcional cetona en el carbono 8.
Los tricotecenos de tipo C tienen un grupo epóxido adicional en el carbono 7 y 8. [4] El ejemplo común de estos es la crotocina, que también tiene un grupo funcional éster en el carbono 4.
Los tricotecenos de tipo D tienen un anillo adicional entre el carbono 4 y el carbono 15. [4] Estos anillos pueden tener diversos grupos funcionales adicionales. Algunos ejemplos comunes de estos son la roridina A y la satratoxina H.
Aunque los distintos grupos funcionales de estos tipos de clasificación otorgan a cada tricoteceno propiedades químicas únicas, su tipo de clasificación no indica explícitamente su toxicidad relativa. [4] Si bien se cree que los tricotecenos de tipo D son los más tóxicos, los tipos A y B tienen una toxicidad relativamente mixta. [4]
El sistema de clasificación descrito anteriormente es el más comúnmente utilizado para agrupar moléculas de la familia de los tricotecenos. Sin embargo, también existe una variedad de sistemas de clasificación alternativos para estas moléculas complejas. Los tricotecenos también pueden describirse en general como simples o macrocíclicos. [6] Los tricotecenos simples incluyen los tipos A, B y C, mientras que los tricotecenos macrocíclicos incluyen el tipo D y se caracterizan por la presencia de un puente carbono 4 – carbono 15. Además, JF Grove propuso una clasificación de los tricotecenos en tres grupos que también se basaba en los patrones de sustitución funcional del esqueleto del anillo. [8] Los tricotecenos del grupo 1 solo tienen grupos funcionales sustituidos en el tercer anillo de carbono completamente saturado. [8] Los tricotecenos del grupo 2 contienen grupos funcionales adicionales en el anillo central que contiene el doble enlace de carbono 9, 10. [8] Finalmente, los tricotecenos del grupo 3 contienen un grupo funcional cetona en el carbono 8; este es el mismo criterio para los tricotecenos del tipo B. [8]
Los avances en el campo de la genética evolutiva también han llevado a la propuesta de sistemas de clasificación de tricotecenos basados en la vía de su biosíntesis. Los genes responsables de la biosíntesis de una micotoxina se encuentran típicamente en grupos; en Fusariumi estos se conocen como genes TRI. [9] Cada uno de los genes TRI es responsable de producir una enzima que lleva a cabo un paso específico en la biosíntesis de tricotecenos. Las mutaciones en estos genes pueden conducir a la producción de tricotecenos variantes y, por lo tanto, estas moléculas podrían agruparse sobre la base de pasos de biosíntesis compartidos. Por ejemplo, un paso compartido en la biosíntesis de tricotecenos está controlado por el gen TRI4 . [10] Este producto enzimático controla la adición de tres o cuatro oxígenos al tricodieno para formar isotricodiol o isotricotriol respectivamente. [10] Luego, se puede sintetizar una variedad de tricotecenos a partir de cualquiera de estos intermediarios y, por lo tanto, podrían clasificarse como de tipo t si se sintetizan a partir de isotricotriol o de tipo d si se sintetizan a partir de isotricodiol. [4]

La toxicidad de los tricotecenos es principalmente el resultado de su acción ampliamente citada como inhibidores de la síntesis de proteínas; esta inhibición ocurre en los ribosomas durante las tres etapas de la síntesis de proteínas: iniciación, elongación y terminación. [11] Durante la iniciación, los tricotecenos pueden inhibir la asociación de las dos subunidades ribosómicas o inhibir la función del ribosoma maduro al prevenir la asociación del primer ARNt con el codón de inicio. [11] La inhibición en la elongación probablemente ocurre debido a que los tricotecenos previenen la función de la peptidil transferasa , la enzima que cataliza la formación de nuevos enlaces peptídicos en la subunidad ribosómica 60s. [12] La inhibición durante la terminación también puede ser el resultado de la inhibición de la peptidil transferasa o la capacidad de los tricotecenos para prevenir la hidrólisis requerida en este paso final. [11]
Es interesante observar que el patrón de sustitución del núcleo del anillo de los tricotecenos influye en la acción de la toxina como inhibidor de la iniciación o como inhibidor de la elongación/terminación. [11] Los tricotecenos también tienen la capacidad de afectar la función enzimática celular general debido a la tendencia de los grupos tiol del sitio activo a atacar el anillo epóxido de 12,13 carbonos. [13] Estos efectos inhibidores se ven más dramáticamente en células que proliferan activamente, como en el tracto gastrointestinal o la médula ósea .
La síntesis de proteínas ocurre tanto en el citoplasma de la célula como en el espacio luminal de las mitocondrias , el orgánulo citoplasmático responsable de producir la energía de la célula. Esto se hace a través de una vía enzimática que genera moléculas altamente oxidadas llamadas especies reactivas de oxígeno , por ejemplo, peróxido de hidrógeno . [14] Las especies reactivas de oxígeno pueden reaccionar y causar daños a muchas partes críticas de la célula, incluidas las membranas, las proteínas y el ADN . [15] La inhibición de la síntesis de proteínas por los tricotecenos en las mitocondrias permite que las especies reactivas de oxígeno se acumulen en la célula, lo que inevitablemente conduce al estrés oxidativo y a la inducción de la vía de muerte celular programada, la apoptosis . [15]
La inducción de la apoptosis en células con altos niveles de especies reactivas de oxígeno se debe a una variedad de vías de señalización celular. La primera es la vía p53 , que se ha demostrado que está regulada positivamente por la toxina T-2. p53 es una proteína responsable de controlar el ciclo celular, pero un aumento en la actividad de esta proteína también conduce a una mayor activación de las proteínas BAX en la célula. [16] Estas proteínas BAX son las principales responsables de aumentar la permeabilidad de la membrana mitocondrial y conducir a la liberación de citocromo c y especies reactivas de oxígeno. [16] La liberación de citocromo c de las mitocondrias induce la apoptosis al iniciar el ensamblaje de caspasas , o proteínas responsables de degradar la célula desde dentro.
Además, se ha demostrado que los tricotecenos, como el T-2, también aumentan la vía de señalización de la quinasa N-terminal c-Jun en las células. [17] En este caso, la quinasa N-terminal c-Jun puede aumentar la fosforilación de su diana, c-Jun, en su forma activa. El c-jun activado actúa como un factor de transcripción en el núcleo celular para proteínas importantes para facilitar la vía apoptótica descendente. [17]
Las micotoxinas tricoteceno son tóxicas para los seres humanos, otros mamíferos, aves, peces, una variedad de invertebrados, plantas y células eucariotas. [18] La toxicidad específica varía según la toxina en particular y la especie animal, sin embargo, la vía de administración juega un papel significativamente mayor en la determinación de la letalidad. Los efectos del envenenamiento dependerán de la concentración de exposición, la duración y la forma en que la persona esté expuesta. Una solución altamente concentrada o una gran cantidad de la forma gaseosa de la toxina tiene más probabilidades de causar efectos graves, incluida la muerte. Tras el consumo, la toxina inhibe la proteína ribosomal, la síntesis de ADN y ARN, [19] [18] [20] las funciones mitocondriales [21] [22] [23] la división celular [24] [25] al mismo tiempo que activa una respuesta de estrés celular denominada respuesta de estrés ribotóxico. [26]
Las micotoxinas tricoteceno pueden absorberse por vía tópica , oral e inhalatoria y son altamente tóxicas a nivel del sistema subcelular, celular y orgánico. [18]
Los tricotecenos se diferencian de la mayoría de las otras toxinas de armas potenciales porque pueden actuar a través de la piel, lo que se atribuye a sus características anfipáticas y lipofílicas . La pequeña naturaleza anfipática de los tricotecenos les permite atravesar fácilmente las membranas celulares [7] e interactuar con diferentes orgánulos como las mitocondrias, [27] [28] el retículo endoplasmático (RE). [29] y el cloroplasto [30] La naturaleza lipofílica de los tricotecenos les permite ser fácilmente absorbidos a través de la piel [31] la mucosa pulmonar y el intestino. La aplicación dérmica directa o la ingestión oral de tricotecenos causa una rápida irritación de la piel o la mucosa intestinal. [19] [18] Como irritante dérmico y agente ampollar, se alega que es 400 veces más intoxicante que la mostaza azufrada .

La respuesta del organismo a la micotoxina, tóxica alimentaria aleucia, se produce varios días después del consumo, en cuatro etapas:
La infección puede ser provocada por una lesión tan pequeña como un corte, un rasguño o una abrasión. [32]
Se presentan los siguientes síntomas:
Cuando se trata de alimentos para animales y humanos, los tricotecenos de tipo A (por ejemplo, toxina T-2 , toxina HT-2, diacetoxiscirpenol ) son de especial interés porque son más tóxicos que los otros tricotecenos transmitidos por los alimentos, es decir, el grupo de tipo B (por ejemplo, deoxinivalenol , nivalenol , 3- y 15-acetildeoxinivalenol). Sin embargo, el deoxinivalenol es motivo de preocupación, ya que es el tricoteceno más frecuente en Europa. [35] Los principales efectos de los tricotecenos, relacionados con su concentración en el producto, son la reducción de la ingesta de alimento, los vómitos y la inmunosupresión. Relativamente pocos países, principalmente en la Unión Europea , han recomendado límites máximos para estas micotoxinas en alimentos y piensos para animales. Sin embargo, los tricotecenos a menudo se prueban en otros lugares, con el fin de evitar que entren en la cadena alimentaria y prevenir pérdidas en la producción animal.
Se cree que los tricotecenos fueron descubiertos en 1932 en Oremburgo, Rusia, durante la Segunda Guerra Mundial , por la Unión Soviética. Alrededor de 100.000 personas (tasa de mortalidad del 60%) comenzaron a sufrir y morir de aleucia tóxica alimentaria , una enfermedad letal con síntomas parecidos a la radiación. Se cree que los civiles soviéticos se enfermaron por ingerir pan contaminado e inhalar moho a través del heno, el polvo y los sistemas de ventilación contaminados. Se cree que el culpable son las toxinas Fusarium sporotrichioides y Fusarium poae , que son grandes productores de toxina T-2 . [36] Las especies de Fusarium son probablemente las más citadas y las más abundantes de los hongos productores de tricotecenos. [37]
Los tricotecenos constituyen un agente de guerra biológica ideal, ya que son letales y económicos de producir en grandes cantidades, estables como aerosol para su dispersión y no requieren vacunación o tratamiento efectivos. [12] La evidencia sugiere que las micotoxinas ya se han utilizado como guerra biológica.
Desde entonces, se ha informado de la presencia de tricotecenos en todo el mundo. [46] Han tenido un impacto económico significativo en el mundo debido a la pérdida de vidas humanas y animales, el aumento de los costos de atención médica y veterinaria, la reducción de la producción ganadera, la eliminación de alimentos y piensos contaminados y la inversión en investigación y aplicaciones para reducir la gravedad del problema de las micotoxinas. Estas micotoxinas representan millones de dólares anuales en pérdidas, debido a factores que a menudo están fuera del control humano (ambientales, ecológicos o método de almacenamiento). [47]
Se han detectado concentraciones peligrosas de tricotecenos en maíz, trigo, cebada, avena, arroz, centeno, verduras y otros cultivos. Las enfermedades resultantes de la infección incluyen la podredumbre de las semillas, el tizón de las plántulas, la podredumbre de las raíces , la podredumbre del tallo y la podredumbre de la mazorca. [48] Los tricotecenos también son contaminantes comunes de los alimentos para aves de corral y sus efectos adversos sobre la salud y la productividad de las aves de corral se han estudiado ampliamente. [49]
Varios estudios han demostrado que las condiciones óptimas para el crecimiento de hongos no son necesariamente óptimas para la producción de toxinas. [50] La producción de toxinas es mayor con alta humedad y temperaturas de 6 a 24 °C. La propagación y producción de hongos se mejora en condiciones tropicales con altas temperaturas y niveles de humedad; monzones , inundaciones repentinas y lluvias fuera de temporada durante la cosecha. [51] Se han detectado tricotecenos en muestras de aire, lo que sugiere que pueden aerosolizarse en esporas o partículas pequeñas [52] [53]
Se ha informado de la aparición natural de TCT en Asia , África , América del Sur , Europa y América del Norte [54].
No se conocen antídotos directos contra la exposición a los tricotecenos. Por lo tanto, la gestión de riesgos en áreas contaminadas se define principalmente por el tratamiento de los síntomas de exposición, así como por la prevención de futuras exposiciones.
Las vías típicas de exposición a las toxinas de los tricotecenos incluyen la absorción tópica, la ingestión y la inhalación. La gravedad de los síntomas depende de la dosis y el tipo de exposición, pero el tratamiento se centra principalmente en apoyar los sistemas corporales dañados por la micotoxina. El primer paso en la mayoría de los casos de exposición es quitarse la ropa potencialmente contaminada y enjuagar bien los sitios de exposición con agua. [65] Esto evita que la víctima se exponga repetidamente. Se pueden administrar líquidos y electrolitos a las víctimas con altos niveles de daño gastrointestinal para mitigar los efectos de la absorción reducida del tracto. También se puede administrar aire fresco y respiración asistida si se desarrolla dificultad respiratoria leve. [65] Los síntomas cada vez más graves pueden requerir la aplicación de asistencia médica avanzada. La aparición de leucopenia , o reducción del recuento de glóbulos blancos, se puede tratar con una transfusión de plasma o plaquetas . [65] La hipotensión se puede tratar con la administración de norepinefrina o dopamina . [65] El desarrollo de dificultad cardiopulmonar grave puede requerir intubación y tratamientos farmacológicos adicionales para estabilizar la actividad cardíaca y pulmonar.
Además, hay una variedad de sustancias químicas que pueden reducir indirectamente los efectos dañinos de los tricotecenos en las células y los tejidos. Las soluciones de carbón activado se administran con frecuencia en casos de ingestión como adsorbente . [66] Aquí, el carbón actúa como una sustancia porosa para que la toxina se una, evitando su absorción a través del tracto gastrointestinal y aumentando su eliminación del cuerpo a través de la excreción intestinal. También se pueden agregar adsorbentes desintoxicantes similares al alimento para animales en caso de contaminación para reducir la biodisponibilidad de la toxina al consumirla. Los antioxidantes también son útiles para mitigar los efectos dañinos de los tricotecenos en respuesta al aumento de las especies reactivas de oxígeno que producen en las células. En general, se cree que una buena dieta rica en probióticos, vitaminas y nutrientes, proteínas y lípidos es eficaz para reducir los síntomas de intoxicación por tricotecenos. [16] Por ejemplo, se descubrió que la vitamina E contrarresta la formación de peróxidos lipídicos inducidos por la toxina T-2 en pollos. [67] De manera similar, la suplementación conjunta de glucomananos modificados y selenio en las dietas de pollos que también consumían toxina T-2 redujo los efectos nocivos de la depleción de antioxidantes en el hígado asociada a la toxina. A pesar de no ser un antídoto directo, estos antioxidantes pueden ser fundamentales para reducir la gravedad de la exposición a los tricotecenos.

Los tricotecenos son micotoxinas producidas por mohos que frecuentemente contaminan los almacenes de productos de granos. Esto hace que la contaminación por tricotecenos sea un problema de salud pública significativo, y muchas áreas tienen límites estrictos en el contenido permitido de tricotecenos. Por ejemplo, en la Unión Europea , solo se permiten 0,025 ppm de toxina T-2 en productos de panadería destinados al consumo humano. [68] Los mohos que pueden producir tricotecenos crecen bien en lugares oscuros y templados con alto contenido de humedad. Por lo tanto, una de las mejores formas de prevenir la contaminación por tricotecenos en productos alimenticios es almacenar los recursos en las condiciones adecuadas para prevenir el crecimiento de mohos. [16] Por ejemplo, generalmente se recomienda almacenar granos solo en áreas con un contenido de humedad de menos del 15%. [69] Sin embargo, si un área ya ha sido contaminada con toxinas de tricoteceno, existen diversas estrategias de descontaminación posibles para prevenir una mayor exposición. Se ha demostrado que el tratamiento con hipoclorito de sodio al 1% (NaOCl) en hidróxido de sodio 0,1 M (NaOH) durante 4 a 5 horas inhibe la actividad biológica de la toxina T-2. [16] También se ha demostrado que la incubación con ozono acuoso a aproximadamente 25 ppm degrada una variedad de tricotecenos a través de un mecanismo que implica la oxidación del doble enlace de carbono 9, 10. [70] También se ha demostrado que la exposición a rayos UV es eficaz en las condiciones adecuadas. [16]
Además de las estrategias de descontaminación física y química, el avance de la investigación en genética molecular también ha dado lugar a la posibilidad de un enfoque de descontaminación biológica. Muchos microbios, incluidas las bacterias, las levaduras y los hongos, han desarrollado productos genéticos enzimáticos que facilitan la degradación específica y eficiente de las micotoxinas de los tricotecenos. [69] Muchas de estas enzimas degradan específicamente el anillo epóxico de 12,13 carbonos, que es importante para la toxicidad de los tricotecenos. Por ejemplo, la cepa Eubacteria BBSH 797 produce enzimas desepoxidasas que reducen el anillo epóxico de 12,13 carbonos a un grupo de doble enlace. [69] Estas, junto con otros microbios que expresan propiedades desintoxicantes de los tricotecenos, se pueden utilizar en los almacenes de piensos para prevenir el efecto tóxico de los piensos contaminados tras el consumo. [16] Además, la clonación molecular de los genes responsables de producir estas enzimas desintoxicantes podría ser útil para producir cepas de productos agrícolas que sean resistentes al envenenamiento por tricoteceno. [16]
Los tricotecenos epoxi son una variación de los anteriores, y alguna vez se exploraron para uso militar en Alemania del Este y posiblemente en todo el bloque soviético. [71] No existe un tratamiento factible una vez que aparecen los síntomas de envenenamiento por tricotecenos epoxi, aunque los efectos pueden desaparecer sin dejar ningún daño permanente.
Los planes para su uso como arma biológica a gran escala fueron abandonados, ya que los tricotecenos epóxicos relevantes se degradan muy rápidamente bajo la luz ultravioleta y el calor, así como bajo la exposición al cloro, lo que los vuelve inútiles para ataques abiertos y el envenenamiento de suministros de agua. [ cita requerida ]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )