El tejido adiposo (también conocido como grasa corporal o simplemente grasa ) es un tejido conectivo laxo compuesto mayoritariamente por adipocitos . [1] [2] También contiene la fracción vascular estromal ( SVF ) de células que incluyen preadipocitos , fibroblastos , células endoteliales vasculares y una variedad de células inmunes como los macrófagos del tejido adiposo . Su función principal es la de almacenar energía en forma de lípidos , aunque también amortigua y aísla el organismo.
Anteriormente tratado como hormonalmente inerte, en los últimos años el tejido adiposo ha sido reconocido como un importante órgano endocrino , [3] ya que produce hormonas como la leptina , el estrógeno , la resistina y las citocinas (especialmente el TNFα ). [2] En la obesidad, el tejido adiposo está implicado en la liberación crónica de marcadores proinflamatorios conocidos como adipocinas , que son responsables del desarrollo del síndrome metabólico , una constelación de enfermedades que incluyen diabetes tipo 2 , enfermedades cardiovasculares y aterosclerosis . [2] [4]
El tejido adiposo se deriva de los preadipocitos y su formación parece estar controlada en parte por el gen adiposo . Los dos tipos de tejido adiposo son el tejido adiposo blanco (WAT), que almacena energía, y el tejido adiposo marrón (BAT), que genera calor corporal. El tejido adiposo, más específicamente el tejido adiposo marrón, fue identificado por primera vez por el naturalista suizo Conrad Gessner en 1551. [5]
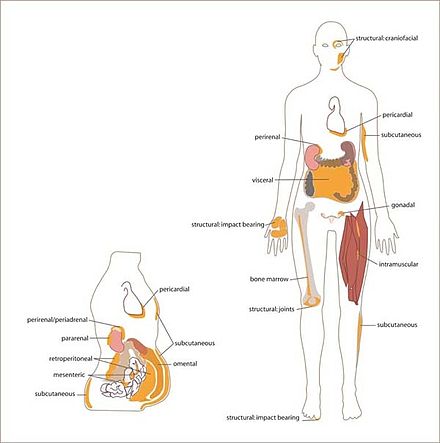
En los seres humanos, el tejido adiposo se encuentra: debajo de la piel ( grasa subcutánea ), alrededor de los órganos internos ( grasa visceral ), en la médula ósea ( médula ósea amarilla ), intermuscular ( sistema muscular ) y en la mama ( tejido mamario ). El tejido adiposo se encuentra en ubicaciones específicas, que se denominan depósitos adiposos . Además de los adipocitos, que comprenden el mayor porcentaje de células dentro del tejido adiposo, hay otros tipos de células presentes, denominadas colectivamente fracción vascular estromal (FVS) de células. SVF incluye preadipocitos , fibroblastos , macrófagos del tejido adiposo y células endoteliales .
El tejido adiposo contiene muchos vasos sanguíneos pequeños . En el sistema tegumentario , que incluye la piel, se acumula en el nivel más profundo, la capa subcutánea , proporcionando aislamiento del calor y el frío. Alrededor de los órganos, proporciona un acolchado protector. Sin embargo, su función principal es ser una reserva de lípidos, que pueden oxidarse para satisfacer las necesidades energéticas del organismo y protegerlo del exceso de glucosa mediante el almacenamiento de triglicéridos producidos por el hígado a partir de los azúcares, aunque algunas evidencias sugieren que la mayor parte de la síntesis de lípidos de los carbohidratos se produce en el propio tejido adiposo. [6] Los depósitos adiposos en diferentes partes del cuerpo tienen diferentes perfiles bioquímicos. En condiciones normales, proporciona información al cerebro sobre el hambre y la dieta.

Los ratones tienen ocho depósitos adiposos principales, cuatro de los cuales se encuentran dentro de la cavidad abdominal . [1] Los depósitos gonadales pareados están unidos al útero y los ovarios en las mujeres y al epidídimo y los testículos en los hombres; Los depósitos retroperitoneales pareados se encuentran a lo largo de la pared dorsal del abdomen , rodeando el riñón y, cuando son masivos, se extienden hasta la pelvis. El depósito mesentérico forma una red similar a un pegamento que sostiene los intestinos y el depósito omental (que se origina cerca del estómago y el bazo ) y, cuando es masivo, se extiende hasta el abdomen ventral. Tanto el depósito mesentérico como el omental incorporan mucho tejido linfoide en forma de ganglios linfáticos y manchas lechosas , respectivamente.
Los dos depósitos superficiales son los depósitos inguinales pares, que se encuentran por delante del segmento superior de las extremidades traseras (debajo de la piel) y los depósitos subescapulares, mezclas mediales pares de tejido adiposo marrón adyacentes a regiones de tejido adiposo blanco, que se encuentran debajo de la piel entre las crestas dorsales de las escápulas. La capa de tejido adiposo marrón en este depósito suele estar cubierta por una "escarcha" de tejido adiposo blanco; A veces estos dos tipos de grasa (marrón y blanca) son difíciles de distinguir. Los depósitos inguinales encierran el grupo inguinal de ganglios linfáticos. Los depósitos menores incluyen el pericárdico , que rodea el corazón, y los depósitos poplíteos pares, entre los músculos principales detrás de las rodillas, cada uno de los cuales contiene un ganglio linfático grande . [7] De todos los depósitos en el ratón, los depósitos gonadales son los más grandes y los más fáciles de diseccionar, [8] y comprenden aproximadamente el 30% de la grasa diseccionable. [9]
En una persona obesa , el exceso de tejido adiposo que cuelga hacia abajo desde el abdomen se denomina panículo . Un panículo complica la cirugía del individuo con obesidad mórbida. Puede permanecer literalmente como un "delantal de piel" si una persona con obesidad severa pierde grandes cantidades de grasa (un resultado común de la cirugía de bypass gástrico ). La obesidad se trata mediante ejercicio, dieta y terapia conductual. La cirugía reconstructiva es un aspecto del tratamiento. [10]

La grasa visceral o grasa abdominal [11] (también conocida como grasa de órganos o grasa intraabdominal) se encuentra en el interior de la cavidad abdominal , empaquetada entre los órganos (estómago, hígado, intestinos, riñones, etc.). La grasa visceral es diferente de la grasa subcutánea debajo de la piel y de la grasa intramuscular intercalada en los músculos esqueléticos . La grasa de la parte inferior del cuerpo, como en los muslos y las nalgas, es subcutánea y no es un tejido espaciado de manera consistente, mientras que la grasa del abdomen es principalmente visceral y semilíquida. [12] La grasa visceral se compone de varios depósitos adiposos, incluidos los depósitos mesentéricos , el tejido adiposo blanco epididimario (EWAT) y los depósitos perirrenales . La grasa visceral a menudo se expresa en términos de su área en cm 2 (VFA, área de grasa visceral). [13]
Se conoce como obesidad abdominal , o “grasa del vientre”, a un exceso de grasa visceral, en la que el abdomen sobresale excesivamente. Nuevos desarrollos como el Índice de Volumen Corporal (BVI) están diseñados específicamente para medir el volumen abdominal y la grasa abdominal. El exceso de grasa visceral también está relacionado con la diabetes tipo 2 , [14] la resistencia a la insulina , [15] las enfermedades inflamatorias , [16] y otras enfermedades relacionadas con la obesidad. [17] Asimismo, se ha demostrado que la acumulación de grasa en el cuello (o tejido adiposo cervical) está asociada con la mortalidad. [18] Varios estudios han sugerido que la grasa visceral se puede predecir a partir de medidas antropométricas simples, [19] y predice la mortalidad con mayor precisión que el índice de masa corporal o la circunferencia de la cintura. [20]
Los hombres tienen más probabilidades de tener grasa almacenada en el abdomen debido a diferencias en las hormonas sexuales . El estrógeno (hormona sexual femenina) hace que la grasa se almacene en las nalgas, los muslos y las caderas de las mujeres. [21] [22] Cuando las mujeres llegan a la menopausia y el estrógeno producido por los ovarios disminuye, la grasa migra desde las nalgas, caderas y muslos hasta la cintura; [23] Posteriormente la grasa se almacena en el abdomen. [12]
La grasa visceral puede ser causada por niveles excesivos de cortisol. [24] Al menos 10 horas MET por semana de ejercicio aeróbico conducen a una reducción de la grasa visceral en personas sin trastornos metabólicos. [25] El entrenamiento de resistencia y la restricción calórica también reducen la grasa visceral, aunque su efecto puede no ser acumulativo. [26] Tanto el ejercicio como la dieta hipocalórica provocan la pérdida de grasa visceral, pero el ejercicio tiene un efecto mayor sobre la grasa visceral que sobre la grasa total. [27] El ejercicio de alta intensidad es una forma de reducir eficazmente la grasa abdominal total. [28] [29] Una dieta restringida en energía combinada con ejercicio reducirá la grasa corporal total y la proporción de tejido adiposo visceral a tejido adiposo subcutáneo, lo que sugiere una movilización preferencial de la grasa visceral sobre la grasa subcutánea. [30]
El tejido adiposo epicárdico (EAT) es una forma particular de grasa visceral depositada alrededor del corazón y que se considera un órgano metabólicamente activo que genera varias moléculas bioactivas, que podrían afectar significativamente la función cardíaca . [31] [32] [33] Se han observado diferencias marcadas en los componentes al comparar la EAT con la grasa subcutánea , lo que sugiere un impacto específico de la ubicación de los ácidos grasos almacenados en la función y el metabolismo de los adipocitos. [34]
La mayor parte de la grasa no visceral restante se encuentra justo debajo de la piel en una región llamada hipodermis . [35] Esta grasa subcutánea no está relacionada con muchas de las patologías clásicas relacionadas con la obesidad, como enfermedades cardíacas , cáncer y accidentes cerebrovasculares , y algunas pruebas incluso sugieren que podría tener un efecto protector. [36] El patrón típicamente femenino (o ginecoide) de distribución de la grasa corporal alrededor de las caderas, los muslos y las nalgas es la grasa subcutánea y, por lo tanto, representa un riesgo menor para la salud en comparación con la grasa visceral. [37] [38]
Como todos los demás órganos grasos, la grasa subcutánea es una parte activa del sistema endocrino y secreta las hormonas leptina y resistina . [35]
La relación entre la capa adiposa subcutánea y la grasa corporal total de una persona a menudo se modela mediante ecuaciones de regresión. La más popular de estas ecuaciones fue formada por Durnin y Wormersley, quienes probaron rigurosamente muchos tipos de pliegues cutáneos y, como resultado, crearon dos fórmulas para calcular la densidad corporal tanto de hombres como de mujeres. Estas ecuaciones presentan una correlación inversa entre los pliegues cutáneos y la densidad corporal: a medida que aumenta la suma de los pliegues cutáneos, la densidad corporal disminuye. [39]
Factores como el sexo, la edad, el tamaño de la población u otras variables pueden hacer que las ecuaciones sean inválidas e inutilizables y, a partir de 2012 [actualizar], las ecuaciones de Durnin y Wormersley siguen siendo solo estimaciones del verdadero nivel de gordura de una persona. Todavía se están creando nuevas fórmulas. [39]
La grasa de la médula, también conocida como tejido adiposo de la médula (MAT), es un depósito adiposo poco conocido que reside en el hueso y está intercalado con células hematopoyéticas y elementos óseos. Los adipocitos de este depósito se derivan de células madre mesenquimales (MSC) que pueden dar lugar a células grasas, células óseas y otros tipos de células. El hecho de que MAT aumente en situaciones de restricción calórica/anorexia es una característica que distingue este depósito de otros depósitos de grasa. [40] [41] [42] El ejercicio regula la MAT, disminuyendo la cantidad de MAT y disminuyendo el tamaño de los adipocitos de la médula. [43] [44] [45] La regulación del ejercicio de la grasa de la médula ósea sugiere que tiene cierta similitud fisiológica con otros depósitos adiposos blancos. Además, el aumento de MAT en la obesidad sugiere además una similitud con los depósitos de grasa blanca. [43]
La grasa ectópica es el almacenamiento de triglicéridos en tejidos distintos del tejido adiposo, que se supone que contienen sólo pequeñas cantidades de grasa, como el hígado , el músculo esquelético , el corazón y el páncreas . [1] Esto puede interferir con las funciones celulares y, por lo tanto, con la función de los órganos, y está asociado con la resistencia a la insulina en la diabetes tipo 2. [46] Se almacena en cantidades relativamente altas alrededor de los órganos de la cavidad abdominal , pero no debe confundirse con la grasa visceral.
Se desconoce la causa específica de la acumulación de grasa ectópica. Es probable que la causa sea una combinación de factores genéticos, ambientales y de comportamiento que intervienen en el consumo excesivo de energía y la disminución de la actividad física. Una pérdida sustancial de peso puede reducir las reservas de grasa ectópica en todos los órganos y esto se asocia con una mejora de la función de esos órganos. [46]
En este último caso, las intervenciones de pérdida de peso no invasivas, como la dieta o el ejercicio, pueden disminuir la grasa ectópica (particularmente en el corazón y el hígado) en niños y adultos con sobrepeso u obesidad. [47] [48]
Los ácidos grasos libres (AGL) se liberan de las lipoproteínas mediante la lipoproteína lipasa (LPL) y ingresan al adipocito, donde se reensamblan en triglicéridos esterificándolos en glicerol . [2] El tejido graso humano contiene aproximadamente un 87% de lípidos . [49]
Hay un flujo constante de ácidos grasos libres que entran y salen del tejido adiposo. [2] La dirección neta de este flujo está controlada por la insulina y la leptina: si la insulina está elevada, entonces hay un flujo neto hacia adentro de FFA, y solo cuando la insulina es baja los FFA pueden salir del tejido adiposo. La secreción de insulina es estimulada por el nivel alto de azúcar en sangre, que resulta del consumo de carbohidratos. [50]
En los seres humanos, la lipólisis (hidrólisis de triglicéridos en ácidos grasos libres) se controla mediante el control equilibrado de los receptores adrenérgicos B lipolíticos y la antilipólisis mediada por receptores adrenérgicos a2A.
Las células grasas tienen un papel fisiológico importante en el mantenimiento de los niveles de triglicéridos y ácidos grasos libres, además de determinar la resistencia a la insulina . [2] La grasa abdominal tiene un perfil metabólico diferente : es más propensa a inducir resistencia a la insulina. Esto explica en gran medida por qué la obesidad central es un marcador de intolerancia a la glucosa y es un factor de riesgo independiente de enfermedad cardiovascular (incluso en ausencia de diabetes mellitus e hipertensión ). [51] Los estudios de monos hembra en la Universidad Wake Forest (2009) descubrieron que las personas con mayor estrés tienen niveles más altos de grasa visceral en sus cuerpos. Esto sugiere un posible vínculo de causa y efecto entre los dos, en el que el estrés promueve la acumulación de grasa visceral, lo que a su vez provoca cambios hormonales y metabólicos que contribuyen a las enfermedades cardíacas y otros problemas de salud. [52]
Los avances recientes en biotecnología han permitido la recolección de células madre adultas del tejido adiposo, lo que permite estimular el crecimiento del tejido utilizando las propias células del paciente. Además, según se informa, las células madre derivadas del tejido adiposo tanto de humanos como de animales pueden reprogramarse eficientemente en células madre pluripotentes inducidas sin la necesidad de células alimentadoras . [53] El uso de las propias células del paciente reduce la posibilidad de rechazo del tejido y evita problemas éticos asociados con el uso de células madre embrionarias humanas . [54] Un creciente conjunto de evidencia también sugiere que diferentes depósitos de grasa (es decir, abdominal, omental, pericárdica) producen células madre derivadas del tejido adiposo con diferentes características. [54] [55] Estas características dependientes del depósito incluyen la tasa de proliferación , el inmunofenotipo , el potencial de diferenciación , la expresión genética y la sensibilidad a las condiciones de cultivo hipóxico. [56] Los niveles de oxígeno parecen desempeñar un papel importante en el metabolismo y, en general, en la función de las células madre derivadas del tejido adiposo. [57]
El tejido adiposo es una importante fuente periférica de aromatasa tanto en hombres como en mujeres, y contribuye a la producción de estradiol . [58]
Las hormonas derivadas del tejido adiposo incluyen:
Los tejidos adiposos también secretan un tipo de citocinas (proteínas de señalización entre células) llamadas adipocinas (citocinas adiposas), que desempeñan un papel en las complicaciones asociadas a la obesidad. El tejido adiposo perivascular libera adipocinas como la adiponectina que afectan la función contráctil de los vasos que lo rodean. [1] [59]

La grasa parda o tejido adiposo pardo (BAT) es una forma especializada de tejido adiposo importante para la termogénesis adaptativa en humanos y otros mamíferos. BAT puede generar calor "desacoplando" la cadena respiratoria de fosforilación oxidativa dentro de las mitocondrias a través de la expresión específica de tejido de la proteína desacopladora 1 (UCP1). [60] BAT se encuentra principalmente alrededor del cuello y los grandes vasos sanguíneos del tórax , donde puede actuar eficazmente en el intercambio de calor. BAT se activa fuertemente tras la exposición al frío mediante la liberación de catecolaminas de los nervios simpáticos que da como resultado la activación de UCP1. Casi la mitad de los nervios presentes en el tejido adiposo son neuronas sensoriales conectadas a los ganglios de la raíz dorsal . [61]
La activación de BAT también puede ocurrir en respuesta a la sobrealimentación. [62] La actividad de UCP1 es estimulada por ácidos grasos de cadena larga que se producen después de la activación del receptor β-adrenérgico . [60] Se propone que UCP1 funcione como un simportador de protones de ácidos grasos , aunque el mecanismo exacto aún no se ha dilucidado. [63] Por el contrario, UCP1 es inhibido por ATP , ADP y GTP . [64]
Los intentos de simular farmacológicamente este proceso hasta ahora no han tenido éxito. Las técnicas para manipular la diferenciación de la "grasa parda" podrían convertirse en el futuro en un mecanismo de terapia de adelgazamiento , favoreciendo el crecimiento de tejido con este metabolismo especializado sin inducirlo en otros órganos. Samuelson y Vidal-Puig publicaron en 2020 una revisión sobre el posible objetivo terapéutico de la grasa parda para tratar la obesidad humana.
Hasta hace poco se pensaba que el tejido adiposo marrón en humanos se limitaba principalmente a los bebés, pero nueva evidencia ha revocado esa creencia. El tejido metabólicamente activo con respuestas de temperatura similares al adiposo pardo se informó por primera vez en el cuello y el tronco de algunos adultos humanos en 2007, [66] y la presencia de adiposo pardo en adultos humanos se verificó posteriormente histológicamente en las mismas regiones anatómicas. [67] [68] [69]
El pardeamiento de WAT, también conocido como "beiging", ocurre cuando los adipocitos dentro de los depósitos de WAT desarrollan características de BAT. Los adipocitos beige adquieren una apariencia multilocular (contienen varias gotitas de lípidos) y aumentan la expresión de la proteína desacopladora 1 (UCP1). [70] Al hacerlo, estos adipocitos que normalmente almacenan energía se convierten en adipocitos que liberan energía.
La capacidad de quemar calorías de la grasa marrón y beige se ha estudiado ampliamente a medida que los esfuerzos de investigación se centran en terapias dirigidas a tratar la obesidad y la diabetes. El fármaco 2,4-dinitrofenol , que también actúa como un desacoplador químico similar al UCP1, se utilizó para perder peso en la década de 1930. Sin embargo, se suspendió rápidamente cuando una dosis excesiva provocó efectos secundarios adversos, como hipertermia y muerte. [70] Los agonistas β3, como CL316,243, también se han desarrollado y probado en humanos. Sin embargo, el uso de tales medicamentos ha resultado en gran medida infructuoso debido a varios desafíos, incluida la especificidad de los receptores de diferentes especies y la escasa biodisponibilidad oral . [71]
El frío es un regulador primario de los procesos BAT e induce el pardeamiento WAT. El oscurecimiento en respuesta a la exposición crónica al frío ha sido bien documentado y es un proceso reversible. Un estudio en ratones demostró que el oscurecimiento inducido por el frío se puede revertir por completo en 21 días, observándose disminuciones mensurables en UCP1 en un período de 24 horas. [72] Un estudio de Rosenwald et al. reveló que cuando los animales se vuelven a exponer a un ambiente frío, los mismos adipocitos adoptarán un fenotipo beige, lo que sugiere que se retienen los adipocitos beige. [73]
Los reguladores transcripcionales, así como un número creciente de otros factores, regulan la inducción de grasa beige. Cuatro reguladores de la transcripción son fundamentales para el pardeamiento del WAT y sirven como objetivos para muchas de las moléculas que se sabe que influyen en este proceso. [74] Estos incluyen el receptor gamma activado por proliferador de peroxisomas (PPARγ) , PRDM16, [75] el coactivador 1 alfa del receptor gamma activado por proliferador de peroxisomas (PGC-1α) y el factor 2 de células B tempranas (EBF2). [76] [77] [78]
La lista de moléculas que influyen en el oscurecimiento ha crecido en proporción directa a la popularidad de este tema y evoluciona constantemente a medida que se adquieren más conocimientos. Entre estas moléculas se encuentran la irisina y el factor de crecimiento de fibroblastos 21 ( FGF21 ), que han sido bien estudiados y se cree que son importantes reguladores del oscurecimiento. La irisina se secreta en los músculos en respuesta al ejercicio y se ha demostrado que aumenta el oscurecimiento al actuar sobre los preadipocitos beige. [79] FGF21, una hormona secretada principalmente por el hígado, ha despertado un gran interés después de ser identificada como un potente estimulador de la absorción de glucosa y un regulador del oscurecimiento a través de sus efectos sobre PGC-1α. [70] Aumenta en BAT durante la exposición al frío y se cree que ayuda en la resistencia a la obesidad inducida por la dieta. [80] El FGF21 también puede secretarse en respuesta al ejercicio y a una dieta baja en proteínas, aunque esta última no se ha investigado a fondo. [81] [82] Los datos de estos estudios sugieren que los factores ambientales como la dieta y el ejercicio pueden ser mediadores importantes del oscurecimiento. En ratones, se descubrió que la pigmentación puede ocurrir mediante la producción de péptidos de metionina-encefalina por parte de células linfoides innatas tipo 2 en respuesta a la interleucina 33 . [83]
Debido a la naturaleza compleja del tejido adiposo y a una lista cada vez mayor de moléculas reguladoras del pardeamiento, existe un gran potencial para el uso de herramientas bioinformáticas para mejorar los estudios en este campo. Los estudios sobre el pardeamiento WAT se han beneficiado enormemente de los avances en estas técnicas, ya que la grasa beige está ganando rápidamente popularidad como objetivo terapéutico para el tratamiento de la obesidad y la diabetes.
Los microarrays de ADN son una herramienta bioinformática que se utiliza para cuantificar los niveles de expresión de varios genes simultáneamente y se han utilizado ampliamente en el estudio del tejido adiposo. Uno de esos estudios utilizó análisis de microarrays junto con el software Ingenuity IPA para observar los cambios en la expresión de los genes WAT y BAT cuando los ratones fueron expuestos a temperaturas de 28 y 6 °C. [84] Luego se identificaron y utilizaron los genes regulados hacia arriba y hacia abajo más significativamente para el análisis de las vías expresadas diferencialmente. Se descubrió que muchas de las vías reguladas positivamente en WAT después de la exposición al frío también se expresan altamente en BAT, como la fosforilación oxidativa , el metabolismo de los ácidos grasos y el metabolismo del piruvato. [84] Esto sugiere que algunos de los adipocitos cambiaron a un fenotipo beige a 6 °C. Mössenböck et al. También utilizaron análisis de microarrays para demostrar que la deficiencia de insulina inhibe la diferenciación de los adipocitos beige pero no altera su capacidad de oscurecerse. [85] Estos dos estudios demuestran el potencial del uso de microarrays en el estudio del pardeamiento WAT.
La secuenciación de ARN ( RNA-Seq ) es una poderosa herramienta computacional que permite la cuantificación de la expresión de ARN de todos los genes dentro de una muestra. La incorporación de RNA-Seq en los estudios de pardeamiento es de gran valor, ya que ofrece una mejor especificidad, sensibilidad y una descripción más completa de la expresión genética que otros métodos. RNA-Seq se ha utilizado en estudios tanto en humanos como en ratones en un intento de caracterizar los adipocitos beige según sus perfiles de expresión génica e identificar posibles moléculas terapéuticas que puedan inducir el fenotipo beige. Uno de esos estudios utilizó RNA-Seq para comparar los perfiles de expresión genética de WAT de ratones de tipo salvaje (WT) y aquellos que sobreexpresan el factor 2 de células B tempranas (EBF2). El WAT de los animales transgénicos exhibió un programa genético de grasa parda y tuvo una expresión genética específica de WAT disminuida en comparación con los ratones WT. [86] Por lo tanto, EBF2 ha sido identificado como una molécula terapéutica potencial para inducir el beiging.
La inmunoprecipitación de cromatina con secuenciación (ChIP-seq) es un método utilizado para identificar sitios de unión de proteínas en el ADN y evaluar las modificaciones de las histonas . Esta herramienta ha permitido examinar la regulación epigenética del pardeamiento y ayuda a dilucidar los mecanismos por los cuales las interacciones proteína-ADN estimulan la diferenciación de los adipocitos beige. Los estudios que observaron los paisajes de cromatina de los adipocitos beige han encontrado que la adipogénesis de estas células resulta de la formación de paisajes de cromatina específicos de cada célula, que regulan el programa transcripcional y, en última instancia, controlan la diferenciación. Utilizando ChIP-seq junto con otras herramientas, estudios recientes han identificado más de 30 factores transcripcionales y epigenéticos que influyen en el desarrollo de los adipocitos beige. [86]
La hipótesis del gen ahorrativo (también llamada hipótesis de la hambruna) afirma que en algunas poblaciones el cuerpo sería más eficiente para retener grasa en tiempos de abundancia, dotando así de una mayor resistencia al hambre en tiempos de escasez de alimentos. Esta hipótesis, originalmente planteada en el contexto del metabolismo de la glucosa y la resistencia a la insulina, ha sido desacreditada por antropólogos físicos, fisiólogos y el propio proponente original de la idea con respecto a ese contexto, aunque según su desarrollador sigue siendo "tan viable como cuando [fue] avanzado por primera vez" en otros contextos. [87] [88]
En 1995, Jeffrey Friedman , en su residencia en la Universidad Rockefeller , junto con Rudolph Leibel , Douglas Coleman et al. descubrió la proteína leptina de la que carecía el ratón genéticamente obeso. [89] [90] [91] La leptina se produce en el tejido adiposo blanco y envía señales al hipotálamo . Cuando los niveles de leptina bajan, el cuerpo lo interpreta como una pérdida de energía y aumenta el hambre. Los ratones que carecen de esta proteína comen hasta alcanzar cuatro veces su tamaño normal.
La leptina, sin embargo, desempeña un papel diferente en la obesidad inducida por la dieta en roedores y humanos. Debido a que los adipocitos producen leptina, los niveles de leptina están elevados en las personas obesas. Sin embargo, el hambre persiste y, cuando los niveles de leptina bajan debido a la pérdida de peso, el hambre aumenta. La caída de leptina se ve mejor como una señal de inanición que el aumento de leptina como una señal de saciedad . [92] Sin embargo, la leptina elevada en la obesidad se conoce como resistencia a la leptina . Los cambios que se producen en el hipotálamo y que dan lugar a la resistencia a la leptina en la obesidad son actualmente el foco de la investigación sobre la obesidad. [93]
Los defectos genéticos en el gen de la leptina ( ob ) son raros en la obesidad humana. [94] En julio de 2010 [actualizar], solo se han identificado 14 individuos de cinco familias en todo el mundo que portan un gen ob mutado (uno de los cuales fue la primera causa identificada de obesidad genética en humanos): dos familias de origen paquistaní que viven en el Reino Unido. , una familia que vive en Turquía, una en Egipto y otra en Austria [95] [96] [97] [98] [99] , y se ha descubierto que otras dos familias portan un receptor ob mutado . [100] [101] Se ha identificado que otros tienen una deficiencia genética parcial de leptina y, en estos individuos, los niveles de leptina en el extremo inferior del rango normal pueden predecir la obesidad. [102]
También se ha identificado que varias mutaciones de genes que involucran a las melanocortinas (utilizadas en la señalización cerebral asociada con el apetito) y sus receptores causan obesidad en una porción mayor de la población que las mutaciones de la leptina. [103]
El tejido adiposo tiene una densidad de ~0,9 g/ml. [104] Así, una persona con más tejido adiposo flotará más fácilmente que una persona del mismo peso con más tejido muscular , ya que el tejido muscular tiene una densidad de 1,06 g/ml. [105]
Un medidor de grasa corporal es una herramienta que se utiliza para medir la proporción de grasa corporal y peso en el cuerpo humano. Diferentes medidores utilizan varios métodos para determinar la relación. Tienden a subestimar el porcentaje de grasa corporal.
A diferencia de herramientas clínicas como DXA y pesaje bajo el agua , un tipo de medidor de grasa corporal relativamente económico utiliza el principio del análisis de impedancia bioeléctrica (BIA) para determinar el porcentaje de grasa corporal de un individuo. Para lograr esto, el medidor pasa una pequeña corriente eléctrica inofensiva a través del cuerpo y mide la resistencia , luego usa información sobre el peso, la altura, la edad y el sexo de la persona para calcular un valor aproximado del porcentaje de grasa corporal de la persona. El cálculo mide el volumen total de agua en el cuerpo (el tejido magro y el músculo contienen un mayor porcentaje de agua que de grasa) y estima el porcentaje de grasa basándose en esta información. El resultado puede variar varios puntos porcentuales dependiendo de lo que se haya comido y de la cantidad de agua que se haya bebido antes del análisis. Este método es rápido y fácilmente accesible, pero impreciso. Los métodos alternativos son: métodos de pliegues cutáneos que utilizan calibradores , pesaje bajo el agua , pletismografía por desplazamiento de aire de todo el cuerpo (ADP) y DXA .
Dentro del tejido graso (adiposo) de ratones con deficiencia de CCR2 , hay un mayor número de eosinófilos , una mayor activación alternativa de macrófagos y una propensión a la expresión de citoquinas tipo 2 . Además, este efecto se exageró cuando los ratones se volvieron obesos debido a una dieta rica en grasas. [106]
La grasa visceral es más un problema de salud que la grasa subcutánea
El estrógeno hace que la grasa se almacene alrededor de la región pélvica, las caderas, los glúteos y los muslos (región pélvica).