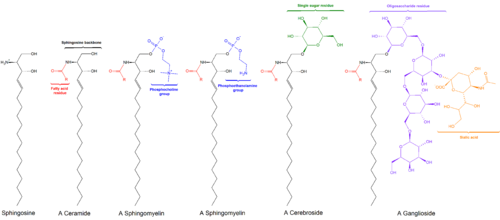
Los esfingolípidos son una clase de lípidos que contienen una columna vertebral de bases esfingoideas, que son un conjunto de aminoalcoholes alifáticos que incluye la esfingosina . Fueron descubiertos en extractos de cerebro en la década de 1870 y recibieron el nombre de la esfinge mitológica debido a su naturaleza enigmática. [1] Estos compuestos desempeñan funciones importantes en la transducción de señales y el reconocimiento celular . Las esfingolipidosis , o trastornos del metabolismo de los esfingolípidos, tienen un impacto particular en el tejido neural . Un esfingolípido con un grupo hidroxilo terminal es una ceramida . Otros grupos comunes unidos al átomo de oxígeno terminal incluyen fosfocolina , que produce una esfingomielina , y varios monómeros o dímeros de azúcar, que producen cerebrósidos y globosidos , respectivamente. Los cerebrósidos y los globosidos se conocen colectivamente como glicoesfingolípidos .
Las bases de cadena larga, a veces conocidas simplemente como bases esfingoideas, son los primeros productos no transitorios de la síntesis de novo de esfingolípidos tanto en levaduras como en mamíferos. Estos compuestos, conocidos específicamente como fitoesfingosina y dihidroesfingosina (también conocida como esfinganina, [2] aunque este término es menos común), son principalmente compuestos C 18 , con niveles algo más bajos de bases C 20 . [3] Las ceramidas y los glicoesfingolípidos son derivados N -acílicos de estos compuestos. [4]
La columna vertebral de la esfingosina está unida en forma de O a un grupo principal (generalmente) cargado, como etanolamina , serina o colina . [ cita necesaria ]
La cadena principal también está unida por amida a un grupo acilo , como un ácido graso . [ cita necesaria ]
Los esfingolípidos simples, que incluyen las bases esfingoideas y las ceramidas, constituyen los primeros productos de las vías sintéticas de los esfingolípidos.
Los esfingolípidos complejos se pueden formar mediante la adición de grupos principales a ceramida o fitoceramida:
La síntesis de novo de esfingolípidos comienza con la formación de 3-ceto-dihidroesfingosina por la serina palmitoiltransferasa . [7] Los sustratos preferidos para esta reacción son palmitoil-CoA y serina . Sin embargo, los estudios han demostrado que la serina palmitoiltransferasa tiene cierta actividad hacia otras especies de acil-CoA grasa [8] y aminoácidos alternativos , [9] y recientemente se ha revisado la diversidad de bases esfingoideas. [10] A continuación, la 3-ceto-dihidroesfingosina se reduce para formar dihidroesfingosina. La dihidroesfingosina es acilada por una de las seis (dihidro)-ceramida sintasa, CerS, originalmente denominada LASS, para formar dihidroceramida. [11] Las seis enzimas CerS tienen diferente especificidad por los sustratos de acil-CoA , lo que da como resultado la generación de dihidroceramidas con diferentes longitudes de cadena (que van desde C14-C26). Luego, las dihidroceramidas se desaturan para formar ceramida. [12]
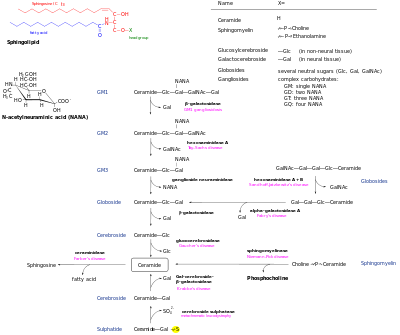
La ceramida generada de novo es el centro de la red de esfingolípidos y posteriormente tiene varios destinos. Puede ser fosforilado por la ceramida quinasa para formar ceramida-1-fosfato. Alternativamente, puede glicosilarse mediante glucosilceramida sintasa o galactosilceramida sintasa. Además, puede convertirse en esfingomielina mediante la adición de un grupo principal de fosforilcolina mediante la esfingomielina sintasa . Este proceso genera diacilglicerol . Finalmente, la ceramida puede ser descompuesta por una ceramidasa para formar esfingosina . La esfingosina puede fosforilarse para formar esfingosina-1-fosfato. Este puede desfosforilarse para reformar la esfingosina. [13]
Las vías de descomposición permiten la reversión de estos metabolitos a ceramida. Los glicoesfingolípidos complejos se hidrolizan a glucosilceramida y galactosilceramida. Estos lípidos luego son hidrolizados por betaglucosidasas y betagalactosidasas para regenerar la ceramida. De manera similar, la esfingomielinasa puede descomponer la esfingomielina para formar ceramida. [ cita necesaria ]
La única ruta por la cual los esfingolípidos se convierten en no esfingolípidos es a través de la esfingosina-1-fosfato liasa. Esto forma fosfato de etanolamina y hexadecenal. [14]
Se cree comúnmente que los esfingolípidos protegen la superficie celular contra factores ambientales dañinos al formar una valva externa mecánicamente estable y químicamente resistente de la bicapa lipídica de la membrana plasmática . Se descubrió que ciertos glicoesfingolípidos complejos estaban involucrados en funciones específicas, como el reconocimiento y la señalización celular . El reconocimiento celular depende principalmente de las propiedades físicas de los esfingolípidos, mientras que la señalización implica interacciones específicas de las estructuras de glicanos de los glicoesfingolípidos con lípidos similares presentes en células vecinas o con proteínas . [ cita necesaria ]
Recientemente, se ha demostrado que los metabolitos de esfingolípidos simples , como la ceramida y la esfingosina-1-fosfato , son mediadores importantes en las cascadas de señalización implicadas en la apoptosis , la proliferación , las respuestas al estrés, la necrosis , la inflamación , la autofagia , la senescencia y la diferenciación . [15] [16] [17] [18] [19] [20] Los lípidos a base de ceramidas se autoagregan en las membranas celulares y forman fases separadas menos fluidas que los fosfolípidos en masa. Estos microdominios basados en esfingolípidos, o " balsas de lípidos ", se propusieron originalmente para clasificar las proteínas de la membrana a lo largo de las vías celulares de transporte de la membrana. En la actualidad, la mayoría de las investigaciones se centran en la función organizadora durante la transducción de señales. [21]
Los esfingolípidos se sintetizan en una vía que comienza en el RE y se completa en el aparato de Golgi , pero estos lípidos se enriquecen en la membrana plasmática y en los endosomas , donde realizan muchas de sus funciones. [22] El transporte se produce a través de vesículas y transporte monomérico en el citosol . Los esfingolípidos están prácticamente ausentes en las mitocondrias y el RE , pero constituyen una fracción molar de 20 a 35 de los lípidos de la membrana plasmática. [23]
En animales de experimentación, la alimentación con esfingolípidos inhibe la carcinogénesis de colon , reduce el colesterol LDL y eleva el colesterol HDL . [24]
Los esfingolípidos son universales en los eucariotas , pero son raros en las bacterias y arqueas , lo que significa que evolutivamente son muy antiguos. Las bacterias que producen esfingolípidos se encuentran en algunos miembros del grupo superfilo FCB ( Sphingobacteria ), particularmente en la familia Sphingomonadaceae , algunos miembros de Bdellovibrionota y algunos miembros de Myxococcota . [25]
Debido a la increíble complejidad de los sistemas de los mamíferos, las levaduras se utilizan a menudo como organismo modelo para desarrollar nuevas vías. Estos organismos unicelulares suelen ser más manejables genéticamente que las células de mamíferos, y hay bibliotecas de cepas disponibles para suministrar cepas que albergan casi cualquier deleción única no letal en el marco de lectura abierto . Las dos levaduras más utilizadas son Saccharomyces cerevisiae y Schizosaccharomyces pombe , aunque también se investiga en la levadura patógena Candida albicans . [ cita necesaria ]
Además de las importantes funciones estructurales de los esfingolípidos complejos (inositol fosforilceramida y sus derivados manosilados), las bases esfingoideas fitoesfingosina y dihidroesfingosina (esfinganina) desempeñan funciones de señalización vitales en S. cerevisiae . Estos efectos incluyen la regulación de la endocitosis , la proteólisis dependiente de ubiquitina (y, por tanto, la regulación de la absorción de nutrientes [26] ), la dinámica citoesquelética , el ciclo celular , la traducción , la modificación postraduccional de proteínas y la respuesta al estrés por calor. [27] Además, recientemente se ha descrito la modulación del metabolismo de los esfingolípidos mediante la señalización de fosfatidilinositol (4,5)-bifosfato a través de Slm1p y Slm2p y calcineurina . [28] Además, se ha demostrado una interacción a nivel de sustrato entre la síntesis de esfingolípidos complejos y el ciclo del fosfatidilinositol 4-fosfato mediante la fosfatidilinositol quinasa Stt4p y la lípido fosfatasa Sac1p. [29]
Las plantas superiores contienen una variedad más amplia de esfingolípidos que los animales y los hongos. [ cita necesaria ]
Existen varios trastornos del metabolismo de los esfingolípidos, conocidos como esfingolipidosis . Los principales miembros de este grupo son la enfermedad de Niemann-Pick , la enfermedad de Fabry , la enfermedad de Krabbe , la enfermedad de Gaucher , la enfermedad de Tay-Sachs y la leucodistrofia metacromática . Generalmente se heredan de forma autosómica recesiva , pero en particular la enfermedad de Fabry está ligada al cromosoma X. En conjunto, las esfingolipidosis tienen una incidencia de aproximadamente 1 en 10.000, pero sustancialmente mayor en ciertas poblaciones como los judíos asquenazíes . La terapia de reemplazo enzimático está disponible para tratar principalmente la enfermedad de Fabry y la enfermedad de Gaucher , y las personas con estos tipos de esfingolipidosis pueden vivir hasta la edad adulta. Los otros tipos son generalmente mortales entre el año y los cinco años de edad en el caso de las formas infantiles, pero la progresión puede ser leve en las formas de inicio juvenil o adulto. [ cita necesaria ]
Los esfingolípidos también han sido implicados con la proteína frataxina (Fxn), cuya deficiencia está asociada con la ataxia de Friedreich (FRDA). La pérdida de Fxn en el sistema nervioso de ratones también activa una vía de hierro/esfingolípido/PDK1/Mef2, lo que indica que el mecanismo se conserva evolutivamente. Además, los niveles de esfingolípidos y la actividad de PDK1 también aumentan en los corazones de pacientes con FRDA, lo que sugiere que una vía similar está afectada en FRDA. [30] Otra investigación ha demostrado que la acumulación de hierro en el sistema nervioso de las moscas mejora la síntesis de esfingolípidos, que a su vez activa la proteína quinasa-1 dependiente de 3-fosfoinositida (Pdk1) y el factor potenciador de miocitos-2 (Mef2) para desencadenar la neurodegeneración de fotorreceptores adultos. [31]
Los esfingolípidos desempeñan un papel clave en la supervivencia neuronal en la enfermedad de Parkinson (EP) y su alteración de la vía catabólica en el cerebro está representada en parte en el líquido cefalorraquídeo y los tejidos sanguíneos (Tabla 1) y tienen potencial diagnóstico. [32]