
En química orgánica , la hidroformilación , también conocida como oxosíntesis o proceso oxo , es un proceso industrial para la producción de aldehídos ( R−CH=O ) a partir de alquenos ( R 2 C=CR 2 ). [1] [2] Esta reacción química implica la adición neta de un grupo formilo ( −CHO ) y un átomo de hidrógeno a un doble enlace carbono-carbono . Este proceso ha experimentado un crecimiento continuo desde su invención: la capacidad de producción alcanzó 6,6 × 106 toneladas en 1995. Es importante porque los aldehídos se convierten fácilmente en muchos productos secundarios. Por ejemplo, los aldehídos resultantes se hidrogenan a alcoholes que se convierten en detergentes . La hidroformilación también se utiliza en productos químicos especializados , relevantes para la síntesis orgánica de fragancias y productos farmacéuticos . El desarrollo de la hidroformilación es uno de los principales logros de la química industrial del siglo XX.
El proceso implica el tratamiento de un alqueno típicamente con altas presiones (entre 10 y 100 atmósferas ) de monóxido de carbono e hidrógeno a temperaturas entre 40 y 200 °C. [3] En una variación, se utiliza formaldehído en lugar de gas de síntesis. [4] Se requieren catalizadores de metales de transición . Invariablemente, el catalizador se disuelve en el medio de reacción, es decir, la hidroformilación es un ejemplo de catálisis homogénea .
El proceso fue descubierto por el químico alemán Otto Roelen en 1938 durante las investigaciones del proceso Fischer-Tropsch . Se obtuvieron aldehídos y dietilcetona cuando se añadió etileno a un reactor FT. A través de estos estudios, Roelen descubrió la utilidad de los catalizadores de cobalto. El HCo(CO) 4 , que había sido aislado sólo unos años antes del trabajo de Roelen, demostró ser un excelente catalizador. [5] [6] El término oxosíntesis fue acuñado por el departamento de patentes de Ruhrchemie, que esperaba que el proceso fuera aplicable a la preparación tanto de aldehídos como de cetonas. Trabajos posteriores demostraron que el ligando tributilfosfina (PBu 3 ) mejoraba la selectividad del proceso catalizado por cobalto. El mecanismo de hidroformilación cocatalizada fue aclarado por Richard F. Heck y David Breslow en la década de 1960. [7]
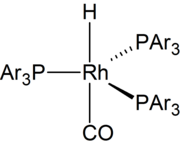
En 1968, se informó sobre catalizadores a base de rodio altamente activos. [8] Desde la década de 1970, la mayor parte de la hidroformilación se basa en catalizadores basados en rodio . [9] Se han desarrollado catalizadores solubles en agua. Facilitan la separación de los productos del catalizador. [10]

Una consideración clave de la hidroformilación es la selectividad "normal" versus "iso" . Por ejemplo, la hidroformilación de propileno puede producir dos productos isoméricos , butiraldehído o isobutiraldehído :
Estos isómeros reflejan la regioquímica de la inserción del alqueno en el enlace M-H. Dado que ambos productos no son igualmente deseables (lo normal es más estable que lo iso), se dedicó mucha investigación a la búsqueda de un catalizador que favoreciera al isómero normal.
La adición de hidruro de cobalto a alquenos primarios según la regla de Markovnikov se ve desfavorecida por el impedimento estérico entre el centro de cobalto y el ligando de alquilo secundario. Los ligandos voluminosos exacerban este impedimento estérico. Por lo tanto, los complejos mixtos carbonilo/fosfina ofrecen una mayor selectividad para la adición anti-Markovnikov, favoreciendo así los productos de cadena lineal ( n- )aldehídos. Los catalizadores modernos dependen cada vez más de ligandos quelantes, especialmente difosfitos. [12]

Además, los complejos de hidruro ricos en electrones se parecen menos a los protones. Por tanto, como resultado, los efectos electrónicos que normalmente favorecen la adición de Markovnikov a un alqueno son menos aplicables. Por tanto, los hidruros ricos en electrones son más selectivos.
Para suprimir la isomerización competitiva del alqueno, la velocidad de inserción migratoria del carbonilo en el enlace carbono -metal del alquilo debe ser relativamente rápida. Es probable que la tasa de inserción del carbono carbonilo en el enlace CM sea mayor que la tasa de eliminación del beta-hidruro. [13]

La hidroformilación de alquenos proquirales crea nuevos estereocentros . Utilizando ligandos de fosfina quirales , la hidroformilación se puede adaptar para favorecer un enantiómero . [14] Así, por ejemplo, el dexibuprofeno , el enantiómero (+)-( S ) del ibuprofeno , puede producirse mediante hidroformilación enantioselectiva seguida de oxidación.
Los procesos industriales varían dependiendo de la longitud de la cadena de la olefina a hidroformilar, el metal y ligandos del catalizador y la recuperación del catalizador. El proceso original de Ruhrchemie producía propanal a partir de eteno y gas de síntesis utilizando hidruro de tetracarbonilo de cobalto . Hoy en día, los procesos industriales basados en catalizadores de cobalto se utilizan principalmente para la producción de olefinas de cadena media a larga, mientras que los catalizadores a base de rodio se utilizan habitualmente para la hidroformilación de propeno . Los catalizadores de rodio son significativamente más caros que los catalizadores de cobalto. En la hidroformilación de olefinas de mayor peso molecular, la separación del catalizador de los aldehídos producidos es difícil.
El proceso BASF-oxo comienza principalmente con olefinas superiores y se basa en un catalizador a base de carbonilo de cobalto. [15] Al realizar la reacción a bajas temperaturas, se observa una mayor selectividad que favorece el producto lineal. El proceso se lleva a cabo a una presión de aproximadamente 30 MPa y en un rango de temperatura de 150 a 170 °C. El cobalto se recupera del producto líquido mediante oxidación a Co 2 + soluble en agua , seguido de la adición de ácidos fórmico o acético acuosos . Este proceso da una fase acuosa de cobalto, que luego puede reciclarse. Las pérdidas se compensan añadiendo sales de cobalto. [dieciséis]
Para la hidroformilación de olefinas C6-C12 se utiliza el proceso Exxon, también proceso Kuhlmann o PCUK oxo. El proceso se basa en catalizadores de cobalto. Para recuperar el catalizador, se añade a la fase orgánica una solución acuosa de hidróxido de sodio o carbonato de sodio. Mediante extracción con olefina y neutralización mediante la adición de una solución de ácido sulfúrico bajo presión de monóxido de carbono se puede recuperar el hidruro de carbonilo metálico . Este se elimina con gas de síntesis, es absorbido por la olefina y devuelto al reactor. De manera similar al proceso BASF, el proceso Exxon se lleva a cabo a una presión de aproximadamente 30 MPa y a una temperatura de aproximadamente 160 a 180 °C. [dieciséis]
El proceso Shell utiliza complejos de cobalto modificados con ligandos de fosfina para la hidroformilación de olefinas C7-C14. Los aldehídos resultantes se hidrogenan directamente hasta los alcoholes grasos , que se separan por destilación , lo que permite reciclar el catalizador. El proceso tiene buena selectividad hacia los productos lineales, que se utilizan como materia prima para detergentes . El proceso se lleva a cabo a una presión de aproximadamente 4 a 8 MPa y en un rango de temperatura de aproximadamente 150 a 190 °C. [dieciséis]
El proceso Union Carbide (UCC), también conocido como proceso oxo de baja presión (LPO), se basa en un catalizador de rodio disuelto en aceite espeso de alto punto de ebullición, un producto de condensación de mayor peso molecular de los aldehídos primarios, para la hidroformilación del propeno. La mezcla de reacción se separa de los componentes volátiles en un evaporador de película descendente. La fase líquida se destila y se elimina el butiraldehído como producto de cabeza mientras que el catalizador que contiene el producto de fondo se recicla al proceso. El proceso se lleva a cabo a aproximadamente 1,8 MPa y entre 95 y 100 °C. [dieciséis]


El proceso Ruhrchemie/Rhone-Poulenc (RCRPP) se basa en un catalizador de rodio con TPPTS soluble en agua como ligando (catalizador de Kuntz Cornils) para la hidroformilación de propeno. [19] La trisulfonación del ligando trifenilfosfano proporciona propiedades hidrófilas al complejo organometálico. El complejo catalizador lleva nueve grupos sulfonato y es altamente soluble en agua (aproximadamente 1 kg L -1 ), pero no en la fase de producto emergente. [20] El TPPTS soluble en agua se utiliza en un exceso de aproximadamente 50 veces, con lo que se suprime eficazmente la lixiviación del catalizador. Los reactivos son propeno y gas de síntesis, compuestos de hidrógeno y monóxido de carbono en una proporción de 1,1:1. Se genera una mezcla de butiraldehído e isobutiraldehído en una proporción de 96:4 con pocos subproductos como alcoholes, ésteres y fracciones de punto de ebullición más alto. [20] El proceso Ruhrchemie/Rhone-Poulenc es el primer sistema de dos fases disponible comercialmente en el que el catalizador está presente en la fase acuosa. Durante el desarrollo de la reacción se forma una fase de producto orgánico, que se separa continuamente mediante separación de fases, permaneciendo la fase acuosa del catalizador en el reactor. [20]
El proceso se lleva a cabo en un reactor de tanque agitado donde la olefina y el gas de síntesis son retenidos [ se necesita clarificación ] desde el fondo del reactor a través de la fase de catalizador bajo agitación intensiva. La fase de aldehído bruta resultante se separa por la cabeza de la fase acuosa. La solución acuosa que contiene el catalizador se recalienta mediante un intercambiador de calor y se bombea de nuevo al reactor. [20] El exceso de olefina y gas de síntesis se separa de la fase de aldehído en un separador y se devuelve al reactor. El calor generado se utiliza para la generación de vapor de proceso, que se utiliza para la destilación posterior de la fase orgánica para separarla en butiraldehído e isobutiraldehído. [20] Los posibles venenos del catalizador provenientes del gas de síntesis migran a la fase orgánica y se eliminan de la reacción con el aldehído. De este modo no se produce acumulación de venenos en los catalizadores y se puede prescindir de la costosa purificación fina del gas de síntesis. [20]
En 1984 se construyó una planta en Oberhausen , que se descongestionó en 1988 y nuevamente en 1998 hasta alcanzar una capacidad de producción de 500.000 toneladas anuales de butanal. La tasa de conversión de propeno es del 98% y la selectividad hacia n-butanal es alta. Durante la vida útil de un lote de catalizador en el proceso se pierde menos de 1 ppb de rodio. [21]
Se han desarrollado recetas para la hidroformilación a escala de laboratorio, por ejemplo del ciclohexeno . [3] [14]
Los complejos de cobalto carbonilo y rodio catalizan la hidroformilación de formaldehído y óxido de etileno para dar hidroxiacetaldehído y 3-hidroxipropanal , que luego pueden hidrogenarse a etilenglicol y propano-1,3-diol , respectivamente. Las reacciones funcionan mejor cuando el disolvente es básico (como la piridina ). [22] [23]
En el caso del dicobalto octacarbonilo o el Co 2 (CO) 8 como catalizador, la pentan-3-ona puede surgir a partir de eteno y CO, en ausencia de hidrógeno. Un intermediario propuesto es la especie etileno-propionilo [CH 3 C(O)Co(CO) 3 (eteno)] que sufre una inserción migratoria para formar [CH 3 COCH 2 CH 2 Co(CO) 3 ]. El hidrógeno necesario surge de la reacción de desplazamiento del agua . Para obtener más información, consulte [24]
Si la reacción de desplazamiento de agua no es operativa, la reacción produce un polímero que contiene unidades alternas de monóxido de carbono y etileno. Estas policetonas alifáticas se preparan de forma más convencional utilizando catalizadores de paladio . [25]
Las olefinas funcionalizadas como el alcohol alílico pueden hidroformilarse. El producto objetivo 1,4-butanodiol y su isómero se obtienen con catalizadores libres de isomerización, como complejos de rodio-trifenilfosfina. El uso del complejo de cobalto conduce a la isomerización del doble enlace a n- propanal . [26] La hidroformilación de éteres alquenílicos y ésteres alquenílicos ocurre generalmente en la posición α con respecto a la función éter o éster.
La hidroformilación del ácido acrílico y del ácido metacrílico en el proceso catalizado por rodio conduce en el primer paso al producto de Markovnikov . [27] Mediante la variación de las condiciones de reacción, la reacción puede dirigirse a diferentes productos. Una alta temperatura de reacción y una baja presión de monóxido de carbono favorecen la isomerización del producto de Markovnikov al isómero β termodinámicamente más estable, lo que conduce al n-aldehído. Las bajas temperaturas y la alta presión de monóxido de carbono y un exceso de fosfina, que bloquea los sitios de coordinación libres, pueden conducir a una hidroformilación más rápida en la posición α del grupo éster y suprimir la isomerización. [27]
Las reacciones secundarias de los alquenos son la isomerización e hidrogenación del doble enlace. Mientras que los alcanos resultantes de la hidrogenación del doble enlace no participan más en la reacción, la isomerización del doble enlace con la posterior formación de los complejos n-alquilo es una reacción deseada. La hidrogenación suele ser de menor importancia; Sin embargo, los catalizadores modificados con cobalto-fosfina pueden tener una mayor actividad de hidrogenación, donde se hidrogena hasta un 15% del alqueno.
Una reacción consecutiva habitualmente deseada es la hidrogenación de los aldehídos a alcoholes. Las temperaturas más altas y las presiones parciales de hidrógeno favorecen la hidrogenación del aldehído resultante al alcohol. Para el mecanismo de reacción se cree que el aldehído forma inicialmente un complejo CO-π con el catalizador. Este se transpone al complejo de alcóxido y mediante la posterior adición oxidativa de hidrógeno se elimina el alcohol y se forma el complejo de partida.
El doble enlace aldehídico carbono-oxígeno también puede sufrir hidroformilación, lo que da lugar a ácido fórmico y sus ésteres. La reacción requiere la inserción de monóxido de carbono en el enlace oxígeno-metal del complejo alcóxido. El complejo de formilo resultante se puede convertir en ésteres de ácido fórmico y en el complejo de partida mediante adición oxidativa de hidrógeno. Los aldehídos inicialmente producidos pueden reaccionar posteriormente mediante condensación aldólica con precursores de producto objetivo como el 2-etilhexenal o con productos de condensación de mayor peso molecular, el llamado aceite espeso.
Las condiciones para la catálisis de hidroformilación pueden inducir la degradación de los ligandos organofosforados de soporte. La trifenilfosfina está sujeta a hidrogenólisis , liberando benceno y difenilfosfina. La inserción de monóxido de carbono en un enlace intermedio metal-fenilo puede conducir a la formación de benzaldehído o por hidrogenación posterior a alcohol bencílico . [28] Uno de los ligandos, grupos fenilo, puede ser reemplazado por propeno, y el ligando de difenilpropilfosfina resultante puede inhibir la reacción de hidroformilación debido a su mayor basicidad. [28]
{{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite web}}: Mantenimiento CS1: copia archivada como título ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite journal}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )