El pirilio es un catión ( ion positivo ) con fórmula C 5 H 5 O + , que consiste en un anillo de seis miembros de cinco átomos de carbono , cada uno con un átomo de hidrógeno y un átomo de oxígeno con carga positiva . Los enlaces en el anillo están conjugados como en el benceno , lo que le da un carácter aromático . En particular, debido a la carga positiva, el átomo de oxígeno es trivalente . El pirilio es un compuesto monocíclico y heterocíclico, uno de los iones oxonio .
Las sales de pirilio se producen fácilmente a partir de materiales de partida simples a través de una reacción de condensación . [2]
Las sales de pirilio con sustituyentes aromáticos, como el tetrafluoroborato de 2,4,6-trifenilpirilio, se pueden obtener a partir de dos moles de acetofenona , un mol de benzaldehído y un exceso de ácido tetrafluorobórico . [3] Para las sales de pirilio con sustituyentes de alquilo, como las sales de 2,4,6-trimetilpirilio, el mejor método utiliza la síntesis de Balaban - Nenitzescu -Praill a partir de butanol terciario y anhídrido acético en presencia de ácidos tetrafluorobórico, [4] perclórico, [5] o trifluorometanosulfónico. [6]
Las bases de hidróxido abren e hidrolizan la piridina a una base de endiona que se cicla en ácidos muy fuertes a un catión pirilio. [7]
Las condiciones de enolización (ácido fuerte) fuerzan a las pironas a convertirse en su tautómero de pirilio. [8]
El pirilio y sus derivados forman sales estables con una variedad de aniones. [9] [10] [11] [12] [13] [14]
Al igual que otros iones de oxonio , el pirilio es inestable en agua neutra. Sin embargo, el pirilio es mucho menos reactivo que los iones de oxonio ordinarios debido a la estabilización aromática. El oxígeno altamente electronegativo perturba fuertemente los orbitales en el anillo aromático, y los derivados de pirilio son extremadamente resistentes a la sustitución aromática electrofílica . Los cationes de pirilio reaccionan con nucleófilos en las posiciones orto y para , típicamente a través de ANRORC . [15]
Las sales de 2,4,6-trifenilpirilio se convierten mediante bases de hidróxido en una 1,5-enediona estable (pseudobase), pero las sales de 2,4,6-trimetilpirilio tratadas con hidróxidos alcalinos calientes producen una pseudobase inestable que sufre una condensación intramolecular que produce 3,5- dimetilfenol . En óxido de deuterio caliente, las sales de 2,4,6-trimetilpirilio experimentan un intercambio isotópico de hidrógenos de 4-metilo más rápido que los grupos 2- y 6-metilo, lo que permite la síntesis de compuestos deuterados regioselectivamente. [ cita requerida ]
La electrofilicidad del pirilio lo convierte en un material útil para producir otros compuestos con un carácter aromático más fuerte. Las sales de pirilio producen piridinas con amoníaco , [16] sales de piridinio con aminas primarias, piridina- N -óxidos con hidroxilamina , fosfabencenos con derivados de fosfina , sales de tiopirilio con sulfuro de hidrógeno y derivados de benceno con acetonitrilo o nitrometano .
Muchos cationes importantes se derivan formalmente del pirilio mediante la sustitución de varios grupos funcionales por algunos o todos los hidrógenos en el anillo. El 2,4,6-trifenilpirilio reacciona con aminas primarias para dar derivados de piridinio llamados "sales de Katritzky "; se utilizan comúnmente en el desplazamiento nucleofílico catalizado por metales de la amina. [15]
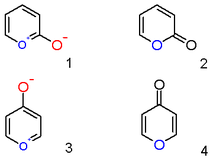
Un catión pirilio con un anión hidroxilo sustituyente en la posición 2 no es el compuesto aromático zwitteriónico ( 1 ), sino la lactona neutra insaturada 2-pirona o piran-2-ona ( 2 ). Representantes importantes de esta clase son las cumarinas . Asimismo, un compuesto de pirilio 4-hidroxilo es una γ-pirona o piran-4-ona ( 4 ), grupo al que pertenecen compuestos como el maltol .
Se sabe que las 2-pironas reaccionan con alquinos en una reacción de Diels-Alder para formar compuestos de areno con expulsión de dióxido de carbono , por ejemplo: [17]


Un ion bicíclico de pirilio se llama ion benzopirilio ( IUPAC : ion cromenilio) (fórmula: C 9 H 7 O + , masa molar: 131,15 g/mol, masa exacta: 131,04968983). Puede verse como un derivado cargado de 2 H -1- benzopirano (IUPAC: 2 H -cromeno, C 9 H 8 O ), o un derivado heterocíclico sustituido (cargado) de naftaleno ( C 10 H 8 ).

En biología, el ion 2-fenilbenzopirilio (2-fenilcromenilio) se denomina flavilio . Una clase de compuestos derivados del flavilio son las antocianidinas y las antocianinas , pigmentos responsables de los colores de muchas flores. [ cita requerida ]

También existen derivados policíclicos superiores del pirilio. Un buen ejemplo es el naftoxantenio. Este colorante es muy estable, aromático y plano. Absorbe en la región ultravioleta y azul y presenta propiedades fotofísicas excepcionales. Puede sintetizarse mediante reacciones químicas o fotoquímicas. [18]