Redox ( / ˈ r ɛ d ɒ k s / RED -oks , / ˈ r iː d ɒ k s / REE -doks , reducción -oxidación [2] u oxidación-reducción [3] : 150 ) es un tipo de reacción química en la que cambian los estados de oxidación de los reactivos . [4] La oxidación es la pérdida de electrones o un aumento en el estado de oxidación, mientras que la reducción es la ganancia de electrones o una disminución en el estado de oxidación. Los procesos de oxidación y reducción ocurren simultáneamente en la reacción química.
Hay dos clases de reacciones redox:
"Redox" es una combinación de las palabras "REDuction" y "OXidation". El término "redox" se utilizó por primera vez en 1928. [6]
La oxidación es un proceso en el que una sustancia pierde electrones. La reducción es un proceso en el que una sustancia gana electrones.
Los procesos de oxidación y reducción ocurren simultáneamente y no pueden ocurrir de forma independiente. [5] En los procesos redox, el reductor transfiere electrones al oxidante. Así, en la reacción, el agente reductor o reductor pierde electrones y se oxida, y el oxidante o agente oxidante gana electrones y se reduce. El par de un agente oxidante y reductor que interviene en una reacción particular se denomina par redox. Un par redox es una especie reductora y su forma oxidante correspondiente, [7] p. ej., Fe2+/ Fe3+La oxidación sola y la reducción sola se denominan semirreacción porque dos semirreacciones siempre ocurren juntas para formar una reacción completa. [5]
En las reacciones electroquímicas, los procesos de oxidación y reducción ocurren simultáneamente pero están separados en el espacio.
La oxidación implicaba originalmente una reacción con el oxígeno para formar un óxido. Más tarde, el término se amplió para abarcar sustancias que realizaban reacciones químicas similares a las del oxígeno. Finalmente, el significado se generalizó para incluir todos los procesos que implican la pérdida de electrones o el aumento del estado de oxidación de una especie química. [8] : A49 Las sustancias que tienen la capacidad de oxidar otras sustancias (hacer que pierdan electrones) se dice que son oxidativas u oxidantes, y se conocen como agentes oxidantes , oxidantes u oxidantes. El oxidante elimina electrones de otra sustancia y, por lo tanto, se reduce a sí mismo. [8] : A50 Debido a que "acepta" electrones, el agente oxidante también se denomina aceptor de electrones . Los oxidantes suelen ser sustancias químicas con elementos en estados de oxidación altos [3] : 159 (p. ej., N
2Oh
4, MnO−
4, Cromo
3, Cr
2Oh2−
7, OsO4), o bien elementos altamente electronegativos (por ejemplo, O 2 , F 2 , Cl 2 , Br 2 , I 2 ) que pueden ganar electrones adicionales al oxidar otra sustancia. [3] : 909
Los oxidantes son sustancias oxidantes, pero el término se reserva principalmente para las fuentes de oxígeno, en particular en el contexto de las explosiones. El ácido nítrico es un oxidante fuerte. [9]

Las sustancias que tienen la capacidad de reducir otras sustancias (hacer que ganen electrones) se dice que son reductoras o reductoras y se conocen como agentes reductores , reductores o reductores. El reductor transfiere electrones a otra sustancia y, por lo tanto, se oxida a sí mismo. [3] : 159 Debido a que dona electrones, el agente reductor también se llama donador de electrones . Los donadores de electrones también pueden formar complejos de transferencia de carga con aceptores de electrones. La palabra reducción originalmente se refería a la pérdida de peso al calentar un mineral metálico como un óxido de metal para extraer el metal. En otras palabras, el mineral se "reducía" a metal. [10] Antoine Lavoisier demostró que esta pérdida de peso se debía a la pérdida de oxígeno como gas. Más tarde, los científicos se dieron cuenta de que el átomo de metal gana electrones en este proceso. El significado de reducción luego se generalizó para incluir todos los procesos que involucran una ganancia de electrones. [10] El equivalente reductor se refiere a las especies químicas que transfieren el equivalente de un electrón en reacciones redox. El término es común en bioquímica . [11] Un equivalente reductor puede ser un electrón o un átomo de hidrógeno como un ion hidruro . [12]
Los reductores en química son muy diversos. Los metales elementales electropositivos , como el litio , el sodio , el magnesio , el hierro , el cinc y el aluminio , son buenos agentes reductores. Estos metales donan electrones con relativa facilidad. [13]
Los reactivos de transferencia de hidruro, como NaBH 4 y LiAlH 4 , reducen por transferencia de átomos: transfieren el equivalente de hidruro o H − . Estos reactivos se utilizan ampliamente en la reducción de compuestos carbonílicos a alcoholes . [14] [15] Un método de reducción relacionado implica el uso de gas hidrógeno (H 2 ) como fuente de átomos de H. [3] : 288
El electroquímico John Bockris propuso las palabras electronización y deselectronización para describir los procesos de reducción y oxidación, respectivamente, cuando ocurren en los electrodos . [16] Estas palabras son análogas a protonación y desprotonación . [17] No han sido ampliamente adoptadas por los químicos de todo el mundo, [ cita requerida ] aunque la IUPAC ha reconocido los términos electronización [18] y deselectronización. [19]
Las reacciones redox pueden ocurrir lentamente, como en la formación de óxido , o rápidamente, como en el caso de la quema de combustible . Las reacciones de transferencia de electrones son generalmente rápidas y ocurren dentro del tiempo de mezcla. [20]
Los mecanismos de las reacciones de transferencia de átomos son muy variables porque se pueden transferir muchos tipos de átomos. Estas reacciones también pueden ser bastante complejas e implicar muchos pasos. Los mecanismos de las reacciones de transferencia de electrones se producen por dos vías distintas: la transferencia de electrones de la esfera interna [21] y la transferencia de electrones de la esfera externa [22] .
El análisis de las energías de enlace y de las energías de ionización en el agua permite calcular los aspectos termodinámicos de las reacciones redox. [23]
Cada semirreacción tiene un potencial de electrodo estándar ( Eo
célula), que es igual a la diferencia de potencial o voltaje en equilibrio en condiciones estándar de una celda electroquímica en la que la reacción del cátodo es la semirreacción considerada, y el ánodo es un electrodo de hidrógeno estándar donde se oxida el hidrógeno: [24]
El potencial de electrodo de cada semirreacción también se conoce como su potencial de reducción ( Eo
rojo), o potencial cuando la semirreacción tiene lugar en un cátodo. El potencial de reducción es una medida de la tendencia del agente oxidante a reducirse. Su valor es cero para H + + e − → 1 ⁄ 2 H 2 por definición, positivo para agentes oxidantes más fuertes que H + (p. ej., +2,866 V para F 2 ) y negativo para agentes oxidantes que son más débiles que H + (p. ej., −0,763 V para Zn 2+ ). [8] : 873
Para una reacción redox que tiene lugar en una célula, la diferencia de potencial es:
Sin embargo, el potencial de la reacción en el ánodo a veces se expresa como potencial de oxidación :
El potencial de oxidación es una medida de la tendencia del agente reductor a oxidarse, pero no representa el potencial físico en un electrodo. Con esta notación, la ecuación de voltaje de la celda se escribe con un signo más

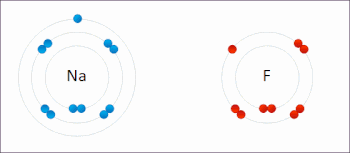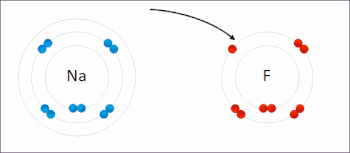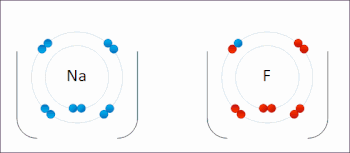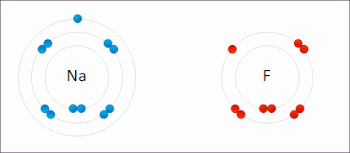
En la reacción entre hidrógeno y flúor , el hidrógeno se oxida y el flúor se reduce:
Esta reacción espontánea libera 542 kJ por cada 2 g de hidrógeno porque el enlace HF es mucho más fuerte que el enlace FF. Esta reacción se puede analizar como dos semirreacciones . La reacción de oxidación convierte el hidrógeno en protones :
La reacción de reducción convierte el flúor en el anión fluoruro:
Las semireacciones se combinan de manera que los electrones se cancelan:
Los protones y el fluoruro se combinan para formar fluoruro de hidrógeno en una reacción no redox:
La reacción general es:

En este tipo de reacción, un átomo de metal en un compuesto o solución se reemplaza por un átomo de otro metal. Por ejemplo, el cobre se deposita cuando se coloca zinc metálico en una solución de sulfato de cobre (II) :
En la reacción anterior, el metal zinc desplaza al ion cobre(II) de la solución de sulfato de cobre, liberando así cobre metálico. La reacción es espontánea y libera 213 kJ por cada 65 g de zinc.
La ecuación iónica para esta reacción es:
Como dos semirreacciones , se ve que el zinc se oxida:
Y el cobre se reduce:


Una reacción de desproporción es aquella en la que una sola sustancia se oxida y se reduce a la vez. Por ejemplo, el ion tiosulfato con azufre en estado de oxidación +2 puede reaccionar en presencia de ácido para formar azufre elemental (estado de oxidación 0) y dióxido de azufre (estado de oxidación +4).
De esta manera, un átomo de azufre se reduce de +2 a 0, mientras que el otro se oxida de +2 a +4. [8] : 176
La protección catódica es una técnica que se utiliza para controlar la corrosión de una superficie metálica convirtiéndola en el cátodo de una celda electroquímica . Un método de protección simple conecta el metal protegido a un " ánodo de sacrificio " que se corroe con mayor facilidad para que actúe como ánodo . El metal de sacrificio, en lugar del metal protegido, se corroe. Una aplicación común de la protección catódica es en el acero galvanizado , en el que un revestimiento de zinc de sacrificio sobre las piezas de acero las protege de la oxidación. [ cita requerida ]
La oxidación se utiliza en una amplia variedad de industrias, como en la producción de productos de limpieza y la oxidación de amoníaco para producir ácido nítrico . [ cita requerida ]
Las reacciones redox son la base de las celdas electroquímicas, que pueden generar energía eléctrica o sustentar la electrosíntesis . Los minerales metálicos a menudo contienen metales en estados oxidados, como óxidos o sulfuros, de los cuales se extraen los metales puros mediante fundición a altas temperaturas en presencia de un agente reductor. El proceso de galvanoplastia utiliza reacciones redox para recubrir objetos con una capa fina de un material, como en las piezas de automóviles cromadas , la cubertería plateada , la galvanización y la joyería bañada en oro . [ cita requerida ]

Muchos procesos biológicos esenciales implican reacciones redox. Antes de que algunos de estos procesos puedan comenzar, es necesario asimilar el hierro del medio ambiente. [25]
La respiración celular , por ejemplo, consiste en la oxidación de la glucosa (C 6 H 12 O 6 ) a CO 2 y la reducción del oxígeno a agua . La ecuación resumida de la respiración celular es:
El proceso de respiración celular también depende en gran medida de la reducción de NAD + a NADH y de la reacción inversa (la oxidación de NADH a NAD + ). La fotosíntesis y la respiración celular son complementarias, pero la fotosíntesis no es la reacción inversa de la oxidorreducción en la respiración celular:
La energía biológica se almacena y se libera frecuentemente mediante reacciones redox. La fotosíntesis implica la reducción del dióxido de carbono en azúcares y la oxidación del agua en oxígeno molecular. La reacción inversa, la respiración, oxida los azúcares para producir dióxido de carbono y agua. Como pasos intermedios, los compuestos de carbono reducido se utilizan para reducir el dinucleótido de nicotinamida y adenina (NAD + ) a NADH, que luego contribuye a la creación de un gradiente de protones , que impulsa la síntesis de trifosfato de adenosina (ATP) y se mantiene mediante la reducción del oxígeno. En las células animales, las mitocondrias realizan funciones similares.
Las reacciones de radicales libres son reacciones redox que ocurren como parte de la homeostasis y la eliminación de microorganismos . En estas reacciones, un electrón se desprende de una molécula y luego se vuelve a unir casi instantáneamente. Los radicales libres son parte de las moléculas redox y pueden volverse dañinos para el cuerpo humano si no se vuelven a unir a la molécula redox o a un antioxidante .
El término estado redox se utiliza a menudo para describir el equilibrio de GSH/GSSG , NAD + /NADH y NADP + /NADPH en un sistema biológico como una célula u órgano . El estado redox se refleja en el equilibrio de varios conjuntos de metabolitos (p. ej., lactato y piruvato , beta-hidroxibutirato y acetoacetato ), cuya interconversión depende de estas proporciones. Los mecanismos redox también controlan algunos procesos celulares. Las proteínas redox y sus genes deben estar co-ubicados para la regulación redox según la hipótesis CoRR para la función del ADN en mitocondrias y cloroplastos .
Una amplia variedad de compuestos aromáticos se reducen enzimáticamente para formar radicales libres que contienen un electrón más que sus compuestos originales. En general, el donante de electrones es cualquiera de una amplia variedad de flavoenzimas y sus coenzimas . Una vez formados, estos radicales libres aniónicos reducen el oxígeno molecular a superóxido y regeneran el compuesto original sin cambios. La reacción neta es la oxidación de las coenzimas de la flavoenzima y la reducción del oxígeno molecular para formar superóxido. Este comportamiento catalítico se ha descrito como un ciclo inútil o ciclo redox.

Los minerales son generalmente derivados oxidados de los metales. El hierro se extrae en forma de magnetita (Fe 3 O 4 ). El titanio se extrae en forma de dióxido, normalmente en forma de rutilo (TiO 2 ). Estos óxidos deben reducirse para obtener los metales correspondientes, lo que a menudo se consigue calentando estos óxidos con carbono o monóxido de carbono como agentes reductores. Los altos hornos son los reactores en los que se combinan los óxidos de hierro y el coque (una forma de carbono) para producir hierro fundido. La principal reacción química que produce el hierro fundido es: [26]
Las reacciones de transferencia de electrones son fundamentales para una gran cantidad de procesos y propiedades en los suelos, y el potencial redox , cuantificado como Eh (potencial del electrodo de platino ( voltaje ) relativo al electrodo de hidrógeno estándar) o pe (análogo al pH como -log de la actividad electrónica), es una variable maestra, junto con el pH, que controla y es gobernada por las reacciones químicas y los procesos biológicos. Las primeras investigaciones teóricas con aplicaciones a los suelos inundados y la producción de arroz con cáscara fueron fundamentales para el trabajo posterior sobre los aspectos termodinámicos del redox y el crecimiento de las raíces de las plantas en los suelos. [27] El trabajo posterior se basó en esta base y la amplió para comprender las reacciones redox relacionadas con los cambios del estado de oxidación de los metales pesados, la pedogénesis y la morfología, la degradación y formación de compuestos orgánicos, la química de los radicales libres , la delimitación de humedales , la remediación del suelo y varios enfoques metodológicos para caracterizar el estado redox de los suelos. [28] [29]
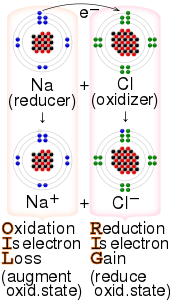
Los términos clave que intervienen en el proceso redox pueden ser confusos. [30] [31] Por ejemplo, un reactivo que se oxida pierde electrones; sin embargo, ese reactivo se denomina agente reductor. Del mismo modo, un reactivo que se reduce gana electrones y se denomina agente oxidante. [32] Los estudiantes suelen utilizar estos mnemónicos para memorizar la terminología: [33]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )Las reacciones homogéneas de transferencia de protones descritas son similares a las reacciones homogéneas de transferencia de electrones en que la reacción de transferencia de electrones general se puede descomponer en una reacción de electronización y una reacción de deselectronización.