
El ciclo del nitrógeno es el ciclo biogeoquímico mediante el cual el nitrógeno se convierte en múltiples formas químicas a medida que circula entre los ecosistemas atmosféricos , terrestres y marinos . La conversión de nitrógeno se puede llevar a cabo mediante procesos tanto biológicos como físicos. Los procesos importantes en el ciclo del nitrógeno incluyen la fijación , amonificación , nitrificación y desnitrificación . La mayor parte de la atmósfera de la Tierra (78%) es nitrógeno atmosférico , [16] lo que la convierte en la mayor fuente de nitrógeno. Sin embargo, el nitrógeno atmosférico tiene una disponibilidad limitada para uso biológico, lo que provoca una escasez de nitrógeno utilizable en muchos tipos de ecosistemas .
El ciclo del nitrógeno es de particular interés para los ecologistas porque la disponibilidad de nitrógeno puede afectar la tasa de procesos clave del ecosistema, incluida la producción primaria y la descomposición . Las actividades humanas como la quema de combustibles fósiles, el uso de fertilizantes nitrogenados artificiales y la liberación de nitrógeno en las aguas residuales han alterado drásticamente el ciclo global del nitrógeno . [17] [18] [19] La modificación humana del ciclo global del nitrógeno puede afectar negativamente el sistema ambiental natural y también la salud humana. [20] [21]
El nitrógeno está presente en el medio ambiente en una amplia variedad de formas químicas, incluido el nitrógeno orgánico, el amonio ( NH+4), nitrito ( NO−2), nitrato ( NO−3), óxido nitroso ( N 2 O ), óxido nítrico (NO) o gas nitrógeno inorgánico ( N 2 ). El nitrógeno orgánico puede encontrarse en forma de organismo vivo, humus o productos intermedios de la descomposición de la materia orgánica. Los procesos en el ciclo del nitrógeno consisten en transformar el nitrógeno de una forma a otra. Muchos de esos procesos son llevados a cabo por microbios , ya sea en su esfuerzo por recolectar energía o por acumular nitrógeno en la forma necesaria para su crecimiento. Por ejemplo, los desechos nitrogenados de la orina de los animales se descomponen mediante bacterias nitrificantes en el suelo para ser utilizados por las plantas. El diagrama al lado muestra cómo estos procesos encajan para formar el ciclo del nitrógeno.
La conversión del gas nitrógeno ( N 2 ) en nitratos y nitritos mediante procesos atmosféricos, industriales y biológicos se denomina fijación de nitrógeno. El nitrógeno atmosférico debe procesarse o " fijarse " en una forma utilizable para que las plantas lo absorban. Entre 5 y 10 mil millones de kg por año se fijan mediante rayos , pero la mayor parte de la fijación la realizan bacterias de vida libre o simbióticas conocidas como diazotrofas . Estas bacterias tienen la enzima nitrogenasa que combina nitrógeno gaseoso con hidrógeno para producir amoníaco , que la bacteria convierte en otros compuestos orgánicos . La mayor parte de la fijación biológica de nitrógeno se produce mediante la actividad de la molibdeno (Mo)-nitrogenasa, que se encuentra en una amplia variedad de bacterias y algunas arqueas . La mo-nitrogenasa es una enzima compleja de dos componentes que tiene múltiples grupos protésicos que contienen metales. [22] Un ejemplo de bacteria de vida libre es Azotobacter . Las bacterias simbióticas fijadoras de nitrógeno, como Rhizobium, suelen vivir en los nódulos de las raíces de las leguminosas (como los guisantes, la alfalfa y las langostas). Aquí forman una relación mutualista con la planta, produciendo amoníaco a cambio de carbohidratos . Debido a esta relación, las leguminosas a menudo aumentan el contenido de nitrógeno en los suelos pobres en nitrógeno. Algunas especies no leguminosas también pueden formar este tipo de simbiosis . Hoy en día, alrededor del 30% del nitrógeno fijado total se produce industrialmente mediante el proceso Haber-Bosch , [23] que utiliza altas temperaturas y presiones para convertir el gas nitrógeno y una fuente de hidrógeno (gas natural o petróleo) en amoníaco. [24]
Las plantas pueden absorber nitrato o amonio del suelo a través de los pelos de sus raíces. Si se absorbe nitrato, primero se reduce a iones nitrito y luego a iones amonio para su incorporación a aminoácidos, ácidos nucleicos y clorofila. En las plantas que tienen una relación simbiótica con los rizobios, parte del nitrógeno se asimila en forma de iones de amonio directamente de los nódulos. Ahora se sabe que existe un ciclo más complejo de aminoácidos entre los bacteroides de Rhizobia y las plantas. La planta proporciona aminoácidos a los bacteroides, por lo que no se requiere la asimilación de amoníaco y los bacteroides devuelven aminoácidos (con el nitrógeno recién fijado) a la planta, formando así una relación de interdependencia. [25] Mientras que muchos animales, hongos y otros organismos heterótrofos obtienen nitrógeno mediante la ingestión de aminoácidos , nucleótidos y otras moléculas orgánicas pequeñas, otros heterótrofos (incluidas muchas bacterias ) pueden utilizar compuestos inorgánicos, como el amonio, como única fuente de N. . La utilización de diversas fuentes de N está cuidadosamente regulada en todos los organismos.
Cuando una planta o un animal muere o un animal expulsa desechos, la forma inicial del nitrógeno es orgánica . Las bacterias u hongos convierten el nitrógeno orgánico de los restos en amonio ( NH+4), proceso llamado amonificación o mineralización . Las enzimas involucradas son:

La conversión de amonio en nitrato se realiza principalmente por bacterias que viven en el suelo y otras bacterias nitrificantes. En la etapa primaria de la nitrificación, la oxidación del amonio ( NH+4) lo realizan bacterias como la especie Nitrosomonas , que convierte el amoníaco en nitritos ( NO−2). Otras especies bacterianas como Nitrobacter , son responsables de la oxidación de los nitritos ( NO−2) en nitratos ( NO−3). Es importante que el amoníaco ( NH 3 ) se convierta en nitratos o nitritos porque el gas amoníaco es tóxico para las plantas.
Debido a su muy alta solubilidad y a que los suelos son muy incapaces de retener aniones , los nitratos pueden llegar a las aguas subterráneas . El nivel elevado de nitrato en el agua subterránea es una preocupación para el uso de agua potable porque el nitrato puede interferir con los niveles de oxígeno en la sangre de los bebés y causar metahemoglobinemia o síndrome del bebé azul. [28] Cuando el agua subterránea recarga el flujo de la corriente, el agua subterránea enriquecida con nitratos puede contribuir a la eutrofización , un proceso que conduce a una alta población y crecimiento de algas, especialmente poblaciones de algas verdiazules. Si bien no es directamente tóxico para los peces, como el amoníaco, el nitrato puede tener efectos indirectos en los peces si contribuye a esta eutrofización. El nitrógeno ha contribuido a graves problemas de eutrofización en algunas masas de agua. Desde 2006, la aplicación de fertilizantes nitrogenados ha estado cada vez más controlada en Gran Bretaña y Estados Unidos. Esto ocurre en la misma línea que el control de los fertilizantes fosfatados, cuya restricción normalmente se considera esencial para la recuperación de masas de agua eutrofiadas.
La desnitrificación es la reducción de los nitratos nuevamente a gas nitrógeno ( N
2), completando el ciclo del nitrógeno. Este proceso lo realizan especies bacterianas como Pseudomonas y Paracoccus , en condiciones anaeróbicas. Utilizan el nitrato como aceptor de electrones en lugar del oxígeno durante la respiración. Estas bacterias anaeróbicas facultativas (es decir, opcionales) también pueden vivir en condiciones aeróbicas. La desnitrificación ocurre en condiciones anaeróbicas, por ejemplo, suelos anegados. Las bacterias desnitrificantes utilizan los nitratos del suelo para realizar la respiración y, en consecuencia, producen gas nitrógeno, que es inerte y no está disponible para las plantas. La desnitrificación ocurre en microorganismos de vida libre, así como en simbiontes obligados de ciliados anaeróbicos. [29]
La reducción disimilatoria de nitrato a amonio (DNRA), o amonificación de nitrato/nitrito, es un proceso de respiración anaeróbica . Los microbios que realizan DNRA oxidan la materia orgánica y utilizan el nitrato como aceptor de electrones, reduciéndolo a nitrito y luego a amonio ( NO−3 → NO−2 → NH+4). [30] Tanto las bacterias desnitrificantes como las de amonificación de nitratos competirán por el nitrato en el medio ambiente, aunque la DNRA actúa para conservar el nitrógeno biodisponible como amonio soluble en lugar de producir gas dinitrógeno. [31]
El proceso de OX idación de AMM onía aeróbica también se conoce como proceso ANAMMOX , abreviatura acuñada al unir las primeras sílabas de cada una de estas tres palabras. Este proceso biológico es una reacción de comproporción redox , en la que el amoníaco (el agente reductor que da electrones) y el nitrito (el agente oxidante que acepta electrones) transfieren tres electrones y se convierten en una molécula de nitrógeno diatómico ( N) .
2) gas y dos moléculas de agua. Este proceso constituye una proporción importante de la conversión de nitrógeno en los océanos . La fórmula estequiométricamente equilibrada para la reacción química ANAMMOX se puede escribir de la siguiente manera, donde un ion amonio incluye la molécula de amoníaco, su base conjugada :
Se trata de un proceso exergónico (aquí también una reacción exotérmica ) que libera energía, como lo indica el valor negativo de Δ G °, la diferencia en energía libre de Gibbs entre los productos de la reacción y los reactivos.
Aunque la fijación de nitrógeno es la principal fuente de nitrógeno disponible para las plantas en la mayoría de los ecosistemas , en áreas con lecho rocoso rico en nitrógeno , la descomposición de esta roca también sirve como fuente de nitrógeno. [33] [34] [35] La reducción de nitrato también es parte del ciclo del hierro ; en condiciones anóxicas, el Fe (II) puede donar un electrón al NO.−3y se oxida a Fe(III) mientras que NO−3se reduce a NO−2, N 2 O, N 2 y NH+4dependiendo de las condiciones y especies microbianas involucradas. [36] Las columnas fecales de los cetáceos también actúan como una unión en el ciclo del nitrógeno marino, concentrando nitrógeno en las zonas epipelágicas de los ambientes oceánicos antes de su dispersión a través de varias capas marinas, lo que en última instancia mejora la productividad primaria oceánica. [37]
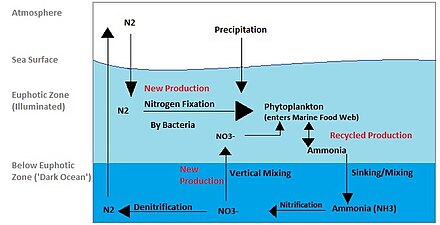


El ciclo del nitrógeno también es un proceso importante en el océano. Si bien el ciclo general es similar, existen diferentes actores [40] y modos de transferencia de nitrógeno en el océano. El nitrógeno ingresa al agua a través de la precipitación, escorrentía o como N
2de la atmósfera. El fitoplancton no puede utilizar el nitrógeno como N
2por lo que debe someterse a la fijación de nitrógeno, que se realiza predominantemente por cianobacterias . [41] Sin suministros de nitrógeno fijo que entren en el ciclo marino, el nitrógeno fijado se consumiría en unos 2000 años. [42] El fitoplancton necesita nitrógeno en formas biológicamente disponibles para la síntesis inicial de materia orgánica. El amoníaco y la urea se liberan al agua mediante la excreción del plancton. Las fuentes de nitrógeno se eliminan de la zona eufótica mediante el movimiento descendente de la materia orgánica. Esto puede ocurrir por hundimiento de fitoplancton, mezcla vertical o hundimiento de desechos de migradores verticales. El hundimiento da como resultado la introducción de amoníaco a menores profundidades debajo de la zona eufótica. Las bacterias pueden convertir el amoníaco en nitrito y nitrato, pero la luz las inhibe, por lo que esto debe ocurrir debajo de la zona eufótica. [43] La amonificación o mineralización la realizan bacterias para convertir el nitrógeno orgánico en amoníaco. Luego puede ocurrir la nitrificación para convertir el amonio en nitrito y nitrato. [44] El nitrato puede regresar a la zona eufótica mediante mezcla vertical y surgencia, donde puede ser absorbido por el fitoplancton para continuar el ciclo. norte
2Puede regresar a la atmósfera mediante desnitrificación .
Se cree que el amonio es la fuente preferida de nitrógeno fijo para el fitoplancton porque su asimilación no implica una reacción redox y, por lo tanto, requiere poca energía. El nitrato requiere una reacción redox para su asimilación pero es más abundante por lo que la mayoría del fitoplancton se ha adaptado para disponer de las enzimas necesarias para emprender esta reducción ( nitrato reductasa ). Hay algunas excepciones notables y bien conocidas que incluyen la mayoría de los Proclorococos y algunos Synechococcus que solo pueden absorber nitrógeno en forma de amonio. [42]
Los nutrientes del océano no están distribuidos uniformemente. Las áreas de afloramiento proporcionan suministros de nitrógeno desde debajo de la zona eufótica. Las zonas costeras proporcionan nitrógeno procedente de la escorrentía y las surgencias se producen fácilmente a lo largo de la costa. Sin embargo, la velocidad a la que el fitoplancton puede absorber nitrógeno disminuye en aguas oligotróficas durante todo el año y en aguas templadas en verano, lo que resulta en una menor producción primaria. [45] La distribución de las diferentes formas de nitrógeno también varía en los océanos.
El nitrato se agota en las aguas cercanas a la superficie, excepto en las regiones de afloramiento. Las regiones costeras de surgencia suelen tener altos niveles de nitrato y clorofila como resultado del aumento de la producción. Sin embargo, hay regiones con alto contenido de nitrato en la superficie pero bajo contenido de clorofila que se conocen como regiones HNLC (alto contenido de nitrógeno, bajo nivel de clorofila). La mejor explicación para las regiones HNLC se relaciona con la escasez de hierro en el océano, que puede desempeñar un papel importante en la dinámica oceánica y los ciclos de nutrientes. El aporte de hierro varía según la región y llega al océano a través del polvo (de las tormentas de polvo ) y se lixivia de las rocas. Se está considerando al hierro como el verdadero elemento limitante de la productividad de los ecosistemas en el océano.
El amonio y el nitrito muestran una concentración máxima entre 50 y 80 m (extremo inferior de la zona eufótica ) con una concentración decreciente por debajo de esa profundidad. Esta distribución puede explicarse por el hecho de que el nitrito y el amonio son especies intermedias. Ambos se producen y consumen rápidamente a través de la columna de agua. [42] La cantidad de amonio en el océano es aproximadamente 3 órdenes de magnitud menor que la del nitrato. [42] Entre el amonio, el nitrito y el nitrato, el nitrito tiene la tasa de rotación más rápida. Puede producirse durante la asimilación, nitrificación y desnitrificación de nitratos; sin embargo, inmediatamente se vuelve a consumir.
El nitrógeno que ingresa a la zona eufótica se denomina nitrógeno nuevo porque recién llega desde fuera de la capa productiva. [41] El nuevo nitrógeno puede provenir de debajo de la zona eufótica o de fuentes externas. Las fuentes externas provienen de aguas profundas y de la fijación de nitrógeno. Si la materia orgánica se come, se respira, se entrega al agua como amoníaco y el fitoplancton la reincorpora a la materia orgánica, se considera producción reciclada/regenerada.
La nueva producción es un componente importante del medio marino. Una razón es que sólo el aporte continuo de nitrógeno nuevo puede determinar la capacidad total del océano para producir una captura pesquera sostenible. [45] La captura de peces en zonas regeneradas con nitrógeno provocará una disminución del nitrógeno y, por tanto, una disminución de la producción primaria. Esto tendrá un efecto negativo en el sistema. Sin embargo, si se capturan peces en áreas con nitrógeno nuevo, éste se repondrá.
Como se ilustra en el diagrama de la derecha, el océano absorbe dióxido de carbono adicional (CO 2 ) y reacciona con el agua, el ácido carbónico ( H
2CO
3) se forma y se descompone en bicarbonato ( HCO−3) e hidrógeno ( H+) iones (flecha gris), lo que reduce el carbonato biodisponible ( CO2-3) y disminuye el pH del océano (flecha negra). Es probable que esto mejore la fijación de nitrógeno por parte de los diazótrofos (flecha gris), que utilizan H+
iones para convertir el nitrógeno en formas biodisponibles como el amoníaco ( NH
3) e iones de amonio ( NH+4). Sin embargo, a medida que el pH disminuye y se convierte más amoníaco en iones de amonio (flecha gris), hay menos oxidación de amoníaco a nitrito (NO–
2), lo que resulta en una disminución general de la nitrificación y desnitrificación (flechas negras). Esto, a su vez, conduciría a una mayor acumulación de nitrógeno fijado en el océano, con la posible consecuencia de eutrofización . Las flechas grises representan un aumento mientras que las flechas negras representan una disminución en el proceso asociado. [39]
.jpg/440px-Global_-_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_Fertilizer_Application_(6074011960).jpg)
.jpg/440px-Global_Global_Fertilizer_and_Manure,_Version_1_Nitrogen_in_Manure_Production_(6173194512).jpg)
Como resultado del cultivo extensivo de leguminosas (particularmente soja , alfalfa y trébol ), el uso cada vez mayor del proceso Haber-Bosch en la producción de fertilizantes químicos y la contaminación emitida por vehículos y plantas industriales, los seres humanos han duplicado con creces su consumo anual. transferencia de nitrógeno a formas biológicamente disponibles. [28] Además, los seres humanos han contribuido significativamente a la transferencia de gases traza de nitrógeno de la Tierra a la atmósfera y de la tierra a los sistemas acuáticos. Las alteraciones humanas en el ciclo global del nitrógeno son más intensas en los países desarrollados y en Asia, donde las emisiones de vehículos y la agricultura industrial son mayores. [46]
La generación de Nr, nitrógeno reactivo , se ha multiplicado por diez en el último siglo debido a la industrialización global . [2] [47] Esta forma de nitrógeno sigue una cascada a través de la biosfera a través de una variedad de mecanismos y se acumula a medida que la tasa de generación es mayor que la tasa de desnitrificación . [48]
Óxido nitroso ( norte
2O ) ha aumentado en la atmósfera como resultado de la fertilización agrícola, la quema de biomasa, el ganado y los corrales de engorde, y fuentes industriales. [49] norte
2El O tiene efectos nocivos en la estratosfera , donde se descompone y actúa como catalizador en la destrucción del ozono atmosférico . El óxido nitroso también es un gas de efecto invernadero y actualmente es el tercer mayor contribuyente al calentamiento global , después del dióxido de carbono y el metano . Si bien no es tan abundante en la atmósfera como el dióxido de carbono, es, para una masa equivalente, casi 300 veces más potente en su capacidad para calentar el planeta. [50]
Amoníaco ( NH
3) en la atmósfera se ha triplicado como resultado de las actividades humanas. Es un reactivo en la atmósfera, donde actúa como aerosol , disminuyendo la calidad del aire y adhiriéndose a las gotas de agua, lo que eventualmente resulta en ácido nítrico ( HNO3 ) que produce lluvia ácida . El amoníaco atmosférico y el ácido nítrico también dañan los sistemas respiratorios.
La temperatura muy alta de los rayos produce naturalmente pequeñas cantidades de NO
X, Nuevo Hampshire
3y HNO
3, pero la combustión a alta temperatura ha contribuido a un aumento de 6 o 7 veces en el flujo de NO
Xa la atmósfera. Su producción es función de la temperatura de combustión: cuanto mayor es la temperatura, más NO
Xes producido. La quema de combustibles fósiles es uno de los principales contribuyentes, pero también lo son los biocombustibles e incluso la quema de hidrógeno. Sin embargo, la velocidad a la que el hidrógeno se inyecta directamente en las cámaras de combustión de los motores de combustión interna se puede controlar para evitar las temperaturas de combustión más altas que producen NO.
X.
El amoníaco y los óxidos nitrosos alteran activamente la química atmosférica . Son precursores de la producción de ozono troposférico (atmósfera inferior), que contribuye al smog y la lluvia ácida , daña las plantas y aumenta los aportes de nitrógeno a los ecosistemas. Los procesos ecosistémicos pueden aumentar con la fertilización con nitrógeno , pero el aporte antropogénico también puede provocar una saturación de nitrógeno, lo que debilita la productividad y puede dañar la salud de las plantas, los animales, los peces y los seres humanos. [28]
También puede producirse una disminución de la biodiversidad si una mayor disponibilidad de nitrógeno aumenta los pastos que demandan nitrógeno, provocando una degradación de los brezales pobres en nitrógeno y con diversas especies . [51]

Se ha demostrado que los niveles crecientes de deposición de nitrógeno tienen una serie de efectos negativos en los ecosistemas tanto terrestres como acuáticos . [52] [53] Los gases y aerosoles de nitrógeno pueden ser directamente tóxicos para ciertas especies de plantas, afectando la fisiología aérea y el crecimiento de las plantas cerca de grandes fuentes puntuales de contaminación por nitrógeno. También pueden ocurrir cambios en las especies de plantas, a medida que la acumulación de compuestos de nitrógeno aumenta su disponibilidad en un ecosistema determinado, cambiando eventualmente la composición de las especies, la diversidad de las plantas y el ciclo del nitrógeno. El amoníaco y el amonio (dos formas reducidas de nitrógeno) pueden ser perjudiciales con el tiempo debido a una mayor toxicidad hacia especies de plantas sensibles, [54] particularmente aquellas que están acostumbradas a usar nitrato como fuente de nitrógeno, causando un desarrollo deficiente de sus raíces y dispara. El aumento de la deposición de nitrógeno también conduce a la acidificación del suelo, lo que aumenta la lixiviación de cationes básicos en el suelo y las cantidades de aluminio y otros metales potencialmente tóxicos, además de disminuir la cantidad de nitrificación que se produce y aumentar la basura derivada de las plantas. Debido a los cambios continuos causados por la alta deposición de nitrógeno, la susceptibilidad de un medio ambiente al estrés y las perturbaciones ecológicas (como plagas y patógenos ) puede aumentar, haciéndolo menos resistente a situaciones que de otro modo tendrían poco impacto en su vitalidad a largo plazo.
Los riesgos adicionales que plantea la mayor disponibilidad de nitrógeno inorgánico en los ecosistemas acuáticos incluyen la acidificación del agua; eutrofización de sistemas de agua dulce y salada; y problemas de toxicidad para los animales, incluidos los humanos. [55] La eutrofización a menudo conduce a niveles más bajos de oxígeno disuelto en la columna de agua, incluidas condiciones hipóxicas y anóxicas, que pueden causar la muerte de la fauna acuática. Los bentos relativamente sésiles, o criaturas que habitan en el fondo, son particularmente vulnerables debido a su falta de movilidad, aunque no son infrecuentes las grandes muertes de peces. Las zonas muertas oceánicas cerca de la desembocadura del Mississippi en el Golfo de México son un ejemplo bien conocido de hipoxia inducida por proliferación de algas . [56] [57] Los lagos Adirondack de Nueva York , Catskills , Hudson Highlands , Rensselaer Plateau y partes de Long Island muestran el impacto de la deposición de lluvia de ácido nítrico , lo que resulta en la muerte de peces y muchas otras especies acuáticas. [58]
Amoníaco ( NH
3) es muy tóxico para los peces y es necesario controlar estrechamente el nivel de amoníaco vertido en las instalaciones de tratamiento de aguas residuales . Para evitar la muerte de los peces, suele ser deseable la nitrificación mediante aireación antes de la descarga. La aplicación al suelo puede ser una alternativa atractiva a la aireación.
La fuga de Nr (nitrógeno reactivo) procedente de actividades humanas puede provocar la acumulación de nitrato en el entorno acuático natural, lo que puede generar impactos nocivos para la salud humana. El uso excesivo de fertilizantes nitrogenados en la agricultura ha sido una de las principales fuentes de contaminación por nitratos en las aguas subterráneas y superficiales. [59] [60] Debido a su alta solubilidad y baja retención por el suelo, el nitrato puede escapar fácilmente de la capa del subsuelo al agua subterránea, causando contaminación por nitrato. Algunas otras fuentes difusas de contaminación por nitratos en las aguas subterráneas se originan en la alimentación del ganado, la contaminación animal y humana y los desechos municipales e industriales. Dado que las aguas subterráneas suelen ser el principal suministro de agua para uso doméstico, la contaminación por nitratos puede extenderse desde las aguas subterráneas hasta las superficiales y potables en el proceso de producción de agua potable , especialmente en el caso de pequeños suministros de agua comunitarios, donde se utilizan aguas mal reguladas e insalubres. [61]
El estándar de la OMS para el agua potable es 50 mg de NO.−3L −1 para exposición a corto plazo y para 3 mg de NO−3L −1 efectos crónicos. [62] Una vez que ingresa al cuerpo humano, el nitrato puede reaccionar con compuestos orgánicos a través de reacciones de nitrosación en el estómago para formar nitrosaminas y nitrosamidas , que están involucradas en algunos tipos de cánceres (por ejemplo, cáncer oral y cáncer gástrico ). [63]
Las actividades humanas también han alterado drásticamente el ciclo global del nitrógeno mediante la producción de gases nitrógeno, asociado con la contaminación atmosférica global por nitrógeno. Existen múltiples fuentes de flujos de nitrógeno reactivo (Nr) atmosférico. Las fuentes agrícolas de nitrógeno reactivo pueden producir emisiones atmosféricas de amoniaco ( NH 3 ), óxidos de nitrógeno ( NO
X) y óxido nitroso ( norte
2O ). Los procesos de combustión en la producción de energía, el transporte y la industria también pueden dar lugar a la formación de nuevo nitrógeno reactivo mediante la emisión de NO.
X, un producto de desecho no intencionado. Cuando esos nitrógenos reactivos se liberan a la atmósfera inferior, pueden inducir la formación de smog, partículas y aerosoles, todos los cuales contribuyen de manera importante a los efectos adversos para la salud humana debido a la contaminación del aire. [64] En la atmósfera, NO
2se puede oxidar a ácido nítrico ( HNO
3), y puede reaccionar aún más con NH
3para formar nitrato de amonio ( NH 4 NO 3 ), que facilita la formación de nitrato particulado. Además, NH
3Puede reaccionar con otros gases ácidos ( ácidos sulfúrico y clorhídrico ) para formar partículas que contienen amonio, que son los precursores de las partículas de aerosol orgánico secundario en el smog fotoquímico . [sesenta y cinco]
{{cite web}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace ){{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )