Los sideróforos (del griego: "portadores de hierro") son compuestos quelantes de hierro pequeños y de alta afinidad que son secretados por microorganismos como bacterias y hongos. Ayudan al organismo a acumular hierro. [2] [3] [4] [5] Aunque ahora se está apreciando una gama cada vez más amplia de funciones de los sideróforos, [6] los sideróforos se encuentran entre los agentes aglutinantes de Fe 3+ más fuertes (de mayor afinidad) conocidos. Los fitosideróforos son sideróforos producidos por las plantas.
A pesar de ser uno de los elementos más abundantes en la corteza terrestre, el hierro no está fácilmente biodisponible. En la mayoría de los ambientes aeróbicos, como el suelo o el mar, el hierro existe en estado férrico (Fe 3+ ), que tiende a formar sólidos insolubles parecidos al óxido. Para que sean eficaces, los nutrientes no sólo deben estar disponibles, sino que deben ser solubles. [7] Los microbios liberan sideróforos para eliminar el hierro de estas fases minerales mediante la formación de complejos solubles de Fe 3+ que pueden ser absorbidos mediante mecanismos de transporte activo . Muchos sideróforos son péptidos no ribosómicos , [3] [8] aunque varios se biosintetizan de forma independiente. [9]
Los sideróforos también son importantes para algunas bacterias patógenas para la adquisición de hierro. [3] [4] [10] En los huéspedes mamíferos, el hierro está estrechamente unido a proteínas como la hemoglobina , la transferrina , la lactoferrina y la ferritina . La estricta homeostasis del hierro conduce a una concentración libre de aproximadamente 10 −24 mol L −1 , [11] por lo que existen grandes presiones evolutivas sobre las bacterias patógenas para obtener este metal. Por ejemplo, el patógeno del ántrax, Bacillus anthracis, libera dos sideróforos, bacilibactina y petrobactina , para eliminar los iones férricos de las proteínas que contienen hierro. Si bien se ha demostrado que la bacilibactina se une a la proteína siderocalina del sistema inmunológico , [12] se supone que la petrobactina evade el sistema inmunológico y se ha demostrado que es importante para la virulencia en ratones. [13]
Los sideróforos se encuentran entre los aglutinantes más fuertes del Fe 3+ conocidos, siendo la enterobactina uno de los más fuertes. [11] Debido a esta propiedad, han atraído el interés de la ciencia médica en la terapia de quelación de metales , y el sideróforo deferrioxamina B ha ganado un uso generalizado en tratamientos para el envenenamiento por hierro y la talasemia . [14]
Además de los sideróforos, algunas bacterias patógenas producen hemóforos ( proteínas eliminadoras de unión al hemo ) o tienen receptores que se unen directamente a las proteínas hierro/hemo. [15] En eucariotas, otras estrategias para mejorar la solubilidad y absorción del hierro son la acidificación del entorno (por ejemplo, utilizado por las raíces de las plantas) o la reducción extracelular de Fe 3+ en iones Fe 2+ más solubles .
Los sideróforos suelen formar un complejo octaédrico , hexadentado y estable , preferentemente con Fe 3+ en comparación con otros iones metálicos abundantes de origen natural, aunque si hay menos de seis átomos donantes, el agua también puede coordinarse. Los sideróforos más eficaces son aquellos que tienen tres ligandos bidentados por molécula, formando un complejo hexadentado y provocando un cambio entrópico menor que el provocado por la quelación de un solo ion férrico con ligandos separados. [16] Fe 3+ es un ácido de Lewis fuerte , prefiriendo bases de Lewis fuertes como átomos de oxígeno aniónicos o neutros para coordinarse. Los microbios suelen liberar el hierro del sideróforo mediante reducción a Fe 2+ , que tiene poca afinidad por estos ligandos. [8] [2]
Los sideróforos suelen clasificarse según los ligandos utilizados para quelar el hierro férrico. Los grupos principales de sideróforos incluyen los catecolatos (fenolatos), hidroxamatos y carboxilatos (por ejemplo, derivados del ácido cítrico ). [3] El ácido cítrico también puede actuar como sideróforo. [17] La amplia variedad de sideróforos puede deberse a presiones evolutivas ejercidas sobre los microbios para producir sideróforos estructuralmente diferentes que no pueden ser transportados por los sistemas de transporte activo específicos de otros microbios, o en el caso de patógenos desactivados por el organismo huésped. [3] [10]
Ejemplos de sideróforos producidos por diversas bacterias y hongos :
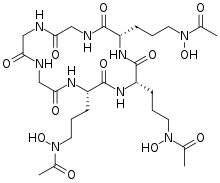





Sideróforos de hidroxamato
Sideróforos de catecolato
Ligandos mixtos
Ligandos de aminocarboxilato
En el Apéndice 1 se presenta una lista completa de estructuras de sideróforos (más de 250) como referencia. [3]
En respuesta a la limitación de hierro en su entorno, los genes implicados en la producción y absorción de sideróforos microbianos se desreprimen , lo que lleva a la fabricación de sideróforos y las proteínas de absorción apropiadas. En las bacterias, los represores dependientes de Fe 2+ se unen al ADN aguas arriba de los genes implicados en la producción de sideróforos en altas concentraciones de hierro intracelular. En concentraciones bajas, el Fe 2+ se disocia del represor, que a su vez se disocia del ADN, lo que conduce a la transcripción de los genes. En las bacterias gramnegativas y grampositivas ricas en AT, esto suele estar regulado por el represor Fur (regulador de la absorción férrica), mientras que en las bacterias grampositivas ricas en GC (p. ej., Actinomycetota ) es el DtxR (represor de la toxina diftérica), por lo que -La producción de la peligrosa toxina diftérica por parte de Corynebacterium diphtheriae también está regulada por este sistema. [8]
A esto le sigue la excreción del sideróforo al entorno extracelular, donde actúa para secuestrar y solubilizar el hierro. [3] [18] [19] [20] Los sideróforos son luego reconocidos por receptores celulares específicos en la membrana externa de la célula. [2] [3] [21] En hongos y otros eucariotas, el complejo Fe-sideróforo puede reducirse extracelularmente a Fe 2+ , mientras que en muchos casos todo el complejo Fe-sideróforo se transporta activamente a través de la membrana celular. En las bacterias gramnegativas, estos se transportan al periplasma a través de receptores dependientes de TonB y se transfieren al citoplasma mediante transportadores ABC . [3] [8] [16] [22]
Una vez en el citoplasma de la célula, el complejo Fe 3+ -sideróforo suele reducirse a Fe 2+ para liberar el hierro, especialmente en el caso de ligandos sideróforos "más débiles", como hidroxamatos y carboxilatos. La descomposición de los sideróforos u otros mecanismos biológicos también pueden liberar hierro, [16] especialmente en el caso de catecolatos como la enterobactina férrica, cuyo potencial de reducción es demasiado bajo para agentes reductores como el dinucleótido de flavina y adenina , por lo que se necesita una degradación enzimática para liberar el hierro. . [11]

Aunque hay suficiente hierro en la mayoría de los suelos para el crecimiento de las plantas, la deficiencia de hierro en las plantas es un problema en los suelos calcáreos , debido a la baja solubilidad del hidróxido de hierro (III) . Los suelos calcáreos representan el 30% de las tierras agrícolas del mundo. En tales condiciones, las plantas gramíneas (pastos, cereales y arroz) secretan fitosideróforos en el suelo, [23] un ejemplo típico es el ácido desoximuginéico. Los fitosideróforos tienen una estructura diferente a la de los sideróforos fúngicos y bacterianos que tienen dos centros de unión de α-aminocarboxilato, junto con una única unidad de α-hidroxicarboxilato. Esta última función bidentada proporciona a los fitosideróforos una alta selectividad por el hierro (III). Cuando se cultivan en un suelo deficiente en hierro, las raíces de las gramíneas secretan sideróforos a la rizosfera. Al eliminar el hierro (III), el complejo hierro-fitosideróforo se transporta a través de la membrana citoplasmática mediante un mecanismo de transporte de protones . [24] El complejo de hierro (III) luego se reduce a hierro (II) y el hierro se transfiere a nicotianamina , que aunque es muy similar a los fitosideróforos es selectiva para el hierro (II) y no es secretada por las raíces. [25] La nicotianamina transloca el hierro del floema a todas las partes de la planta.
El hierro es un nutriente importante para la bacteria Pseudomonas aeruginosa , sin embargo, el hierro no es fácilmente accesible en el medio ambiente. Para superar este problema, P. aeruginosa produce sideróforos para unir y transportar hierro. [26] Pero la bacteria que produjo los sideróforos no necesariamente recibe el beneficio directo de la ingesta de hierro. Más bien, todos los miembros de la población celular tienen la misma probabilidad de acceder a los complejos hierro-sideróforo. La producción de sideróforos también requiere que la bacteria gaste energía. Por tanto, la producción de sideróforos puede considerarse un rasgo altruista porque es beneficiosa para el grupo local pero costosa para el individuo. Esta dinámica altruista requiere que todos los miembros de la población celular contribuyan por igual a la producción de sideróforos. Pero a veces pueden ocurrir mutaciones que hacen que algunas bacterias produzcan menores cantidades de sideróforo. Estas mutaciones dan una ventaja evolutiva porque la bacteria puede beneficiarse de la producción de sideróforos sin sufrir el coste energético. Por lo tanto, se puede asignar más energía al crecimiento. Los miembros de la población celular que pueden producir eficientemente estos sideróforos se denominan comúnmente cooperadores; Los miembros que producen pocos o ningún sideróforo a menudo se denominan tramposos. [27] Las investigaciones han demostrado que cuando los cooperadores y los tramposos crecen juntos, los cooperadores tienen una disminución en su aptitud física, mientras que los tramposos tienen una mayor aptitud física. Se observa que la magnitud del cambio en la aptitud física aumenta al aumentar la limitación de hierro. [28] Con un aumento en la aptitud, los tramposos pueden superar a los cooperadores; esto conduce a una disminución general de la aptitud física del grupo, debido a la falta de producción suficiente de sideróforos.
En un estudio reciente, [29] se exploró la producción de pioverdina (PVD), un tipo de sideróforo, en la bacteria Pseudomonas aeruginosa . Este estudio se centró en la construcción, modelado y simulación dinámica de la biosíntesis de PVD, [30] un factor de virulencia, a través de un enfoque sistémico. Este enfoque considera que la vía metabólica de síntesis de PVD está regulada por el fenómeno de quorum-sensing (QS), un sistema de comunicación celular que permite a las bacterias coordinar su comportamiento en función de su densidad de población.
El estudio demostró que a medida que aumenta el crecimiento bacteriano, también aumenta la concentración extracelular de moléculas de señalización QS , emulando así el comportamiento natural de P. aeruginosa PAO1. Para llevar a cabo este estudio, se construyó un modelo de red metabólica de P. aeruginosa basado en el modelo iMO1056, la anotación genómica de la cepa PAO1 de P. aeruginosa y la vía metabólica de síntesis de PVD. Este modelo incluía la síntesis de PVD, reacciones de transporte, intercambio y moléculas de señalización QS.
El modelo resultante, denominado CCBM1146, [31] demostró que el fenómeno QS influye directamente en el metabolismo de P. aeruginosa hacia la biosíntesis de PVD en función del cambio en la intensidad de la señal QS. Este trabajo es el primer informe in silico de un modelo integrador que comprende la red reguladora del gen QS y la red metabólica de P. aeruginosa, proporcionando una vista detallada de cómo la producción de pioverdina y sideróforos en Pseudomonas aeruginosa está influenciada por la detección de quórum. fenómeno
Los sideróforos se vuelven importantes en el nicho ecológico definido por la baja disponibilidad de hierro, siendo el hierro uno de los factores críticos limitantes del crecimiento de prácticamente todos los microorganismos aeróbicos. Hay cuatro hábitats ecológicos principales: suelo y aguas superficiales, agua marina, tejido vegetal (patógenos) y tejido animal (patógenos).
El suelo es una rica fuente de géneros bacterianos y fúngicos. Las especies Gram positivas comunes son las pertenecientes a los Actinomycetales y especies de los géneros Bacillus , Arthrobacter y Nocardia . Muchos de estos organismos producen y secretan ferrioxaminas que promueven el crecimiento no solo de los organismos productores, sino también de otras poblaciones microbianas que pueden utilizar sideróforos exógenos. Los hongos del suelo incluyen Aspergillus y Penicillium y producen predominantemente ferricromos. Este grupo de sideróforos está formado por hexapéptidos cíclicos y, en consecuencia, son altamente resistentes a la degradación ambiental asociada con la amplia gama de enzimas hidrolíticas que están presentes en los suelos húmicos. [32] Los suelos que contienen material vegetal en descomposición poseen valores de pH tan bajos como 3-4. En tales condiciones, los organismos que producen sideróforos de hidroxamato tienen una ventaja debido a la extrema estabilidad ácida de estas moléculas. La población microbiana del agua dulce es similar a la del suelo; de hecho, muchas bacterias son eliminadas del suelo. Además, los lagos de agua dulce contienen grandes poblaciones de especies de Pseudomonas , Azomonas , Aeromonas y Alcaligenes . [33] A medida que los sideróforos se secretan al entorno, los depredadores bacterívoros, incluido Caenorhabditis elegans , pueden detectar los sideróforos, lo que resulta en la migración de los nematodos hacia la presa bacteriana. [34]
A diferencia de la mayoría de las fuentes de agua dulce, los niveles de hierro en la superficie del agua de mar son extremadamente bajos (1 nM a 1 μM en los 200 m superiores) y mucho más bajos que los de V, Cr, Co, Ni, Cu y Zn. Prácticamente todo este hierro está en estado de hierro (III) y forma complejos con ligandos orgánicos. [35] Estos bajos niveles de hierro limitan la producción primaria de fitoplancton y han llevado a la Hipótesis del Hierro [36] donde se propuso que una entrada de hierro promovería el crecimiento del fitoplancton y, por lo tanto, reduciría el CO 2 atmosférico . Esta hipótesis ha sido probada en más de 10 ocasiones diferentes y en todos los casos se produjeron floraciones masivas. Sin embargo, las floraciones persistieron durante períodos de tiempo variables. Una observación interesante hecha en algunos de estos estudios fue que la concentración de los ligandos orgánicos aumentó en un corto período de tiempo para igualar la concentración de hierro agregado, lo que implica un origen biológico y, en vista de su afinidad por el hierro, posiblemente sea un sideróforo. o naturaleza similar a un sideróforo. [37] Significativamente, también se encontró que las bacterias heterótrofas aumentaban notablemente en número en las floraciones inducidas por el hierro. Por tanto, existe el elemento de sinergismo entre el fitoplancton y las bacterias heterótrofas. El fitoplancton requiere hierro (proporcionado por los sideróforos bacterianos) y las bacterias heterótrofas requieren fuentes de carbono distintas del CO 2 (proporcionado por el fitoplancton).
La naturaleza diluida del ambiente marino pelágico promueve grandes pérdidas por difusión y hace que la eficiencia de las estrategias normales de absorción de hierro basadas en sideróforos sea problemática. Sin embargo, muchas bacterias marinas heterótrofas producen sideróforos, aunque con propiedades diferentes a las producidas por los organismos terrestres. Muchos sideróforos marinos son tensioactivos y tienden a formar agregados moleculares, por ejemplo, las acuaquelinas. La presencia de la cadena de acilo graso confiere a las moléculas una alta actividad superficial y capacidad para formar micelas . [38] Por lo tanto, cuando se secretan, estas moléculas se unen a las superficies y entre sí, lo que ralentiza la velocidad de difusión fuera del organismo secretor y mantiene una concentración de sideróforo local relativamente alta. El fitoplancton tiene altos requerimientos de hierro y, sin embargo, la mayoría (y posiblemente todos) no producen sideróforos. Sin embargo, el fitoplancton puede obtener hierro de complejos de sideróforos con la ayuda de reductasas unidas a membranas [39] y, ciertamente, del hierro (II) generado mediante la descomposición fotoquímica de sideróforos de hierro (III). Por tanto, una gran proporción del hierro (posiblemente todo el hierro) absorbido por el fitoplancton depende de la producción de sideróforos bacterianos. [40]


La mayoría de los patógenos vegetales invaden el apoplasma liberando enzimas pectolíticas que facilitan la propagación del organismo invasor. Las bacterias frecuentemente infectan las plantas ingresando al tejido a través de los estomas . Al entrar en la planta, se propagan y multiplican en los espacios intercelulares. En las enfermedades vasculares bacterianas, la infección se propaga dentro de las plantas a través del xilema .
Una vez dentro de la planta, las bacterias necesitan poder eliminar el hierro de los dos principales ligandos transportadores de hierro, la nicotianamina y el citrato. [41] Para ello producen sideróforos, por lo que la enterobacteria Erwinia chrysanthemi produce dos sideróforos, crisobactina y acromobactina. [42] El grupo de patógenos vegetales Xanthomonas produce sideróforos de xantoferrina para eliminar el hierro. [43]
Al igual que los humanos, las plantas también poseen proteínas de unión a sideróforos implicadas en la defensa del huésped, como el principal alérgeno del polen de abedul, Bet v 1 , que generalmente se secretan y poseen una estructura similar a la lipocalina . [40]
Las bacterias y hongos patógenos han desarrollado medios de supervivencia en los tejidos animales. Pueden invadir el tracto gastrointestinal ( Escherichia , Shigella y Salmonella ), el pulmón ( Pseudomonas , Bordetella , Streptococcus y Corynebacterium ), la piel ( Staphylococcus ) o el tracto urinario ( Escherichia y Pseudomonas ). Estas bacterias pueden colonizar las heridas ( Vibrio y Staphylococcus ) y ser responsables de la septicemia ( Yersinia y Bacillus ). Algunas bacterias sobreviven durante largos períodos de tiempo en orgánulos intracelulares, por ejemplo Mycobacterium . (ver tabla). Debido a este riesgo continuo de invasión bacteriana y fúngica, los animales han desarrollado una serie de líneas de defensa basadas en estrategias inmunológicas, el sistema del complemento, la producción de proteínas de unión al hierro y los sideróforos y la "retirada" general de hierro. [44]
Hay dos tipos principales de proteínas fijadoras de hierro presentes en la mayoría de los animales que brindan protección contra la invasión microbiana: la protección extracelular se logra mediante la familia de proteínas transferrina y la protección intracelular se logra mediante la ferritina. La transferrina está presente en el suero en aproximadamente 30 µM y contiene dos sitios de unión al hierro, cada uno con una afinidad extremadamente alta por el hierro. En condiciones normales, está saturado entre un 25% y un 40%, lo que significa que cualquier hierro disponible libremente en el suero será eliminado inmediatamente, evitando así el crecimiento microbiano. La mayoría de los sideróforos no pueden eliminar el hierro de la transferrina. Los mamíferos también producen lactoferrina, que es similar a la transferrina sérica pero posee una afinidad aún mayor por el hierro. [45] La lactoferrina está presente en los fluidos secretores, como el sudor, las lágrimas y la leche, minimizando así la infección bacteriana.
La ferritina está presente en el citoplasma de las células y limita el nivel de hierro intracelular a aproximadamente 1 μM. La ferritina es una proteína mucho más grande que la transferrina y es capaz de unir varios miles de átomos de hierro de forma no tóxica. Los sideróforos no pueden movilizar directamente el hierro de la ferritina.
Además de estas dos clases de proteínas fijadoras de hierro, una hormona, la hepcidina, participa en el control de la liberación de hierro de los enterocitos absorbentes, los hepatocitos que almacenan hierro y los macrófagos. [46] La infección provoca inflamación y liberación de interleucina-6 (IL-6), que estimula la expresión de hepcidina. En los seres humanos, la producción de IL-6 da como resultado niveles bajos de hierro sérico, lo que dificulta la infección de patógenos invasores. Se ha demostrado que tal agotamiento de hierro limita el crecimiento bacteriano tanto en localizaciones extracelulares como intracelulares. [44]
Además de las tácticas de "retirada de hierro", los mamíferos producen una proteína fijadora de sideróforos de hierro, la sideroquelina. La sideroquelina es un miembro de la familia de proteínas lipocalinas que, si bien tiene una secuencia diversa, muestra un pliegue estructural altamente conservado, un barril β antiparalelo de 8 hebras que forma un sitio de unión con varias hebras β adyacentes. La siderocalina (lipocalina 2) tiene 3 residuos cargados positivamente también ubicados en la bolsa hidrofóbica, y estos crean un sitio de unión de alta afinidad para el hierro (III)-enterobactina. [11] La siderocalina es un potente agente bacteriostático contra E. coli . Como resultado de la infección, es secretada tanto por macrófagos como por hepatocitos, y la enterobactina es eliminada del espacio extracelular.
Los sideróforos tienen aplicaciones en medicina para la terapia de sobrecarga de hierro y aluminio y antibióticos para mejorar la focalización. [10] [47] [3] La comprensión de las vías mecanísticas de los sideróforos ha generado oportunidades para diseñar inhibidores de moléculas pequeñas que bloquean la biosíntesis de los sideróforos y, por lo tanto, el crecimiento bacteriano y la virulencia en ambientes limitantes de hierro. [48] [49]
Los sideróforos son útiles como fármacos para facilitar la movilización del hierro en humanos, especialmente en el tratamiento de enfermedades del hierro, debido a su alta afinidad por el hierro. Una aplicación potencialmente poderosa es utilizar la capacidad de transporte de hierro de los sideróforos para transportar fármacos al interior de las células mediante la preparación de conjugados entre sideróforos y agentes antimicrobianos. Debido a que los microbios reconocen y utilizan sólo ciertos sideróforos, se prevé que dichos conjugados tengan actividad antimicrobiana selectiva. [10] [16] Un ejemplo es el antibiótico cefalosporínico cefiderocol . [50]
La administración de fármacos mediada por el transporte microbiano de hierro (sideróforos) utiliza el reconocimiento de los sideróforos como agentes de administración de hierro para que el microbio asimile los conjugados de sideróforos con los fármacos adjuntos. Estos fármacos son letales para el microbio y provocan que el microbio realice apoptosis cuando asimila el conjugado de sideróforo. [10] Mediante la adición de grupos funcionales de sideróforos que se unen al hierro en los antibióticos, su potencia ha aumentado considerablemente. Esto se debe al sistema de absorción de hierro de la bacteria mediado por sideróforos.
Las poáceas (pastos), incluidas especies de importancia agrícola como la cebada y el trigo, pueden secuestrar hierro de manera eficiente liberando fitosideróforos a través de sus raíces en la rizosfera del suelo circundante . [18] Los compuestos químicos producidos por microorganismos en la rizosfera también pueden aumentar la disponibilidad y absorción de hierro. Plantas como la avena son capaces de asimilar hierro a través de estos sideróforos microbianos. Se ha demostrado que las plantas son capaces de utilizar los sideróforos tipo hidroxamato ferricromo, ácido rodotorúlico y ferrioxamina B; los sideróforos de tipo catecol, la agrobactina; y los sideróforos de ligando mixto catecol-hidroxamato-hidroxiácido biosintetizados por bacterias saprofitas colonizadoras de raíces. Todos estos compuestos son producidos por cepas bacterianas rizosféricas, que tienen requisitos nutricionales simples y se encuentran en la naturaleza en suelos, follaje, agua dulce, sedimentos y agua de mar. [51]
Las pseudomonas fluorescentes han sido reconocidas como agentes de biocontrol contra ciertos patógenos vegetales transmitidos por el suelo. Producen pigmentos de color amarillo verdoso ( pioverdinas ) que emiten fluorescencia bajo luz ultravioleta y funcionan como sideróforos. Privan a los patógenos del hierro necesario para su crecimiento y patogénesis. [52]
Los sideróforos, naturales o sintéticos, pueden quelar iones metálicos distintos de los iones de hierro. Los ejemplos incluyen aluminio , [2] [21] [51] [53] galio , [2] [21] [51] [53] cromo , [21] [51] cobre , [21] [51] [53] zinc , [21] [53] plomo , [21] manganeso , [21] cadmio , [21] vanadio , [21] circonio , [54] indio , [21] [53] plutonio , [55] berkelio , californio , [ 56] y uranio . [55]
Los medios alternativos para asimilar el hierro son la reducción de la superficie, la disminución del pH, la utilización de hemo o la extracción de metales complejados con proteínas. [2] Datos recientes sugieren que las moléculas quelantes del hierro con propiedades similares a los sideróforos fueron producidas por bacterias marinas en condiciones de crecimiento limitantes de fosfato. En la naturaleza, el fosfato se une a diferentes tipos de minerales de hierro y, por lo tanto, se planteó la hipótesis de que las bacterias pueden usar moléculas similares a los sideróforos para disolver dicho complejo y poder acceder al fosfato. [57]
{{cite journal}}: Citar diario requiere |journal=( ayuda ){{cite journal}}: Citar diario requiere |journal=( ayuda ){{cite book}}: |journal=ignorado ( ayuda )