
El potencial de membrana (también llamado potencial transmembrana o voltaje de membrana ) es la diferencia de potencial eléctrico entre el interior y el exterior de una célula biológica . Es igual al potencial interior menos el potencial exterior. Esta es la energía (es decir, el trabajo ) por carga que se requiere para mover una carga positiva (muy pequeña) a velocidad constante a través de la membrana celular desde el exterior hacia el interior. (Si se permite que la carga cambie de velocidad, se debe tener en cuenta el cambio de energía cinética y la producción de radiación [1] ).
Los valores típicos del potencial de membrana, que normalmente se dan en unidades de milivoltios y se denotan como mV, varían de –80 mV a –40 mV. Para estos potenciales de membrana negativos típicos, se requiere trabajo positivo para mover una carga positiva del interior al exterior. Sin embargo, la energía cinética térmica permite que los iones superen la diferencia de potencial. Para una membrana selectivamente permeable, esto permite un flujo neto contra el gradiente. Esto es un tipo de ósmosis .
Todas las células animales están rodeadas por una membrana compuesta por una bicapa lipídica con proteínas incrustadas en ella. La membrana sirve tanto como aislante como barrera de difusión para el movimiento de iones . Las proteínas transmembrana , también conocidas como transportadoras de iones o proteínas de bomba de iones , empujan activamente los iones a través de la membrana y establecen gradientes de concentración a través de la membrana, y los canales iónicos permiten que los iones se muevan a través de la membrana a favor de esos gradientes de concentración. Las bombas de iones y los canales iónicos son eléctricamente equivalentes a un conjunto de baterías y resistencias insertadas en la membrana y, por lo tanto, crean un voltaje entre los dos lados de la membrana.
Todas las membranas plasmáticas tienen un potencial eléctrico a través de ellas, siendo el interior generalmente negativo con respecto al exterior. [2] El potencial de membrana tiene dos funciones básicas. En primer lugar, permite que una célula funcione como una batería, proporcionando energía para operar una variedad de "dispositivos moleculares" incrustados en la membrana. [3] En segundo lugar, en células eléctricamente excitables como las neuronas y las células musculares , se utiliza para transmitir señales entre diferentes partes de una célula.
Las señales se generan en las células excitables mediante la apertura o el cierre de canales iónicos en un punto de la membrana, lo que produce un cambio local en el potencial de membrana. Este cambio en el campo eléctrico puede ser detectado rápidamente por canales iónicos adyacentes o más distantes en la membrana. Esos canales iónicos pueden entonces abrirse o cerrarse como resultado del cambio de potencial, reproduciendo la señal.
En las células no excitables y en las excitables en sus estados basales, el potencial de membrana se mantiene en un valor relativamente estable, llamado potencial de reposo . Para las neuronas, el potencial de reposo se define como un rango de –80 a –70 milivoltios; es decir, el interior de una célula tiene un voltaje basal negativo de un poco menos de una décima parte de un voltio. La apertura y el cierre de los canales iónicos pueden inducir una desviación del potencial de reposo. Esto se denomina despolarización si el voltaje interior se vuelve menos negativo (por ejemplo, de –70 mV a –60 mV), o hiperpolarización si el voltaje interior se vuelve más negativo (por ejemplo, de –70 mV a –80 mV). En las células excitables, una despolarización suficientemente grande puede evocar un potencial de acción , en el que el potencial de membrana cambia rápidamente y significativamente durante un corto tiempo (del orden de 1 a 100 milisegundos), a menudo invirtiendo su polaridad. Los potenciales de acción se generan por la activación de ciertos canales iónicos dependientes del voltaje .
En las neuronas, los factores que influyen en el potencial de membrana son diversos. Entre ellos se incluyen numerosos tipos de canales iónicos, algunos de los cuales están regulados químicamente y otros están regulados por voltaje. Dado que los canales iónicos regulados por voltaje están controlados por el potencial de membrana, mientras que el potencial de membrana en sí está influido por estos mismos canales iónicos, surgen bucles de retroalimentación que permiten dinámicas temporales complejas, incluidas oscilaciones y eventos regenerativos como los potenciales de acción.
Las diferencias en las concentraciones de iones en lados opuestos de una membrana celular generan un voltaje llamado potencial de membrana . [4]
Muchos iones tienen un gradiente de concentración a través de la membrana, incluido el potasio (K + ), que se encuentra en una concentración alta dentro de la membrana y una concentración baja fuera de ella. Los iones sodio (Na + ) y cloruro (Cl− ) se encuentran en concentraciones altas en la región extracelular y bajas en las regiones intracelulares . Estos gradientes de concentración proporcionan la energía potencial para impulsar la formación del potencial de membrana. Este voltaje se establece cuando la membrana tiene permeabilidad a uno o más iones.
En el caso más simple, ilustrado en el diagrama superior ("Gradientes de concentración de iones"), si la membrana es selectivamente permeable al potasio, estos iones con carga positiva pueden difundirse a favor del gradiente de concentración hacia el exterior de la célula, dejando atrás cargas negativas sin compensar. Esta separación de cargas es lo que causa el potencial de membrana.
El sistema en su conjunto es electroneutral. Las cargas positivas no compensadas del exterior de la célula y las cargas negativas no compensadas del interior de la célula se alinean físicamente en la superficie de la membrana y se atraen entre sí a través de la bicapa lipídica . Por tanto, el potencial de membrana se encuentra físicamente sólo en las inmediaciones de la membrana. La separación de estas cargas a través de la membrana es la base del voltaje de membrana.
El diagrama superior es solo una aproximación de las contribuciones iónicas al potencial de membrana. Otros iones, como el sodio, el cloruro, el calcio y otros, desempeñan un papel menor, aunque tienen fuertes gradientes de concentración, porque tienen una permeabilidad más limitada que el potasio.
El potencial de membrana de una célula se deriva en última instancia de dos factores: la fuerza eléctrica y la difusión. La fuerza eléctrica surge de la atracción mutua entre partículas con cargas eléctricas opuestas (positivas y negativas) y la repulsión mutua entre partículas con el mismo tipo de carga (ambas positivas o ambas negativas). La difusión surge de la tendencia estadística de las partículas a redistribuirse desde regiones donde están altamente concentradas a regiones donde la concentración es baja.
El voltaje, que es sinónimo de diferencia de potencial eléctrico , es la capacidad de conducir una corriente eléctrica a través de una resistencia. De hecho, la definición más simple de un voltaje viene dada por la ley de Ohm : V = IR, donde V es voltaje, I es corriente y R es resistencia. Si se coloca una fuente de voltaje, como una batería, en un circuito eléctrico, cuanto mayor sea el voltaje de la fuente, mayor será la cantidad de corriente que conducirá a través de la resistencia disponible. El significado funcional del voltaje radica únicamente en las diferencias de potencial entre dos puntos de un circuito. La idea de un voltaje en un solo punto no tiene sentido. Es convencional en electrónica asignar un voltaje de cero a algún elemento elegido arbitrariamente del circuito y luego asignar voltajes para otros elementos medidos en relación con ese punto cero. No tiene importancia qué elemento se elige como punto cero: la función de un circuito depende únicamente de las diferencias, no de los voltajes per se . Sin embargo, en la mayoría de los casos y por convención, el nivel cero se asigna con mayor frecuencia a la parte de un circuito que está en contacto con tierra.
El mismo principio se aplica al voltaje en la biología celular. En un tejido eléctricamente activo, la diferencia de potencial entre dos puntos cualesquiera se puede medir insertando un electrodo en cada punto, por ejemplo, uno dentro y otro fuera de la célula, y conectando ambos electrodos a los cables de lo que en esencia es un voltímetro especializado. Por convención, el valor de potencial cero se asigna al exterior de la célula y el signo de la diferencia de potencial entre el exterior y el interior se determina por el potencial del interior en relación con el cero exterior.
En términos matemáticos, la definición de voltaje comienza con el concepto de campo eléctrico E , un campo vectorial que asigna una magnitud y dirección a cada punto del espacio. En muchas situaciones, el campo eléctrico es un campo conservativo , lo que significa que se puede expresar como el gradiente de una función escalar V , es decir, E = –∇ V . Este campo escalar V se conoce como distribución de voltaje. La definición permite una constante de integración arbitraria; por eso los valores absolutos de voltaje no son significativos. En general, los campos eléctricos se pueden tratar como conservativos solo si los campos magnéticos no los influyen significativamente, pero esta condición generalmente se aplica bien al tejido biológico.
Como el campo eléctrico es el gradiente de la distribución de voltaje, los cambios rápidos de voltaje dentro de una región pequeña implican un campo eléctrico intenso; por el contrario, si el voltaje permanece aproximadamente igual en una región grande, los campos eléctricos en esa región deben ser débiles. Un campo eléctrico intenso, equivalente a un gradiente de voltaje intenso, implica que se ejerce una fuerza intensa sobre cualquier partícula cargada que se encuentre dentro de la región.
Las señales eléctricas dentro de los organismos biológicos son, en general, impulsadas por iones . [6] Los cationes más importantes para el potencial de acción son el sodio (Na + ) y el potasio (K + ). [7] Ambos son cationes monovalentes que llevan una sola carga positiva. Los potenciales de acción también pueden involucrar calcio (Ca 2+ ), [8] que es un catión divalente que lleva una doble carga positiva. El anión cloruro (Cl − ) juega un papel importante en los potenciales de acción de algunas algas , [9] pero juega un papel insignificante en los potenciales de acción de la mayoría de los animales. [10]
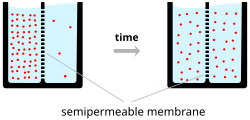
Los iones atraviesan la membrana celular bajo dos influencias: difusión y campos eléctricos . Un ejemplo sencillo en el que dos soluciones (A y B) están separadas por una barrera porosa ilustra que la difusión garantizará que finalmente se mezclen en soluciones iguales. Esta mezcla se produce debido a la diferencia en sus concentraciones. La región con alta concentración se difundirá hacia la región con baja concentración. Para ampliar el ejemplo, supongamos que la solución A tiene 30 iones de sodio y 30 iones de cloruro. Además, supongamos que la solución B tiene solo 20 iones de sodio y 20 iones de cloruro. Suponiendo que la barrera permite que ambos tipos de iones la atraviesen, se alcanzará un estado estable en el que ambas soluciones tendrán 25 iones de sodio y 25 iones de cloruro. Sin embargo, si la barrera porosa es selectiva con respecto a qué iones se dejan pasar, entonces la difusión por sí sola no determinará la solución resultante. Volviendo al ejemplo anterior, construyamos ahora una barrera que sea permeable solo a los iones de sodio. Ahora, solo el sodio puede difundirse a través de la barrera desde su concentración más alta en la solución A a la concentración más baja en la solución B. Esto dará como resultado una mayor acumulación de iones de sodio que de iones de cloruro en la solución B y una menor cantidad de iones de sodio que de iones de cloruro en la solución A.
Esto significa que hay una carga neta positiva en la solución B debido a la mayor concentración de iones de sodio con carga positiva que de iones de cloruro con carga negativa. Asimismo, hay una carga neta negativa en la solución A debido a la mayor concentración de iones de cloruro negativos que de iones de sodio positivos. Como las cargas opuestas se atraen y las cargas iguales se repelen, los iones ahora también están influenciados por campos eléctricos, así como por fuerzas de difusión. Por lo tanto, los iones de sodio positivos tendrán menos probabilidades de viajar a la solución B, ahora más positiva, y permanecer en la solución A, ahora más negativa. El punto en el que las fuerzas de los campos eléctricos contrarrestan por completo la fuerza debida a la difusión se denomina potencial de equilibrio. En este punto, el flujo neto del ion específico (en este caso, el sodio) es cero.

Cada célula está encerrada en una membrana plasmática , que tiene la estructura de una bicapa lipídica con muchos tipos de moléculas grandes incrustadas en ella. Debido a que está hecha de moléculas lipídicas, la membrana plasmática tiene intrínsecamente una alta resistividad eléctrica, en otras palabras, una baja permeabilidad intrínseca a los iones. Sin embargo, algunas de las moléculas incrustadas en la membrana son capaces de transportar activamente iones de un lado de la membrana al otro o de proporcionar canales a través de los cuales pueden moverse. [11]
En términos eléctricos, la membrana plasmática funciona como una combinación de resistencia y condensador . La resistencia surge del hecho de que la membrana impide el movimiento de cargas a través de ella. La capacitancia surge del hecho de que la bicapa lipídica es tan delgada que una acumulación de partículas cargadas en un lado da lugar a una fuerza eléctrica que atrae partículas con carga opuesta hacia el otro lado. La capacitancia de la membrana es relativamente poco afectada por las moléculas que están incrustadas en ella, por lo que tiene un valor más o menos invariante estimado en 2 μF/cm 2 (la capacitancia total de un parche de membrana es proporcional a su área). La conductancia de una bicapa lipídica pura es tan baja, por otro lado, que en situaciones biológicas siempre está dominada por la conductancia de vías alternativas proporcionadas por moléculas incrustadas. Por lo tanto, la capacitancia de la membrana es más o menos fija, pero la resistencia es muy variable.
Se estima que el espesor de una membrana plasmática es de unos 7-8 nanómetros. Debido a que la membrana es tan delgada, no se necesita un voltaje transmembrana muy grande para crear un campo eléctrico fuerte dentro de ella. Los potenciales de membrana típicos en las células animales son del orden de 100 milivoltios (es decir, una décima parte de un voltio), pero los cálculos muestran que esto genera un campo eléctrico cercano al máximo que la membrana puede soportar; se ha calculado que una diferencia de voltaje mucho mayor que 200 milivoltios podría causar una ruptura dieléctrica , es decir, la formación de un arco a través de la membrana.
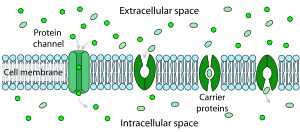
La resistencia de una bicapa lipídica pura al paso de iones a través de ella es muy alta, pero las estructuras incrustadas en la membrana pueden mejorar en gran medida el movimiento de iones, ya sea de forma activa o pasiva , a través de mecanismos llamados transporte facilitado y difusión facilitada . Los dos tipos de estructura que desempeñan los papeles más importantes son los canales iónicos y las bombas iónicas , ambos formados generalmente a partir de conjuntos de moléculas de proteína. Los canales iónicos proporcionan pasajes a través de los cuales los iones pueden moverse. En la mayoría de los casos, un canal iónico es permeable solo a tipos específicos de iones (por ejemplo, sodio y potasio, pero no cloruro o calcio), y a veces la permeabilidad varía dependiendo de la dirección del movimiento de iones. Las bombas de iones, también conocidas como transportadores de iones o proteínas transportadoras, transportan activamente tipos específicos de iones de un lado de la membrana al otro, a veces utilizando energía derivada de procesos metabólicos para hacerlo.
Las bombas de iones son proteínas integrales de membrana que realizan transporte activo , es decir, utilizan energía celular (ATP) para "bombear" los iones contra su gradiente de concentración. [12] Estas bombas de iones toman iones de un lado de la membrana (disminuyendo su concentración allí) y los liberan en el otro lado (aumentando su concentración allí).
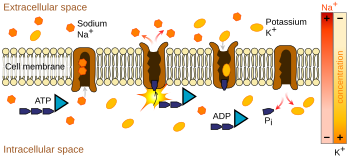
La bomba de iones más relevante para el potencial de acción es la bomba de sodio-potasio , que transporta tres iones de sodio fuera de la célula y dos iones de potasio dentro. [13] [14] Como consecuencia, la concentración de iones de potasio K + dentro de la neurona es aproximadamente 30 veces mayor que la concentración exterior, mientras que la concentración de sodio en el exterior es aproximadamente cinco veces mayor que en el interior. [14] [15] [16] De manera similar, otros iones tienen diferentes concentraciones dentro y fuera de la neurona, como el calcio , el cloruro y el magnesio . [16]
Si las cantidades de cada tipo de ion fueran iguales, la bomba de sodio-potasio sería eléctricamente neutra, pero, debido al intercambio de tres por dos, da un movimiento neto de una carga positiva desde el espacio intracelular al extracelular por cada ciclo, contribuyendo así a una diferencia de voltaje positiva. La bomba tiene tres efectos: (1) hace que la concentración de sodio sea alta en el espacio extracelular y baja en el espacio intracelular; (2) hace que la concentración de potasio sea alta en el espacio intracelular y baja en el espacio extracelular; (3) da al espacio intracelular un voltaje negativo con respecto al espacio extracelular.
La bomba de sodio y potasio funciona con relativa lentitud. Si se inicializara una célula con concentraciones iguales de sodio y potasio en todas partes, la bomba tardaría horas en alcanzar el equilibrio. La bomba funciona constantemente, pero se vuelve progresivamente menos eficiente a medida que se reducen las concentraciones de sodio y potasio disponibles para el bombeo.
Las bombas de iones influyen en el potencial de acción únicamente al establecer la relación relativa de las concentraciones de iones intracelulares y extracelulares. El potencial de acción implica principalmente la apertura y el cierre de los canales iónicos, no las bombas de iones. Si las bombas de iones se desactivan eliminando su fuente de energía o añadiendo un inhibidor como la ouabaína , el axón aún puede disparar cientos de miles de potenciales de acción antes de que sus amplitudes comiencen a decaer significativamente. [12] En particular, las bombas de iones no desempeñan un papel significativo en la repolarización de la membrana después de un potencial de acción. [7]
Otra bomba de iones funcionalmente importante es el intercambiador de sodio-calcio . Esta bomba funciona de una manera conceptualmente similar a la bomba de sodio-potasio, excepto que en cada ciclo intercambia tres Na + del espacio extracelular por un Ca ++ del espacio intracelular. Debido a que el flujo neto de carga es hacia adentro, esta bomba funciona "cuesta abajo", en efecto, y por lo tanto no requiere ninguna fuente de energía excepto el voltaje de la membrana. Su efecto más importante es bombear calcio hacia afuera; también permite un flujo hacia adentro de sodio, contrarrestando así la bomba de sodio-potasio, pero, debido a que las concentraciones generales de sodio y potasio son mucho más altas que las concentraciones de calcio, este efecto es relativamente poco importante. El resultado neto del intercambiador de sodio-calcio es que en el estado de reposo, las concentraciones intracelulares de calcio se vuelven muy bajas.

Los canales iónicos son proteínas de membrana integrales con un poro a través del cual los iones pueden viajar entre el espacio extracelular y el interior de la célula. La mayoría de los canales son específicos (selectivos) para un ion; por ejemplo, la mayoría de los canales de potasio se caracterizan por una relación de selectividad de 1000:1 para el potasio sobre el sodio, aunque los iones de potasio y sodio tienen la misma carga y difieren solo ligeramente en su radio. El poro del canal es típicamente tan pequeño que los iones deben pasar a través de él en orden de una sola fila. [18] Los poros del canal pueden estar abiertos o cerrados para el paso de iones, aunque varios canales muestran varios niveles de subconductancia. Cuando un canal está abierto, los iones permean a través del poro del canal a favor del gradiente de concentración transmembrana para ese ion en particular. La tasa de flujo iónico a través del canal, es decir, la amplitud de corriente de un solo canal, está determinada por la conductancia máxima del canal y la fuerza impulsora electroquímica para ese ion, que es la diferencia entre el valor instantáneo del potencial de membrana y el valor del potencial de inversión . [19]
Un canal puede tener varios estados diferentes (que corresponden a diferentes conformaciones de la proteína), pero cada uno de estos estados es abierto o cerrado. En general, los estados cerrados corresponden a una contracción del poro (que lo vuelve intransitable para el ion) o a una parte separada de la proteína que obstruye el poro. Por ejemplo, el canal de sodio dependiente de voltaje sufre una inactivación , en la que una parte de la proteína oscila hacia el poro y lo sella. [20] Esta inactivación interrumpe la corriente de sodio y desempeña un papel fundamental en el potencial de acción.
Los canales iónicos se pueden clasificar según cómo responden a su entorno. [21] Por ejemplo, los canales iónicos involucrados en el potencial de acción son canales sensibles al voltaje ; se abren y se cierran en respuesta al voltaje a través de la membrana. Los canales controlados por ligando forman otra clase importante; estos canales iónicos se abren y se cierran en respuesta a la unión de una molécula de ligando , como un neurotransmisor . Otros canales iónicos se abren y se cierran con fuerzas mecánicas. Aún otros canales iónicos, como los de las neuronas sensoriales, se abren y se cierran en respuesta a otros estímulos, como la luz, la temperatura o la presión.
Los canales de fuga son el tipo más simple de canal iónico, ya que su permeabilidad es más o menos constante. Los tipos de canales de fuga que tienen mayor importancia en las neuronas son los canales de potasio y de cloruro. Incluso estos no son perfectamente constantes en sus propiedades: primero, la mayoría de ellos dependen del voltaje en el sentido de que conducen mejor en una dirección que en la otra (en otras palabras, son rectificadores ); segundo, algunos de ellos pueden ser bloqueados por ligandos químicos aunque no requieran ligandos para funcionar.
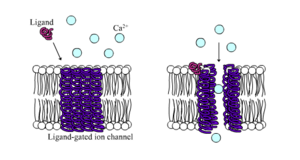
Los canales iónicos regulados por ligando son canales cuya permeabilidad aumenta considerablemente cuando algún tipo de ligando químico se une a la estructura de la proteína. Las células animales contienen cientos, si no miles, de tipos de estos. Un gran subconjunto funciona como receptores de neurotransmisores : se encuentran en sitios postsinápticos y el ligando químico que los regula es liberado por la terminal axónica presináptica . Un ejemplo de este tipo es el receptor AMPA , un receptor para el neurotransmisor glutamato que cuando se activa permite el paso de iones de sodio y potasio. Otro ejemplo es el receptor GABA A , un receptor para el neurotransmisor GABA que cuando se activa permite el paso de iones de cloruro.
Los receptores de neurotransmisores son activados por ligandos que aparecen en el área extracelular, pero existen otros tipos de canales controlados por ligandos que están controlados por interacciones en el lado intracelular.
Los canales iónicos dependientes del voltaje , también conocidos como canales iónicos dependientes del voltaje , son canales cuya permeabilidad está influenciada por el potencial de membrana. Forman otro grupo muy grande, en el que cada miembro tiene una selectividad iónica particular y una dependencia del voltaje particular. Muchos también dependen del tiempo; en otras palabras, no responden inmediatamente a un cambio de voltaje, sino solo después de un retraso.
Uno de los miembros más importantes de este grupo es un tipo de canal de sodio dependiente de voltaje que subyace a los potenciales de acción; a veces se los llama canales de sodio de Hodgkin-Huxley porque fueron caracterizados inicialmente por Alan Lloyd Hodgkin y Andrew Huxley en sus estudios sobre la fisiología del potencial de acción, que les valieron el Premio Nobel. El canal está cerrado en el nivel de voltaje en reposo, pero se abre abruptamente cuando el voltaje excede un cierto umbral, lo que permite una gran afluencia de iones de sodio que produce un cambio muy rápido en el potencial de membrana. La recuperación de un potencial de acción depende en parte de un tipo de canal de potasio dependiente de voltaje que está cerrado en el nivel de voltaje en reposo, pero se abre como consecuencia del gran cambio de voltaje producido durante el potencial de acción.
El potencial de inversión (o potencial de equilibrio ) de un ion es el valor del voltaje transmembrana en el que las fuerzas difusivas y eléctricas se equilibran, de modo que no hay flujo neto de iones a través de la membrana. Esto significa que el voltaje transmembrana se opone exactamente a la fuerza de difusión del ion, de modo que la corriente neta del ion a través de la membrana es cero y no cambia. El potencial de inversión es importante porque proporciona el voltaje que actúa sobre los canales permeables a ese ion; en otras palabras, proporciona el voltaje que genera el gradiente de concentración de iones cuando actúa como una batería .
El potencial de equilibrio de un ion particular se designa generalmente con la notación E ion . El potencial de equilibrio para cualquier ion se puede calcular utilizando la ecuación de Nernst . [22] Por ejemplo, el potencial de inversión para los iones de potasio será el siguiente:
dónde
Incluso si dos iones diferentes tienen la misma carga (es decir, K + y Na + ), pueden tener potenciales de equilibrio muy diferentes, siempre que sus concentraciones externas y/o internas difieran. Tomemos, por ejemplo, los potenciales de equilibrio del potasio y el sodio en las neuronas. El potencial de equilibrio del potasio, E K, es de −84 mV con 5 mM de potasio en el exterior y 140 mM en el interior. Por otro lado, el potencial de equilibrio del sodio, E Na , es de aproximadamente +66 mV con aproximadamente 12 mM de sodio en el interior y 140 mM en el exterior. [nota 1]
El potencial de membrana en reposo de una neurona cambia durante el desarrollo de un organismo. Para que una neurona adopte finalmente su función adulta completa, su potencial debe estar estrechamente regulado durante el desarrollo. A medida que un organismo progresa en el desarrollo, el potencial de membrana en reposo se vuelve más negativo. [23] Las células gliales también se diferencian y proliferan a medida que avanza el desarrollo en el cerebro . [24] La adición de estas células gliales aumenta la capacidad del organismo para regular el potasio extracelular . La caída del potasio extracelular puede provocar una disminución del potencial de membrana de 35 mV. [25]
La excitabilidad celular es el cambio en el potencial de membrana que es necesario para las respuestas celulares en varios tejidos. La excitabilidad celular es una propiedad que se induce durante la embriogénesis temprana. [26] La excitabilidad de una célula también se ha definido como la facilidad con la que se puede desencadenar una respuesta. [27] Los potenciales de reposo y umbral forman la base de la excitabilidad celular y estos procesos son fundamentales para la generación de potenciales graduados y de acción.
Los reguladores más importantes de la excitabilidad celular son las concentraciones de electrolitos extracelulares (es decir, Na + , K + , Ca 2+ , Cl − , Mg 2+ ) y las proteínas asociadas. Las proteínas importantes que regulan la excitabilidad celular son los canales iónicos dependientes de voltaje , los transportadores de iones (por ejemplo, Na+/K+-ATPasa , transportadores de magnesio , transportadores ácido-base ), los receptores de membrana y los canales dependientes de nucleótidos cíclicos activados por hiperpolarización . [28] Por ejemplo, los canales de potasio y los receptores sensibles al calcio son reguladores importantes de la excitabilidad en neuronas , miocitos cardíacos y muchas otras células excitables como los astrocitos . [29] El ion calcio también es el segundo mensajero más importante en la señalización celular excitable . La activación de los receptores sinápticos inicia cambios duraderos en la excitabilidad neuronal. [30] La tiroides , las hormonas suprarrenales y otras hormonas también regulan la excitabilidad celular; por ejemplo, la progesterona y el estrógeno modulan la excitabilidad de las células del músculo liso del miometrio .
Se considera que muchos tipos de células tienen una membrana excitable. Las células excitables son las neuronas, las células musculares ( cardíacas , esqueléticas , lisas ), las células endoteliales vasculares , los pericitos , las células yuxtaglomerulares , las células intersticiales de Cajal , muchos tipos de células epiteliales (p. ej. , células beta , células alfa , células delta , células enteroendocrinas , células neuroendocrinas pulmonares , pinealocitos ), las células gliales (p. ej., astrocitos), las células mecanorreceptoras (p. ej ., células ciliadas y células de Merkel ), las células quimiorreceptoras (p. ej. , células glómicas , receptores del gusto ), algunas células vegetales y posiblemente células inmunitarias . [31] Los astrocitos muestran una forma de excitabilidad no eléctrica basada en variaciones de calcio intracelular relacionadas con la expresión de varios receptores a través de los cuales pueden detectar la señal sináptica. En las neuronas, existen diferentes propiedades de membrana en algunas porciones de la célula, por ejemplo, la excitabilidad dendrítica otorga a las neuronas la capacidad de detectar coincidencias de entradas separadas espacialmente. [32]
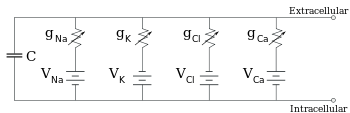
Los electrofisiólogos modelan los efectos de las diferencias de concentración iónica, los canales iónicos y la capacitancia de la membrana en términos de un circuito equivalente , que pretende representar las propiedades eléctricas de una pequeña porción de membrana. El circuito equivalente consta de un condensador en paralelo con cuatro vías, cada una de las cuales consta de una batería en serie con una conductancia variable. La capacitancia está determinada por las propiedades de la bicapa lipídica y se considera fija. Cada una de las cuatro vías paralelas proviene de uno de los iones principales, sodio, potasio, cloruro y calcio. El voltaje de cada vía iónica está determinado por las concentraciones del ion en cada lado de la membrana; consulte la sección Potencial de inversión anterior. La conductancia de cada vía iónica en cualquier momento está determinada por los estados de todos los canales iónicos que son potencialmente permeables a ese ion, incluidos los canales de fuga, los canales controlados por ligando y los canales iónicos controlados por voltaje.
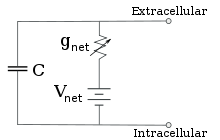
Para concentraciones fijas de iones y valores fijos de conductancia del canal iónico, el circuito equivalente se puede reducir aún más, utilizando la ecuación de Goldman como se describe a continuación, a un circuito que contiene una capacitancia en paralelo con una batería y conductancia. En términos eléctricos, este es un tipo de circuito RC (circuito de resistencia-capacitancia), y sus propiedades eléctricas son muy simples. A partir de cualquier estado inicial, la corriente que fluye a través de la conductancia o la capacitancia decae con un curso de tiempo exponencial, con una constante de tiempo de τ = RC , donde C es la capacitancia del parche de membrana y R = 1/g net es la resistencia neta. Para situaciones realistas, la constante de tiempo generalmente se encuentra en el rango de 1 a 100 milisegundos. En la mayoría de los casos, los cambios en la conductancia de los canales iónicos ocurren en una escala de tiempo más rápida, por lo que un circuito RC no es una buena aproximación; sin embargo, la ecuación diferencial utilizada para modelar un parche de membrana es comúnmente una versión modificada de la ecuación del circuito RC.
Cuando el potencial de membrana de una célula permanece durante un largo período de tiempo sin cambiar significativamente, se denomina potencial de reposo o voltaje de reposo. Este término se utiliza para el potencial de membrana de las células no excitables, pero también para el potencial de membrana de las células excitables en ausencia de excitación. En las células excitables, los otros estados posibles son los potenciales de membrana graduados (de amplitud variable) y los potenciales de acción, que son grandes aumentos de todo o nada en el potencial de membrana que generalmente siguen un curso temporal fijo. Las células excitables incluyen neuronas , células musculares y algunas células secretoras en glándulas . Sin embargo, incluso en otros tipos de células, el voltaje de membrana puede sufrir cambios en respuesta a estímulos ambientales o intracelulares. Por ejemplo, la despolarización de la membrana plasmática parece ser un paso importante en la muerte celular programada . [33]
Las interacciones que generan el potencial de reposo se modelan mediante la ecuación de Goldman [34] . Esta ecuación es similar en su forma a la ecuación de Nernst mostrada anteriormente, ya que se basa en las cargas de los iones en cuestión, así como en la diferencia entre sus concentraciones internas y externas. Sin embargo, también tiene en cuenta la permeabilidad relativa de la membrana plasmática a cada ion en cuestión.
Los tres iones que aparecen en esta ecuación son potasio (K + ), sodio (Na + ) y cloruro (Cl− ) . Se omite el calcio, pero se puede añadir para abordar situaciones en las que desempeña un papel importante. [35] Al ser un anión, los términos de cloruro se tratan de forma diferente a los términos de catión; la concentración intracelular está en el numerador y la concentración extracelular en el denominador, que es inverso a los términos de catión. P i representa la permeabilidad relativa del ion tipo i.
En esencia, la fórmula de Goldman expresa el potencial de membrana como un promedio ponderado de los potenciales de inversión para los tipos de iones individuales, ponderados por la permeabilidad. (Aunque el potencial de membrana cambia alrededor de 100 mV durante un potencial de acción, las concentraciones de iones dentro y fuera de la célula no cambian significativamente. Permanecen cerca de sus concentraciones respectivas cuando la membrana está en potencial de reposo). En la mayoría de las células animales, la permeabilidad al potasio es mucho mayor en estado de reposo que la permeabilidad al sodio. Como consecuencia, el potencial de reposo suele estar cerca del potencial de inversión del potasio. [36] [37] La permeabilidad al cloruro puede ser lo suficientemente alta como para ser significativa, pero, a diferencia de los otros iones, el cloruro no se bombea activamente y, por lo tanto, se equilibra a un potencial de inversión muy cercano al potencial de reposo determinado por los otros iones.
Los valores del potencial de membrana en reposo en la mayoría de las células animales suelen variar entre el potencial de inversión de potasio (normalmente alrededor de -80 mV) y alrededor de -40 mV. El potencial de reposo en células excitables (capaces de producir potenciales de acción) suele estar cerca de -60 mV (voltajes más despolarizados darían lugar a la generación espontánea de potenciales de acción). Las células inmaduras o indiferenciadas muestran valores de voltaje en reposo muy variables, normalmente significativamente más positivos que en las células diferenciadas. [38] En dichas células, el valor del potencial en reposo se correlaciona con el grado de diferenciación: las células indiferenciadas en algunos casos pueden no mostrar ninguna diferencia de voltaje transmembrana.
El mantenimiento del potencial de reposo puede ser metabólicamente costoso para una célula debido a su necesidad de bombeo activo de iones para contrarrestar pérdidas debido a canales de fuga. El costo es mayor cuando la función celular requiere un valor especialmente despolarizado de voltaje de membrana. Por ejemplo, el potencial de reposo en los fotorreceptores de la mosca azul adaptada a la luz del día ( Calliphora vicina ) puede ser tan alto como -30 mV. [39] Este potencial de membrana elevado permite que las células respondan muy rápidamente a las entradas visuales; el costo es que el mantenimiento del potencial de reposo puede consumir más del 20% del ATP celular total . [40]
Por otra parte, el alto potencial de reposo en células indiferenciadas no implica necesariamente un alto coste metabólico. Esta aparente paradoja se resuelve examinando el origen de ese potencial de reposo. Las células poco diferenciadas se caracterizan por una resistencia de entrada extremadamente alta, [38] lo que implica que hay pocos canales de fuga presentes en esta etapa de la vida celular. Como resultado aparente, la permeabilidad del potasio se vuelve similar a la de los iones de sodio, lo que coloca el potencial de reposo entre los potenciales de inversión para el sodio y el potasio, como se analizó anteriormente. Las corrientes de fuga reducidas también significan que hay poca necesidad de bombeo activo para compensar, por lo tanto, el coste metabólico es bajo.
Como se explicó anteriormente, el potencial en cualquier punto de la membrana de una célula está determinado por las diferencias de concentración de iones entre las áreas intracelulares y extracelulares, y por la permeabilidad de la membrana a cada tipo de ion. Las concentraciones de iones normalmente no cambian muy rápidamente (con la excepción del Ca 2+ , donde la concentración intracelular de referencia es tan baja que incluso un pequeño influjo puede aumentarla en órdenes de magnitud), pero las permeabilidades de los iones pueden cambiar en una fracción de milisegundo, como resultado de la activación de canales iónicos controlados por ligando. El cambio en el potencial de membrana puede ser grande o pequeño, dependiendo de cuántos canales iónicos se activen y de qué tipo sean, y puede ser largo o corto, dependiendo de la duración de los canales abiertos. Los cambios de este tipo se conocen como potenciales graduados , en contraste con los potenciales de acción, que tienen una amplitud y una evolución temporal fijas.
Como se puede deducir de la ecuación de Goldman mostrada arriba, el efecto de aumentar la permeabilidad de una membrana a un tipo particular de ion desplaza el potencial de membrana hacia el potencial de inversión para ese ion. Así, la apertura de los canales de Na + desplaza el potencial de membrana hacia el potencial de inversión de Na + , que suele estar alrededor de +100 mV. Del mismo modo, la apertura de los canales de K + desplaza el potencial de membrana hacia alrededor de –90 mV, y la apertura de los canales de Cl− lo desplaza hacia alrededor de –70 mV (potencial de reposo de la mayoría de las membranas). Así, los canales de Na + desplazan el potencial de membrana en una dirección positiva, los canales de K + lo desplazan en una dirección negativa (excepto cuando la membrana está hiperpolarizada a un valor más negativo que el potencial de inversión de K + ), y los canales de Cl− tienden a desplazarlo hacia el potencial de reposo.

Los potenciales de membrana graduados son particularmente importantes en las neuronas , donde son producidos por sinapsis (un cambio temporal en el potencial de membrana producido por la activación de una sinapsis por un único potencial graduado o de acción se denomina potencial postsináptico ). Los neurotransmisores que actúan para abrir los canales de Na + generalmente hacen que el potencial de membrana se vuelva más positivo, mientras que los neurotransmisores que activan los canales de K + generalmente hacen que se vuelva más negativo; aquellos que inhiben estos canales tienden a tener el efecto opuesto.
El hecho de que un potencial postsináptico se considere excitador o inhibidor depende del potencial de inversión de los iones de esa corriente y del umbral para que la célula dispare un potencial de acción (alrededor de -50 mV). Una corriente postsináptica con un potencial de inversión por encima del umbral, como una corriente típica de Na + , se considera excitadora. Una corriente con un potencial de inversión por debajo del umbral, como una corriente típica de K + , se considera inhibidora. Una corriente con un potencial de inversión por encima del potencial de reposo, pero por debajo del umbral, no provocará por sí misma potenciales de acción, pero producirá oscilaciones del potencial de membrana por debajo del umbral . Por lo tanto, los neurotransmisores que actúan para abrir los canales de Na + producen potenciales postsinápticos excitadores , o EPSP, mientras que los neurotransmisores que actúan para abrir los canales de K + o Cl− suelen producir potenciales postsinápticos inhibidores , o IPSP. Cuando varios tipos de canales están abiertos dentro del mismo período de tiempo, sus potenciales postsinápticos se suman (se suman).
Desde el punto de vista de la biofísica, el potencial de membrana en reposo es simplemente el potencial de membrana que resulta de las permeabilidades de membrana que predominan cuando la célula está en reposo. La ecuación anterior de promedios ponderados siempre se aplica, pero el siguiente enfoque puede visualizarse más fácilmente. En un momento dado, hay dos factores para un ion que determinan cuánta influencia tendrá ese ion sobre el potencial de membrana de una célula:
Si la fuerza impulsora es alta, el ion se "empuja" a través de la membrana. Si la permeabilidad es alta, será más fácil que el ion se difunda a través de la membrana.
Por lo tanto, en una membrana en reposo, aunque la fuerza impulsora del potasio es baja, su permeabilidad es muy alta. El sodio tiene una fuerza impulsora enorme, pero casi ninguna permeabilidad en reposo. En este caso, el potasio transporta aproximadamente 20 veces más corriente que el sodio y, por lo tanto, tiene 20 veces más influencia sobre Em que el sodio .
Sin embargo, consideremos otro caso: el pico del potencial de acción. Aquí, la permeabilidad al Na es alta y la permeabilidad al K es relativamente baja. Por lo tanto, la membrana se mueve cerca de E Na y lejos de E K .
Cuanto más permeables sean los iones, más complicado será predecir el potencial de membrana. Sin embargo, esto se puede hacer utilizando la ecuación de Goldman-Hodgkin-Katz o la ecuación de medias ponderadas. Al introducir los gradientes de concentración y las permeabilidades de los iones en cualquier instante del tiempo, se puede determinar el potencial de membrana en ese momento. Lo que significan las ecuaciones de GHK es que, en cualquier momento, el valor del potencial de membrana será un promedio ponderado de los potenciales de equilibrio de todos los iones permeables. La "ponderación" es la permeabilidad relativa de los iones a través de la membrana.
Mientras las células gastan energía para transportar iones y establecer un potencial transmembrana, utilizan este potencial a su vez para transportar otros iones y metabolitos como el azúcar. El potencial transmembrana de las mitocondrias impulsa la producción de ATP , que es la moneda común de la energía biológica.
Las células pueden aprovechar la energía que almacenan en el potencial de reposo para generar potenciales de acción u otras formas de excitación. Estos cambios en el potencial de membrana permiten la comunicación con otras células (como en el caso de los potenciales de acción) o inician cambios dentro de la célula, lo que sucede en un óvulo cuando es fecundado por un espermatozoide .
Los cambios en las propiedades dieléctricas de la membrana plasmática pueden actuar como un sello distintivo de enfermedades subyacentes como la diabetes y la dislipidemia. [41]
En las neuronas, un potencial de acción comienza con una avalancha de iones de sodio hacia el interior de la célula a través de los canales de sodio, lo que da lugar a la despolarización, mientras que la recuperación implica una avalancha de potasio hacia el exterior a través de los canales de potasio. Ambos flujos se producen por difusión pasiva .
Una dosis de sal puede hacer que las neuronas aún activas de un corte de carne fresco se activen, causando espasmos musculares. [42] [43] [44] [45] [46]