Los ciclos biogeoquímicos marinos son ciclos biogeoquímicos que ocurren dentro de ambientes marinos , es decir, en el agua salada de mares u océanos o en el agua salobre de estuarios costeros . Estos ciclos biogeoquímicos son las vías por las que se mueven las sustancias y elementos químicos dentro del ambiente marino. Además, las sustancias y elementos pueden ser importados o exportados desde el ambiente marino. Estas importaciones y exportaciones pueden ocurrir como intercambios con la atmósfera superior, el fondo oceánico inferior o como escorrentía desde la tierra.
Existen ciclos biogeoquímicos para los elementos calcio , carbono , hidrógeno , mercurio , nitrógeno , oxígeno , fósforo , selenio y azufre ; ciclos moleculares para el agua y el sílice ; ciclos macroscópicos como el ciclo de las rocas ; así como ciclos inducidos por el hombre para compuestos sintéticos como el bifenilo policlorado (PCB). En algunos ciclos hay depósitos donde una sustancia puede almacenarse durante mucho tiempo. El ciclo de estos elementos está interconectado.
Los organismos marinos , y en particular los microorganismos marinos , son cruciales para el funcionamiento de muchos de estos ciclos. Las fuerzas que impulsan los ciclos biogeoquímicos incluyen procesos metabólicos dentro de los organismos, procesos geológicos que involucran el manto de la Tierra, así como reacciones químicas entre las propias sustancias, razón por la cual se los llama ciclos biogeoquímicos. Si bien las sustancias químicas pueden descomponerse y recombinarse, los elementos químicos en sí mismos no pueden ser creados ni destruidos por estas fuerzas, por lo que, además de algunas pérdidas y ganancias desde el espacio exterior, los elementos se reciclan o almacenan (secuestran) en algún lugar sobre o dentro del planeta.
La energía fluye direccionalmente a través de los ecosistemas, entrando en forma de luz solar (o moléculas inorgánicas en el caso de los quimioautótrofos) y saliendo en forma de calor durante las numerosas transferencias entre niveles tróficos. Sin embargo, la materia que compone los organismos vivos se conserva y se recicla. Los seis elementos más comunes asociados con las moléculas orgánicas (carbono, nitrógeno, hidrógeno, oxígeno, fósforo y azufre) adoptan diversas formas químicas y pueden existir durante largos períodos en la atmósfera, en la tierra, en el agua o debajo de la superficie de la Tierra. Los procesos geológicos, como la meteorización, la erosión, el drenaje del agua y la subducción de las placas continentales, desempeñan un papel en este reciclaje de materiales. Dado que la geología y la química tienen papeles importantes en el estudio de este proceso, el reciclaje de materia inorgánica entre los organismos vivos y su entorno se denomina ciclo biogeoquímico. [1]
Los seis elementos mencionados anteriormente son utilizados por los organismos de diversas maneras. El hidrógeno y el oxígeno se encuentran en el agua y en las moléculas orgánicas, ambos esenciales para la vida. El carbono se encuentra en todas las moléculas orgánicas, mientras que el nitrógeno es un componente importante de los ácidos nucleicos y las proteínas. El fósforo se utiliza para fabricar los ácidos nucleicos y los fosfolípidos que forman las membranas biológicas. El azufre es fundamental para la forma tridimensional de las proteínas. El ciclo de estos elementos está interconectado. Por ejemplo, el movimiento del agua es fundamental para la lixiviación del azufre y el fósforo en los ríos, que luego pueden fluir hacia los océanos. Los minerales circulan a través de la biosfera entre los componentes bióticos y abióticos y de un organismo a otro. [2]

El agua es el medio de los océanos, el medio que transporta todas las sustancias y elementos involucrados en los ciclos biogeoquímicos marinos. El agua tal como se encuentra en la naturaleza casi siempre incluye sustancias disueltas, por lo que el agua ha sido descrita como el "disolvente universal" por su capacidad de disolver tantas sustancias. [3] [4] Esta capacidad le permite ser el " disolvente de la vida" . [5] El agua también es la única sustancia común que existe como sólido , líquido y gas en condiciones terrestres normales. [6] Como el agua líquida fluye, las aguas oceánicas circulan y circulan en corrientes alrededor del mundo. Como el agua cambia fácilmente de fase, puede ser transportada a la atmósfera como vapor de agua o congelada como un iceberg. Luego puede precipitarse o fundirse para convertirse nuevamente en agua líquida. Toda la vida marina está inmersa en agua, la matriz y el útero de la vida misma. [7] El agua puede descomponerse en sus constituyentes hidrógeno y oxígeno mediante procesos metabólicos o abióticos, y luego recombinarse para convertirse nuevamente en agua.
Si bien el ciclo del agua es en sí mismo un ciclo biogeoquímico , el flujo de agua sobre y debajo de la Tierra es un componente clave del ciclo de otros biogeoquímicos. [8] La escorrentía es responsable de casi todo el transporte de sedimentos erosionados y fósforo desde la tierra hasta los cuerpos de agua . [9] La eutrofización cultural de los lagos se debe principalmente al fósforo, aplicado en exceso a los campos agrícolas en fertilizantes , y luego transportado por tierra y ríos. Tanto la escorrentía como el flujo de agua subterránea juegan un papel importante en el transporte de nitrógeno desde la tierra hasta los cuerpos de agua. [10] La zona muerta en la desembocadura del río Misisipi es una consecuencia de los nitratos de los fertilizantes que se transportan desde los campos agrícolas y se canalizan por el sistema fluvial hasta el Golfo de México . La escorrentía también juega un papel en el ciclo del carbono , nuevamente a través del transporte de roca y suelo erosionados. [11]
La salinidad de los océanos se deriva principalmente de la erosión de las rocas y del transporte de sales disueltas desde la tierra, con contribuciones menores de los respiraderos hidrotermales en el fondo marino. [12] La evaporación del agua del océano y la formación de hielo marino aumentan aún más la salinidad del océano. Sin embargo, estos procesos que aumentan la salinidad se ven continuamente contrarrestados por procesos que la reducen, como la entrada continua de agua dulce de los ríos, la precipitación de lluvia y nieve y el derretimiento del hielo. [13] Los dos iones más frecuentes en el agua de mar son el cloruro y el sodio. Juntos, constituyen alrededor del 85 por ciento de todos los iones disueltos en el océano. Los iones de magnesio y sulfato constituyen la mayor parte del resto. La salinidad varía con la temperatura, la evaporación y la precipitación. Generalmente es baja en el ecuador y los polos, y alta en latitudes medias. [12]

Una corriente de microorganismos transportados por el aire circula por el planeta por encima de los sistemas meteorológicos pero por debajo de las rutas aéreas comerciales. [16] Algunos microorganismos peripatéticos son arrastrados por las tormentas de polvo terrestres, pero la mayoría se originan a partir de microorganismos marinos en la espuma del mar . En 2018, los científicos informaron que cientos de millones de virus y decenas de millones de bacterias se depositan diariamente en cada metro cuadrado alrededor del planeta. [17] [18] Este es otro ejemplo de agua que facilita el transporte de material orgánico a grandes distancias, en este caso en forma de microorganismos vivos.
La sal disuelta no se evapora de nuevo a la atmósfera como el agua, pero forma aerosoles de sal marina en la espuma marina . Muchos procesos físicos sobre la superficie del océano generan aerosoles de sal marina. Una causa común es la explosión de burbujas de aire , que son arrastradas por la tensión del viento durante la formación de crestas blancas . Otra es el desprendimiento de gotas de las cimas de las olas. [19] El flujo total de sal marina desde el océano a la atmósfera es de aproximadamente 3300 Tg (3.3 mil millones de toneladas) por año. [20]


La radiación solar afecta a los océanos: el agua cálida del Ecuador tiende a circular hacia los polos , mientras que el agua fría de los polos se dirige hacia el Ecuador. Las corrientes superficiales están dictadas inicialmente por las condiciones del viento en la superficie. Los vientos alisios soplan hacia el oeste en los trópicos, [22] y los vientos del oeste soplan hacia el este en latitudes medias. [23] Este patrón de viento aplica una tensión a la superficie del océano subtropical con una curvatura negativa en el hemisferio norte , [24] y a la inversa en el hemisferio sur . El transporte de Sverdrup resultante es hacia el ecuador. [25] Debido a la conservación de la vorticidad potencial causada por los vientos que se mueven hacia los polos en la periferia occidental de la dorsal subtropical y la mayor vorticidad relativa del agua que se mueve hacia los polos, el transporte se equilibra con una corriente estrecha y acelerada hacia los polos, que fluye a lo largo del límite occidental de la cuenca oceánica, compensando los efectos de la fricción con la corriente fría del límite occidental que se origina en latitudes altas. [26] El proceso general, conocido como intensificación occidental , hace que las corrientes en el límite occidental de una cuenca oceánica sean más fuertes que las del límite oriental. [27]
A medida que viaja hacia los polos, el agua caliente transportada por una fuerte corriente de agua caliente sufre un enfriamiento por evaporación. El enfriamiento es impulsado por el viento: el viento que se mueve sobre el agua enfría el agua y también causa evaporación , dejando una salmuera más salada. En este proceso, el agua se vuelve más salada y más densa y disminuye su temperatura. Una vez que se forma el hielo marino, las sales quedan fuera del hielo, un proceso conocido como exclusión de salmuera. [28] Estos dos procesos producen agua más densa y más fría. El agua a través del Océano Atlántico norte se vuelve tan densa que comienza a hundirse a través de agua menos salada y menos densa. Esta corriente descendente de agua pesada, fría y densa se convierte en parte de las Aguas Profundas del Atlántico Norte , una corriente que se dirige hacia el sur. [29]
Los vientos impulsan las corrientes oceánicas en los 100 metros superiores de la superficie del océano. Sin embargo, las corrientes oceánicas también fluyen a miles de metros por debajo de la superficie. Estas corrientes oceánicas profundas son impulsadas por las diferencias en la densidad del agua, que está controlada por la temperatura (termo) y la salinidad (halina). Este proceso se conoce como circulación termohalina. En las regiones polares de la Tierra, el agua del océano se enfría mucho, formando hielo marino. Como consecuencia, el agua de mar circundante se vuelve más salada, porque cuando se forma hielo marino, la sal se queda atrás. A medida que el agua de mar se vuelve más salada, su densidad aumenta y comienza a hundirse. El agua superficial es arrastrada para reemplazar el agua que se hunde, que a su vez, finalmente se vuelve lo suficientemente fría y salada como para hundirse. Esto inicia las corrientes oceánicas profundas que impulsan la cinta transportadora global. [30]
La circulación termohalina impulsa un sistema de corrientes a escala global llamado “cinta transportadora global”. La cinta transportadora comienza en la superficie del océano cerca del polo en el Atlántico Norte. Allí, el agua se enfría debido a las temperaturas del Ártico. También se vuelve más salada porque cuando se forma hielo marino, la sal no se congela y se queda en el agua circundante. El agua fría ahora es más densa, debido a las sales añadidas, y se hunde hacia el fondo del océano. El agua superficial se desplaza para reemplazar el agua que se hunde, creando así una corriente. Esta agua profunda se desplaza hacia el sur, entre los continentes, más allá del ecuador y hasta los extremos de África y Sudamérica. La corriente viaja alrededor del borde de la Antártida, donde el agua se enfría y se hunde nuevamente, como ocurre en el Atlántico Norte. De este modo, la cinta transportadora se “recarga”. A medida que se mueve alrededor de la Antártida, dos secciones se separan de la cinta transportadora y giran hacia el norte. Una sección se dirige hacia el océano Índico y la otra hacia el océano Pacífico. Estas dos secciones que se separan se calientan y se vuelven menos densas a medida que viajan hacia el norte en dirección al ecuador, de modo que ascienden a la superficie (afloramiento). Luego regresan hacia el sur y el oeste hasta el Atlántico Sur, y finalmente regresan al Atlántico Norte, donde el ciclo comienza de nuevo. La cinta transportadora se mueve a velocidades mucho más lentas (unos pocos centímetros por segundo) que las corrientes impulsadas por el viento o las mareas (decenas a cientos de centímetros por segundo). Se estima que cualquier metro cúbico de agua tarda unos 1.000 años en completar el viaje a lo largo de la cinta transportadora global. Además, la cinta transportadora mueve un inmenso volumen de agua: más de 100 veces el caudal del río Amazonas (Ross, 1995). La cinta transportadora también es un componente vital de los ciclos globales de nutrientes y dióxido de carbono de los océanos. Las aguas superficiales cálidas se agotan de nutrientes y dióxido de carbono, pero se enriquecen nuevamente a medida que viajan a través de la cinta transportadora como capas profundas o del fondo. La base de la cadena alimentaria mundial depende de las aguas frías y ricas en nutrientes que sustentan el crecimiento de algas y algas marinas. [31]
El tiempo medio global de residencia de una molécula de agua en el océano es de unos 3.200 años. En comparación, el tiempo medio de residencia en la atmósfera es de unos nueve días. Si se congela en la Antártida o se deposita en aguas subterráneas profundas, puede quedar secuestrada durante diez mil años. [32] [33]
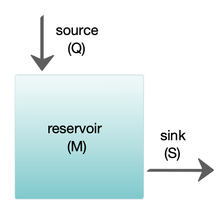
Los modelos de caja se utilizan ampliamente para modelar sistemas biogeoquímicos. [65] Los modelos de caja son versiones simplificadas de sistemas complejos, reduciéndolos a cajas (o depósitos de almacenamiento ) para materiales químicos, conectados por flujos de materiales (flujos). Los modelos de caja simples tienen una pequeña cantidad de cajas con propiedades, como el volumen, que no cambian con el tiempo. Se supone que las cajas se comportan como si estuvieran mezcladas de manera homogénea. [64] Estos modelos se utilizan a menudo para derivar fórmulas analíticas que describen la dinámica y la abundancia en estado estacionario de las especies químicas involucradas.
El diagrama de la derecha muestra un modelo básico de una caja. El yacimiento contiene la cantidad de material M en consideración, según se define por las propiedades químicas, físicas o biológicas. La fuente Q es el flujo de material hacia el yacimiento, y el sumidero S es el flujo de material que sale del yacimiento. El presupuesto es el control y equilibrio de las fuentes y los sumideros que afectan la rotación de material en un yacimiento. El yacimiento está en un estado estable si Q = S , es decir, si las fuentes equilibran a los sumideros y no hay cambios a lo largo del tiempo. [64]
Los modelos de caja biogeoquímica global suelen medir:
— masas de yacimiento en petagramos (Pg)
— flujos de flujo en petagramos por año (Pg año −1 )
Los diagramas de este artículo utilizan principalmente estas unidades
________________________________________________
un petagramo = 10 15 gramos = una gigatonelada = mil millones (10 9 ) de toneladas
El tiempo de recambio (también llamado tiempo de renovación o edad de salida) es el tiempo promedio que el material permanece residente en el yacimiento. Si el yacimiento está en un estado estable, este es el mismo que el tiempo que tarda en llenarse o vaciarse. Por lo tanto, si τ es el tiempo de recambio, entonces τ = M/S. [64] La ecuación que describe la tasa de cambio del contenido en un yacimiento es
Cuando se conectan dos o más depósitos, se puede considerar que el material circula entre los depósitos y pueden existir patrones predecibles para el flujo cíclico. [64] Los modelos multibox más complejos se resuelven generalmente utilizando técnicas numéricas.


El diagrama anterior muestra un presupuesto simplificado de los flujos de carbono oceánico. Está compuesto por tres modelos de caja simples interconectados, uno para la zona eufótica , uno para el interior del océano u océano oscuro y uno para los sedimentos oceánicos . En la zona eufótica, la producción neta de fitoplancton es de aproximadamente 50 Pg C cada año. Aproximadamente 10 Pg se exportan al interior del océano mientras que los otros 40 Pg se respiran. La degradación del carbono orgánico ocurre a medida que las partículas ( nieve marina ) se depositan en el interior del océano. Solo 2 Pg llegan finalmente al fondo marino, mientras que los otros 8 Pg se respiran en el océano oscuro. En los sedimentos, la escala de tiempo disponible para la degradación aumenta en órdenes de magnitud con el resultado de que el 90% del carbono orgánico entregado se degrada y solo 0,2 Pg C año −1 finalmente se entierran y se transfieren de la biosfera a la geosfera. [66]



La bomba biológica , en su forma más simple, es el secuestro biológicamente impulsado por el océano de carbono desde la atmósfera hacia el interior del océano y los sedimentos del fondo marino . [75] Es la parte del ciclo del carbono oceánico responsable del ciclo de la materia orgánica formada principalmente por el fitoplancton durante la fotosíntesis (bomba de tejidos blandos), así como del ciclo del carbonato de calcio (CaCO 3 ) formado en conchas por ciertos organismos como el plancton y los moluscos (bomba de carbonato). [76]
La bomba biológica se puede dividir en tres fases distintas, [77] la primera de las cuales es la producción de carbono fijado por los fotótrofos planctónicos en la región superficial eufótica (iluminada por el sol) del océano. En estas aguas superficiales, el fitoplancton utiliza dióxido de carbono (CO 2 ), nitrógeno (N), fósforo (P) y otros oligoelementos ( bario , hierro , zinc , etc.) durante la fotosíntesis para producir carbohidratos , lípidos y proteínas . Algunos plancton (por ejemplo, cocolitóforos y foraminíferos ) combinan calcio (Ca) y carbonatos disueltos ( ácido carbónico y bicarbonato ) para formar una capa protectora de carbonato de calcio (CaCO 3 ).
Una vez que este carbono se fija en los tejidos blandos o duros, los organismos permanecen en la zona eufótica para reciclarse como parte del ciclo regenerativo de nutrientes o, una vez que mueren, continúan hasta la segunda fase de la bomba biológica y comienzan a hundirse hasta el fondo del océano. Las partículas que se hunden a menudo forman agregados a medida que se hunden, lo que aumenta enormemente la velocidad de hundimiento. Es esta agregación la que les da a las partículas una mejor oportunidad de escapar de la depredación y la descomposición en la columna de agua y, finalmente, llegar al fondo del mar.
El carbono fijado, que es descompuesto por bacterias durante el descenso o una vez en el fondo del mar, pasa a la fase final de la bomba y se remineraliza para ser utilizado nuevamente en la producción primaria . Las partículas que escapan por completo a estos procesos quedan secuestradas en el sedimento y pueden permanecer allí durante millones de años. Es este carbono secuestrado el responsable de reducir en última instancia el CO 2 atmosférico .
El ciclo del carbono marino se compone de procesos que intercambian carbono entre varios depósitos dentro del océano, así como entre la atmósfera, el interior de la Tierra y el fondo marino . El ciclo del carbono es el resultado de muchas fuerzas que interactúan a través de múltiples escalas de tiempo y espacio que hacen circular el carbono alrededor del planeta, asegurando que el carbono esté disponible globalmente. El ciclo del carbono oceánico es un proceso central para el ciclo global del carbono y contiene tanto carbono inorgánico (carbono no asociado con un ser vivo, como el dióxido de carbono) como carbono orgánico (carbono que está, o ha estado, incorporado a un ser vivo). Parte del ciclo del carbono marino transforma el carbono entre materia viva y no viva.
Tres procesos principales (o bombas) que componen el ciclo del carbono marino llevan el dióxido de carbono atmosférico (CO 2 ) al interior del océano y lo distribuyen a través de los océanos. Estas tres bombas son: (1) la bomba de solubilidad, (2) la bomba de carbonato y (3) la bomba biológica. La reserva total de carbono activo en la superficie de la Tierra durante duraciones de menos de 10.000 años es de aproximadamente 40.000 gigatoneladas de C (Gt C, una gigatonelada son mil millones de toneladas, o el peso de aproximadamente 6 millones de ballenas azules ), y aproximadamente el 95% (~38.000 Gt C) se almacena en el océano, principalmente como carbono inorgánico disuelto. [34] [35] La especiación del carbono inorgánico disuelto en el ciclo del carbono marino es un controlador primario de la química ácido-base en los océanos.


El ciclo del nitrógeno es tan importante en el océano como en la tierra. Si bien el ciclo general es similar en ambos casos, existen diferentes actores y modos de transferencia de nitrógeno en el océano. [81] El nitrógeno ingresa al océano a través de la precipitación, la escorrentía o como N2 de la atmósfera. El fitoplancton no puede utilizar el nitrógeno como N2 , por lo que debe sufrir una fijación de nitrógeno que se realiza predominantemente por cianobacterias . [82] Sin suministros de nitrógeno fijado que ingresen al ciclo marino, el nitrógeno fijado se agotaría en aproximadamente 2000 años. [83] El fitoplancton necesita nitrógeno en formas biológicamente disponibles para la síntesis inicial de materia orgánica. El amoníaco y la urea se liberan en el agua por excreción del plancton. Las fuentes de nitrógeno se eliminan de la zona eufótica por el movimiento descendente de la materia orgánica. Esto puede ocurrir por el hundimiento del fitoplancton, la mezcla vertical o el hundimiento de los desechos de los migrantes verticales. El hundimiento hace que el amoníaco se introduzca a profundidades inferiores por debajo de la zona eufótica. Las bacterias pueden convertir el amoníaco en nitrito y nitrato, pero la luz se lo impide, por lo que esto debe ocurrir por debajo de la zona eufótica. [82] Las bacterias realizan la amonificación o mineralización para convertir el nitrógeno orgánico en amoníaco. A continuación, puede producirse la nitrificación para convertir el amonio en nitrito y nitrato. [84] El nitrato puede devolverse a la zona eufótica mediante la mezcla vertical y el afloramiento, donde puede ser absorbido por el fitoplancton para continuar el ciclo. El N 2 puede devolverse a la atmósfera mediante la desnitrificación .
Se cree que el amonio es la fuente preferida de nitrógeno fijado para el fitoplancton porque su asimilación no implica una reacción redox y, por lo tanto, requiere poca energía. El nitrato requiere una reacción redox para su asimilación, pero es más abundante, por lo que la mayoría del fitoplancton se ha adaptado para tener las enzimas necesarias para llevar a cabo esta reducción ( nitrato reductasa ). Hay algunas excepciones notables y bien conocidas que incluyen la mayoría de Prochlorococcus y algunos Synechococcus que solo pueden absorber nitrógeno como amonio. [83]
El fósforo es un nutriente esencial para las plantas y los animales, pero es un nutriente limitante para los organismos acuáticos. Forma parte de moléculas importantes para el sustento de la vida que son muy comunes en la biosfera. El fósforo entra en la atmósfera en cantidades muy pequeñas cuando el polvo se disuelve en el agua de lluvia y la espuma del mar, pero permanece principalmente en la tierra y en los minerales de las rocas y el suelo. El ochenta por ciento del fósforo extraído se utiliza para fabricar fertilizantes. Los fosfatos de los fertilizantes, las aguas residuales y los detergentes pueden causar contaminación en lagos y arroyos. El enriquecimiento excesivo de fosfato en aguas dulces y marinas costeras puede provocar floraciones masivas de algas que, cuando mueren y se descomponen, provocan la eutrofización de las aguas dulces únicamente. Investigaciones recientes sugieren que el contaminante predominante responsable de las floraciones de algas en los estuarios de agua salada y los hábitats marinos costeros es el nitrógeno. [85]
El fósforo se encuentra en mayor abundancia en la naturaleza como parte del ion ortofosfato (PO 4 ) 3− , que consiste en un átomo de P y 4 átomos de oxígeno. En la tierra, la mayor parte del fósforo se encuentra en rocas y minerales. Los depósitos ricos en fósforo se han formado generalmente en el océano o a partir del guano, y con el tiempo, los procesos geológicos traen sedimentos oceánicos a la tierra. La erosión de las rocas y los minerales libera fósforo en una forma soluble que es absorbida por las plantas y transformada en compuestos orgánicos. Las plantas pueden ser consumidas por herbívoros y el fósforo se incorpora a sus tejidos o se excreta. Después de la muerte, el animal o la planta se descompone y el fósforo regresa al suelo donde una gran parte del fósforo se transforma en compuestos insolubles. La escorrentía puede llevar una pequeña parte del fósforo de regreso al océano . [86]

Un ciclo de nutrientes es el movimiento e intercambio de materia orgánica e inorgánica para la producción de materia. El proceso está regulado por las vías disponibles en las redes alimentarias marinas , que en última instancia descomponen la materia orgánica en nutrientes inorgánicos. Los ciclos de nutrientes ocurren dentro de los ecosistemas. El flujo de energía siempre sigue un camino unidireccional y no cíclico, mientras que el movimiento de nutrientes minerales es cíclico. Los ciclos minerales incluyen el ciclo del carbono , el ciclo del oxígeno , el ciclo del nitrógeno , el ciclo del fósforo y el ciclo del azufre, entre otros, que se reciclan continuamente junto con otros nutrientes minerales en una nutrición ecológica productiva .
Existe una superposición considerable entre los términos ciclo biogeoquímico y ciclo de nutrientes. Algunos libros de texto integran ambos y parecen tratarlos como términos sinónimos. [88] Sin embargo, los términos a menudo aparecen de forma independiente. El ciclo de nutrientes se utiliza con más frecuencia en referencia directa a la idea de un ciclo intrasistema, donde un ecosistema funciona como una unidad. Desde un punto de vista práctico, no tiene sentido evaluar un ecosistema terrestre considerando la columna de aire completa sobre él, así como las grandes profundidades de la Tierra debajo de él. Si bien un ecosistema a menudo no tiene un límite claro, como modelo de trabajo es práctico considerar la comunidad funcional donde ocurre la mayor parte de la transferencia de materia y energía. [89] El ciclo de nutrientes ocurre en ecosistemas que participan en los "ciclos biogeoquímicos más amplios de la Tierra a través de un sistema de entradas y salidas". [89] : 425
Los nutrientes disueltos en el agua de mar son esenciales para la supervivencia de la vida marina. El nitrógeno y el fósforo son particularmente importantes. Se los considera nutrientes limitantes en muchos ambientes marinos, porque los productores primarios, como las algas y las plantas marinas, no pueden crecer sin ellos. Son fundamentales para estimular la producción primaria del fitoplancton . Otros nutrientes importantes son el silicio, el hierro y el zinc. [90]
El proceso de ciclado de nutrientes en el mar comienza con el bombeo biológico, cuando el fitoplancton extrae nutrientes de las aguas superficiales para que pasen a formar parte de su composición orgánica. El fitoplancton es consumido por otros organismos o, finalmente, muere y se desplaza hacia el fondo en forma de nieve marina . Allí se descompone y vuelve al estado disuelto, pero a mayores profundidades oceánicas. La fertilidad de los océanos depende de la abundancia de nutrientes y se mide por la producción primaria , que es la tasa de fijación de carbono por unidad de agua por unidad de tiempo. "La producción primaria suele ser cartografiada por satélites utilizando la distribución de clorofila, que es un pigmento producido por las plantas que absorbe energía durante la fotosíntesis. La distribución de clorofila se muestra en la figura anterior. Se puede ver la mayor abundancia cerca de las costas, donde los nutrientes de la tierra son aportados por los ríos. El otro lugar donde los niveles de clorofila son altos es en las zonas de afloramiento, donde los nutrientes son llevados a la superficie del océano desde las profundidades por el proceso de afloramiento..." [90]
"Otro elemento crítico para la salud de los océanos es el contenido de oxígeno disuelto. El oxígeno en la superficie del océano se añade continuamente a través de la interfaz aire-mar, así como por la fotosíntesis; se utiliza en la respiración de los organismos marinos y durante la descomposición u oxidación de la materia orgánica que cae en el océano y se deposita en el fondo del océano. La mayoría de los organismos necesitan oxígeno, por lo que su agotamiento tiene efectos adversos para las poblaciones marinas. La temperatura también afecta a los niveles de oxígeno, ya que las aguas cálidas pueden contener menos oxígeno disuelto que las aguas frías. Esta relación tendrá importantes implicaciones para los océanos del futuro, como veremos... La última propiedad del agua de mar que consideraremos es el contenido de CO 2 disuelto . El CO 2 es casi opuesto al oxígeno en muchos procesos químicos y biológicos; lo utiliza el plancton durante la fotosíntesis y lo repone durante la respiración, así como durante la oxidación de la materia orgánica. Como veremos más adelante, el contenido de CO 2 es importante para el estudio del envejecimiento en aguas profundas". [90]



La reducción de sulfato en el fondo marino se concentra principalmente en los sedimentos cercanos a la superficie con altas tasas de deposición a lo largo de los márgenes oceánicos. Por lo tanto, el ciclo bentónico del azufre marino es sensible a la influencia antropogénica, como el calentamiento de los océanos y el aumento de la carga de nutrientes en los mares costeros. Esto estimula la productividad fotosintética y da como resultado una mayor exportación de materia orgánica al fondo marino, a menudo combinada con una baja concentración de oxígeno en el agua del fondo (Rabalais et al., 2014; Breitburg et al., 2018). De este modo, la zonificación biogeoquímica se comprime hacia la superficie del sedimento y el equilibrio de la mineralización de la materia orgánica se desplaza de los procesos óxicos y subóxicos hacia la reducción de sulfato y la metanogénesis (Middelburg y Levin, 2009). [91]
El ciclo del azufre en ambientes marinos ha sido bien estudiado a través de la herramienta de la sistemática de isótopos de azufre expresados como δ 34 S. Los océanos globales modernos tienen un almacenamiento de azufre de 1,3 × 10 21 g, [92] presentándose principalmente como sulfato con el valor δ 34 S de +21‰. [93] El flujo de entrada general es de 1,0 × 10 14 g/año con la composición isotópica de azufre de ~3‰. [93] El sulfato fluvial derivado de la meteorización terrestre de minerales de sulfuro (δ 34 S = +6‰) es la entrada principal de azufre a los océanos. Otras fuentes son la desgasificación metamórfica y volcánica y la actividad hidrotermal (δ 34 S = 0‰), que liberan especies de azufre reducidas (por ejemplo, H 2 S y S 0 ). Hay dos salidas principales de azufre de los océanos. El primer sumidero es el enterramiento de sulfato, ya sea como evaporitas marinas (por ejemplo, yeso) o sulfato asociado a carbonato (CAS), que representa 6 × 10 13 g/año (δ 34 S = +21‰). El segundo sumidero de azufre es el enterramiento de pirita en sedimentos de plataforma o sedimentos del fondo marino profundo (4 × 10 13 g/año; δ 34 S = -20‰). [94] El flujo total de salida de azufre marino es de 1,0 × 10 14 g/año, que coincide con los flujos de entrada, lo que implica que el presupuesto de azufre marino moderno está en estado estacionario. [93] El tiempo de residencia del azufre en los océanos globales modernos es de 13 000 000 de años. [95]
En los océanos modernos, Hydrogenovibrio crunogenus , Halothiobacillus y Beggiatoa son bacterias oxidantes primarias de azufre, [96] [97] y forman simbiosis quimiosintéticas con huéspedes animales. [98] El huésped proporciona sustratos metabólicos (por ejemplo, CO 2 , O 2 , H 2 O) al simbionte mientras que el simbionte genera carbono orgánico para sostener las actividades metabólicas del huésped. El sulfato producido generalmente se combina con los iones de calcio lixiviados para formar yeso , que puede formar depósitos generalizados en centros de expansión cercanos al medio del océano. [99]
Los respiraderos hidrotermales emiten sulfuro de hidrógeno que favorece la fijación de carbono por parte de bacterias quimiolitotróficas que oxidan el sulfuro de hidrógeno con oxígeno para producir azufre elemental o sulfato. [96]

El ciclo del hierro (Fe) es el ciclo biogeoquímico del hierro a través de la atmósfera , la hidrosfera , la biosfera y la litosfera . Si bien el Fe es muy abundante en la corteza terrestre, [104] es menos común en las aguas superficiales oxigenadas. El hierro es un micronutriente clave en la productividad primaria , [49] y un nutriente limitante en el océano Austral, el Pacífico ecuatorial oriental y el Pacífico subártico, conocidos como regiones del océano con alto contenido de nutrientes y bajo contenido de clorofila (HNLC) . [50]
El hierro en el océano circula entre el plancton, las partículas agregadas (hierro no biodisponible) y el hierro disuelto (hierro biodisponible), y se convierte en sedimentos a través del enterramiento. [100] [105] [106] Los respiraderos hidrotermales liberan hierro ferroso al océano [107] además de los aportes de hierro oceánico de fuentes terrestres. El hierro llega a la atmósfera a través del vulcanismo, [108] el viento eólico , [109] y algo a través de la combustión por parte de los seres humanos. En el Antropoceno , el hierro se extrae de las minas en la corteza y una parte se vuelve a depositar en depósitos de desechos. [103] [106]


El hierro es un micronutriente esencial para casi todas las formas de vida. Es un componente clave de la hemoglobina, importante para la fijación de nitrógeno como parte de la familia de enzimas nitrogenasas , y como parte del núcleo de hierro y azufre de la ferredoxina, facilita el transporte de electrones en los cloroplastos, las mitocondrias eucariotas y las bacterias. Debido a la alta reactividad del Fe 2+ con el oxígeno y la baja solubilidad del Fe 3+ , el hierro es un nutriente limitante en la mayoría de las regiones del mundo.
.jpg/440px-Carbonate-Silicate_Cycle_(Carbon_Cycle_focus).jpg)
El ciclo del calcio es una transferencia de calcio entre fases disueltas y sólidas . Existe un suministro continuo de iones de calcio a los cursos de agua desde rocas , organismos y suelos . [54] [112] Los iones de calcio se consumen y se eliminan de los entornos acuosos a medida que reaccionan para formar estructuras insolubles como el carbonato de calcio y el silicato de calcio, [54] [113] que pueden depositarse para formar sedimentos o los exoesqueletos de los organismos. [57] Los iones de calcio también se pueden utilizar biológicamente , ya que el calcio es esencial para funciones biológicas como la producción de huesos y dientes o la función celular. [58] [59] El ciclo del calcio es un hilo conductor entre los procesos terrestres, marinos, geológicos y biológicos. [114] El calcio se mueve a través de estos diferentes medios a medida que circula por toda la Tierra. El ciclo del calcio marino se ve afectado por el cambio de dióxido de carbono atmosférico debido a la acidificación de los océanos . [57]
El carbonato de calcio biogénico se forma cuando los organismos marinos, como los cocolitóforos , los corales , los pterópodos y otros moluscos , transforman los iones de calcio y el bicarbonato en conchas y exoesqueletos de calcita o aragonito , ambas formas de carbonato de calcio. [57] Este es el sumidero dominante para el calcio disuelto en el océano. [114] Los organismos muertos se hunden hasta el fondo del océano, depositando capas de concha que con el tiempo se cementan para formar piedra caliza . Este es el origen de la piedra caliza tanto marina como terrestre. [57]
El calcio precipita en carbonato de calcio según la siguiente ecuación:
Ca 2+ + 2HCO 3 − → CO 2 + H 2 O + CaCO 3 [112]
La relación entre el calcio disuelto y el carbonato de calcio se ve afectada en gran medida por los niveles de dióxido de carbono (CO 2 ) en la atmósfera.
El aumento de dióxido de carbono produce más bicarbonato en el océano según la siguiente ecuación:
CO 2 + CO 3 2 − + H 2 O → 2HCO 3 − [115]


Debido a su estrecha relación con el ciclo del carbono y los efectos de los gases de efecto invernadero, se prevé que tanto el ciclo del calcio como el del carbono cambien en los próximos años. [118] El seguimiento de los isótopos de calcio permite predecir los cambios ambientales, y muchas fuentes sugieren un aumento de las temperaturas tanto en la atmósfera como en el entorno marino. Como resultado, esto alterará drásticamente la descomposición de las rocas, el pH de los océanos y las vías fluviales y, por lo tanto, la sedimentación del calcio, lo que conlleva una serie de implicaciones para el ciclo del calcio.
Debido a las complejas interacciones del calcio con muchas facetas de la vida, es poco probable que se conozcan los efectos de las condiciones ambientales alteradas hasta que ocurran. Sin embargo, se pueden hacer predicciones tentativas, basadas en investigaciones basadas en evidencia. El aumento de los niveles de dióxido de carbono y la disminución del pH del océano alterarán la solubilidad del calcio, impidiendo que los corales y los organismos con caparazón desarrollen sus exoesqueletos basados en calcio, lo que los hará vulnerables o incapaces de sobrevivir. [119] [120]
La mayor parte de la producción biológica de sílice biogénica en el océano es impulsada por diatomeas , con contribuciones adicionales de radiolarios . Estos microorganismos extraen ácido silícico disuelto de las aguas superficiales durante el crecimiento y lo devuelven mediante reciclaje en toda la columna de agua después de morir. Los aportes de silicio al océano desde arriba llegan a través de los ríos y el polvo eólico , mientras que los de abajo incluyen el reciclaje de sedimentos del fondo marino, la erosión y la actividad hidrotermal . [121]



"La actividad biológica es una fuerza dominante que configura la estructura química y la evolución del medio ambiente de la superficie terrestre. La presencia de una atmósfera-hidrosfera oxigenada que rodea una tierra sólida que, por lo demás, es muy reductora es la consecuencia más llamativa del surgimiento de la vida en la Tierra. La evolución biológica y el funcionamiento de los ecosistemas, a su vez, están condicionados en gran medida por procesos geofísicos y geológicos. La comprensión de las interacciones entre los organismos y su entorno abiótico, y la evolución acoplada resultante de la biosfera y la geosfera, es un tema central de la investigación en biogeología. Los biogeoquímicos contribuyen a esta comprensión estudiando las transformaciones y el transporte de sustratos químicos y productos de la actividad biológica en el medio ambiente". [122]
"Desde la explosión cámbrica, la biota ha secretado en grandes cantidades partes del cuerpo mineralizadas. Dado que el carbonato de calcio, el sílice y el fosfato de calcio son las principales fases minerales que constituyen estas partes duras, la biomineralización desempeña un papel importante en los ciclos biogeoquímicos globales del carbono, el calcio, el silicio y el fósforo" [122]

El ciclo profundo implica el intercambio de materiales con el manto . El ciclo profundo del agua implica el intercambio de agua con el manto, ya que el agua desciende por las placas oceánicas en subducción y regresa a través de la actividad volcánica, algo distinto del proceso del ciclo del agua que ocurre por encima y sobre la superficie de la Tierra. Parte del agua llega hasta el manto inferior e incluso puede llegar al núcleo externo .
En la visión convencional del ciclo del agua (también conocido como ciclo hidrológico ), el agua se mueve entre los reservorios en la atmósfera y la superficie de la Tierra o cerca de la superficie (incluidos el océano , los ríos y lagos , los glaciares y los casquetes polares , la biosfera y las aguas subterráneas ). Sin embargo, además del ciclo de la superficie, el agua también juega un papel importante en los procesos geológicos que llegan hasta la corteza y el manto . El contenido de agua en el magma determina qué tan explosiva es una erupción volcánica; el agua caliente es el conducto principal para que los minerales económicamente importantes se concentren en depósitos minerales hidrotermales ; y el agua juega un papel importante en la formación y migración del petróleo . [123] El petróleo es un combustible fósil derivado de antiguos materiales orgánicos fosilizados , como el zooplancton y las algas . [124] [125]
El agua no solo está presente como una fase separada en el suelo. El agua de mar se filtra en la corteza oceánica e hidrata rocas ígneas como el olivino y el piroxeno , transformándolas en minerales hidratados como serpentinas , talco y brucita . [126] En esta forma, el agua es transportada hacia abajo hasta el manto. En el manto superior , el calor y la presión deshidratan estos minerales, liberando gran parte de ellos a la cuña del manto suprayacente , lo que desencadena la fusión de la roca que se eleva para formar arcos volcánicos . [127] Sin embargo, algunos de los "minerales nominalmente anhidros" que son estables más profundamente en el manto pueden almacenar pequeñas concentraciones de agua en forma de hidroxilo (OH − ), [128] y debido a que ocupan grandes volúmenes de la Tierra, son capaces de almacenar al menos tanto como los océanos del mundo. [123]

La visión convencional del origen del océano es que se llenó por desgasificación del manto en el Arcaico temprano y el manto ha permanecido deshidratado desde entonces. [130] Sin embargo, la subducción arrastra agua hacia abajo a un ritmo que vaciaría el océano en 1-2 mil millones de años. A pesar de esto, los cambios en el nivel global del mar durante los últimos 3-4 mil millones de años solo han sido de unos pocos cientos de metros, mucho más pequeños que la profundidad promedio del océano de 4 kilómetros. Por lo tanto, se espera que los flujos de agua dentro y fuera del manto estén aproximadamente equilibrados y el contenido de agua del manto sea constante. El agua transportada al manto eventualmente regresa a la superficie en erupciones en las dorsales oceánicas y puntos calientes . [131] : 646 Las estimaciones de la cantidad de agua en el manto varían de 1 ⁄ 4 a 4 veces el agua en el océano. [131] : 630–634
El ciclo profundo del carbono es el movimiento del carbono a través del manto y el núcleo de la Tierra . Forma parte del ciclo del carbono y está íntimamente relacionado con el movimiento del carbono en la superficie y la atmósfera de la Tierra. Al devolver el carbono a las profundidades de la Tierra, desempeña un papel fundamental en el mantenimiento de las condiciones terrestres necesarias para la existencia de la vida. Sin él, el carbono se acumularía en la atmósfera y alcanzaría concentraciones extremadamente altas durante largos períodos de tiempo. [132]
El fitoplancton acuático y el zooplancton que murieron y sedimentaron en grandes cantidades en condiciones anóxicas hace millones de años comenzaron a formar petróleo y gas natural como resultado de la descomposición anaeróbica (por el contrario, las plantas terrestres tendieron a formar carbón y metano). Con el tiempo geológico, esta materia orgánica , mezclada con lodo , quedó enterrada bajo otras capas pesadas de sedimento inorgánico. La alta temperatura y presión resultantes hicieron que la materia orgánica se alterara químicamente , primero en un material ceroso conocido como kerógeno , que se encuentra en las pizarras bituminosas , y luego con más calor en hidrocarburos líquidos y gaseosos en un proceso conocido como catagénesis . Estos organismos y sus combustibles fósiles resultantes suelen tener una edad de millones de años, y a veces más de 650 millones de años, [133] la energía liberada en la combustión sigue siendo de origen fotosintético. [134]
Como oligoelementos, micronutrientes, ciclos inducidos por el hombre para compuestos sintéticos como el bifenilo policlorado (PCB).