La prostaciclina (también llamada prostaglandina I 2 o PGI 2 ) es un miembro de la prostaglandina de la familia de moléculas lipídicas de los eicosanoides . Inhibe la activación plaquetaria y también es un vasodilatador eficaz.
Cuando se utiliza como fármaco, también se le conoce como epoprostenol . [1] Los términos a veces se usan indistintamente. [2]
La prostaciclina previene principalmente la formación del tapón de plaquetas implicado en la hemostasia primaria (una parte de la formación de coágulos sanguíneos ). Lo hace inhibiendo la activación plaquetaria. [3] También es un vasodilatador eficaz . Las interacciones de la prostaciclina contrastan con las del tromboxano (TXA 2 ), otro eicosanoide. Ambas moléculas se derivan del ácido araquidónico y actúan juntas con efectos agregadores plaquetarios opuestos. Estos sugieren fuertemente un mecanismo de homeostasis cardiovascular entre estas dos hormonas en relación con el daño vascular .
Se utiliza para tratar la hipertensión arterial pulmonar (HAP), [4] [5] la fibrosis pulmonar , [6] así como la aterosclerosis . [6] Específicamente, el epoprostenol se administra a pacientes con HAP de clase III o IV. [ cita necesaria ]
La prostaciclina, que tiene una vida media de 42 segundos, [7] se descompone en 6-ceto-PGF 1 , que es un vasodilatador mucho más débil. Una forma de estabilizar la prostaciclina en su forma activa, especialmente durante la administración del fármaco, es preparar la prostaciclina en un tampón alcalino. Incluso a pH fisiológico, la prostaciclina puede formar rápidamente el producto de hidratación inactivo 6-ceto-prostaglandina F1α. [8]
Como se mencionó anteriormente, la prostaciclina (PGI 2 ) es liberada por células endoteliales sanas y realiza su función a través de una cascada de señalización paracrina que involucra receptores acoplados a proteína G en plaquetas y células endoteliales cercanas. El receptor acoplado a la proteína Gs de las plaquetas ( receptor de prostaciclina ) se activa cuando se une a PGI 2 . Esta activación, a su vez, indica a la adenilil ciclasa que produzca AMPc . El AMPc inhibe cualquier activación plaquetaria indebida (para promover la circulación) y también contrarresta cualquier aumento en los niveles de calcio citosólico que resultaría de la unión del tromboxano A2 (TXA 2 ) (que conduce a la activación plaquetaria y la posterior coagulación ). PGI 2 también se une a los receptores endoteliales de prostaciclina y, de la misma manera, aumenta los niveles de AMPc en el citosol. Este AMPc luego activa la proteína quinasa A (PKA). Luego, la PKA continúa la cascada promoviendo la fosforilación de la quinasa de cadena ligera de miosina , que la inhibe y conduce a la relajación y vasodilatación del músculo liso . Cabe señalar que PGI 2 y TXA 2 actúan como antagonistas fisiológicos.

Los análogos sintéticos de la prostaciclina ( iloprost , cisaprost) se utilizan por vía intravenosa, subcutánea o por inhalación:
La producción de prostaciclina se inhibe por la acción de los AINE sobre las enzimas ciclooxigenasa COX1 y COX2. Éstos convierten el ácido araquidónico en prostaglandina H2 (PGH 2 ), el precursor inmediato de la prostaciclina. Dado que el tromboxano (un eicosanoide estimulador de la agregación plaquetaria) también se encuentra aguas abajo de las enzimas COX, se podría pensar que el efecto de los AINE actuaría para equilibrar. Sin embargo, las concentraciones de prostaciclina se recuperan mucho más rápido que los niveles de tromboxano, por lo que la administración de aspirina inicialmente tiene poco o ningún efecto, pero eventualmente previene la agregación plaquetaria (el efecto de las prostaglandinas predomina a medida que se regeneran). Esto se explica entendiendo las células que producen cada molécula, TXA 2 y PGI 2 . Dado que la PGI 2 se produce principalmente en una célula endotelial nucleada, la inhibición de la COX por los AINE puede superarse con el tiempo mediante una mayor activación del gen COX y la producción posterior de más enzimas COX para catalizar la formación de PGI 2 . Por el contrario, el TXA 2 es liberado principalmente por plaquetas anucleadas, que no pueden responder a la inhibición de la COX por los AINE con una transcripción adicional del gen COX porque carecen del material de ADN necesario para realizar dicha tarea. Esto permite que los AINE produzcan una dominancia de PGI 2 que promueve la circulación y retarda la trombosis .
En pacientes con hipertensión pulmonar , el epoprostenol inhalado reduce la presión pulmonar y mejora el volumen sistólico del ventrículo derecho en pacientes sometidos a cirugía cardíaca. Una dosis de 60 μg es hemodinámicamente segura y su efecto se invierte por completo después de 25 minutos. No se ha encontrado evidencia de disfunción plaquetaria o aumento del sangrado quirúrgico después de la administración de epoprostenol inhalado. [10] Se sabe que el medicamento causa enrojecimiento, dolores de cabeza e hipotensión. [11]
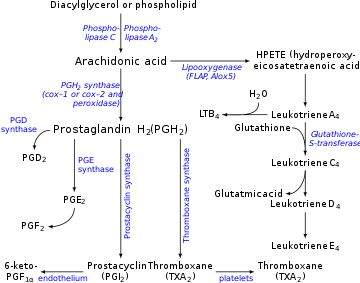
La prostaciclina se produce en las células endoteliales , que recubren las paredes de las arterias y venas, [12] a partir de la prostaglandina H2 ( PGH2 ) por la acción de la enzima prostaciclina sintasa . Aunque la prostaciclina se considera un mediador independiente, en la nomenclatura de eicosanoides se denomina PGI 2 (prostaglandina I 2 ) y es miembro de los prostanoides (junto con las prostaglandinas y el tromboxano ). La PGI 2 , derivada principalmente de la COX-2 en humanos, es el principal metabolito del araquidonato liberado por el endotelio vascular. Este es un punto controvertido, algunos asignan a la COX 1 como la principal ciclooxigenasa productora de prostaciclina en las células endoteliales de los vasos sanguíneos. [13]
La prostaglandina de serie 3 PGH 3 también sigue la vía de la prostaciclina sintasa, produciendo otra prostaciclina, PGI 3 . [14] El término no calificado "prostaciclina" generalmente se refiere a PGI 2 . PGI 2 se deriva del ácido araquidónico ω-6 . PGI 3 se deriva del ω-3 EPA .
La prostaciclina se puede sintetizar a partir del éster metílico de la prostaglandina F 2α . [15] Después de su síntesis, el fármaco se reconstituye en solución salina y glicerina. [dieciséis]
Debido a que la prostaciclina es químicamente lábil, para evaluar su velocidad de síntesis se utiliza la cuantificación de sus metabolitos inactivos, en lugar de los compuestos activos. [17]
Durante la década de 1960, un equipo de investigación del Reino Unido, encabezado por el profesor John Vane , comenzó a explorar el papel de las prostaglandinas en la anafilaxia y las enfermedades respiratorias. Trabajando con un equipo del Royal College of Surgeons , Vane descubrió que la aspirina y otros fármacos antiinflamatorios orales actúan inhibiendo la síntesis de prostaglandinas. Este hallazgo crítico abrió la puerta a una comprensión más amplia del papel de las prostaglandinas en el cuerpo.
Un equipo de la Fundación Wellcome dirigido por Salvador Moncada había identificado un mediador lipídico al que llamaron "PG-X", que inhibe la agregación plaquetaria. PG-X, más tarde conocida como prostaciclina, es 30 veces más potente que cualquier otro agente antiagregante conocido en ese momento. Hicieron esto mientras buscaban una enzima que genera un prostanoide inestable, el tromboxano A2 [18]
En 1976, Vane y sus colegas investigadores Salvador Moncada , Ryszard Gryglewski y Stuart Bunting publicaron el primer artículo sobre la prostaciclina en Nature . [19] La colaboración produjo una molécula sintetizada, que se denominó epoprostenol. Pero, al igual que ocurre con la prostaciclina nativa, la molécula de epoprostenol es inestable en solución y propensa a una rápida degradación. [ cita necesaria ] Esto presentó un desafío tanto para los experimentos in vitro como para las aplicaciones clínicas.
Para superar este desafío, el equipo de investigación que descubrió la prostaciclina continuó la investigación. El equipo de investigación sintetizó cerca de 1.000 análogos. [ cita necesaria ]