La ADN primasa es una enzima que participa en la replicación del ADN y es un tipo de ARN polimerasa . La primasa cataliza la síntesis de un segmento corto de ARN (o ADN en algunos organismos vivos [1] ) llamado cebador complementario a una plantilla de ADN monocatenario ( ssDNA ). Después de esta elongación, el fragmento de ARN es eliminado por una exonucleasa 5' a 3' y rellenado con ADN.

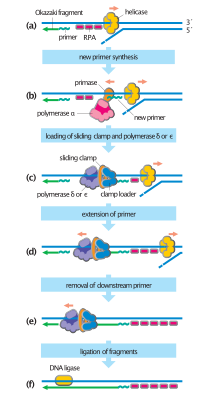
En las bacterias , la primasa se une a la helicasa del ADN formando un complejo llamado primosoma . La primasa es activada por la helicasa, donde luego sintetiza un cebador de ARN corto de aproximadamente 11 ±1 nucleótidos de longitud, al que la ADN polimerasa puede agregar nuevos nucleótidos. Las primasas arqueales y eucariotas son proteínas heterodímeras con una subunidad reguladora grande y una subunidad catalítica minúscula. [2]
Los segmentos de ARN son sintetizados primero por la primasa y luego elongados por la ADN polimerasa. [3] Luego, la ADN polimerasa forma un complejo proteico con dos subunidades de primasa para formar el complejo alfa ADN Polimerasa primasa. La primasa es una de las polimerasas más propensas a errores y lentas. [3] Las primasas en organismos como E. coli sintetizan alrededor de 2000 a 3000 cebadores a una velocidad de un cebador por segundo. [4] La primasa también actúa como un mecanismo de detención para evitar que la cadena líder supere a la cadena rezagada al detener la progresión de la horquilla de replicación . [5] El paso determinante de la velocidad en la primasa es cuando se forma el primer enlace fosfodiéster entre dos moléculas de ARN. [3]
Los mecanismos de replicación difieren entre diferentes bacterias y virus , donde la primasa se une covalentemente a la helicasa en virus como el bacteriófago T7 . [5] En virus como el virus del herpes simple (HSV-1), la primasa puede formar complejos con la helicasa. [6] El complejo primasa-helicasa se utiliza para desenrollar el dsADN (bicatenario) y sintetiza la cadena rezagada utilizando cebadores de ARN [6] La mayoría de los cebadores sintetizados por la primasa tienen una longitud de dos a tres nucleótidos. [6]
Existen dos tipos principales de primasa: la DnaG, presente en la mayoría de las bacterias, y la superfamilia AEP (primasa arqueoeucariota), presente en las primasas arqueoeucariotas. Mientras que las primasas bacterianas ( de tipo DnaG ) están compuestas por una única unidad proteica (un monómero) y sintetizan cebadores de ARN, las primasas AEP suelen estar compuestas por dos unidades de primasa diferentes (un heterodímero) y sintetizan cebadores de dos partes con componentes de ARN y ADN. [7] Aunque funcionalmente son similares, las dos superfamilias de primasas evolucionaron independientemente una de la otra.
La estructura cristalina de la primasa en E. coli con un núcleo que contiene la proteína DnaG se determinó en el año 2000. [4] El complejo DnaG y primasa tiene forma de anacardo y contiene tres subdominios. [4] El subdominio central forma un pliegue superior que está hecho de una mezcla de cinco láminas beta y seis hélices alfa . [4] [8] El pliegue superior se utiliza para unir reguladores y metales. La primasa utiliza un dominio de fosfotransferencia para la coordinación de la transferencia de metales, lo que la distingue de otras polimerasas. [4] Las subunidades laterales contienen una terminal NH2 y COOH hecha de hélices alfa y láminas beta. [4] La terminal NH2 interactúa con un dominio de unión de zinc y una región terminal COOH que interactúa con DnaB - ID. [4]
El pliegue Toprim también se encuentra en la topoisomerasa y en la primasa/helicasa Twinkle mitocondrial. [8] Se han encontrado algunas primasas similares a DnaG (similares a las de las bacterias; InterPro : IPR020607 ) en genomas arqueológicos. [9]
Las primasas eucariotas y arqueales tienden a ser más similares entre sí, en términos de estructura y mecanismo, que con las primasas bacterianas. [10] [11] La superfamilia de las primasas arquea-eucariotas (AEP), a la que pertenecen la mayoría de las subunidades catalíticas de las primasas eucariotas y arqueales, ha sido recientemente redefinida como una familia de primasas-polimerasas en reconocimiento de las muchas otras funciones desempeñadas por las enzimas en esta familia. [12] Esta clasificación también enfatiza los amplios orígenes de las primasas AEP; ahora se reconoce que la superfamilia está en transición entre las funciones de ARN y ADN. [13]
Las primasas de arqueas y eucariotas son proteínas heterodímeras con una subunidad reguladora grande ( PRIM2 humana , p58) y una subunidad catalítica pequeña ( PRIM1 humana , p48/p49). [2] La subunidad grande contiene un grupo 4Fe–4S N-terminal, dividido en algunas arqueas como PriX/PriCT. [14] La subunidad grande está implicada en la mejora de la actividad y especificidad de la subunidad pequeña. Por ejemplo, eliminar la parte correspondiente a la subunidad grande en una proteína de fusión PolpTN2 da como resultado una enzima más lenta con actividad de transcriptasa inversa. [13]

La familia AEP de primasas-polimerasas tiene diversas características más allá de producir solo cebadores. Además de cebar el ADN durante la replicación, las enzimas AEP pueden tener funciones adicionales en el proceso de replicación del ADN, como la polimerización del ADN o ARN, la transferencia terminal , la síntesis de translesión (TLS) , la unión de extremos no homólogos (NHEJ) , [12] y posiblemente en el reinicio de las horquillas de replicación estancadas. [15] Las primasas típicamente sintetizan cebadores a partir de ribonucleótidos (NTP); sin embargo, las primasas con capacidades de polimerasa también tienen una afinidad por los desoxirribonucleótidos (dNTP). [16] [11] Las primasas con funcionalidad de transferasa terminal son capaces de agregar nucleótidos al extremo 3' de una cadena de ADN independientemente de una plantilla. Otras enzimas involucradas en la replicación del ADN, como las helicasas, también pueden exhibir actividad primasa. [17]
La PrimPol humana (ccdc111 [16] ) cumple funciones tanto de primasa como de polimerasa, como muchas primasas arqueales; exhibe actividad de transferasa terminal en presencia de manganeso; y desempeña un papel importante en la síntesis de translesión [18] y en el reinicio de las horquillas de replicación estancadas. PrimPol se recluta activamente a los sitios dañados a través de su interacción con RPA, una proteína adaptadora que facilita la replicación y reparación del ADN. [15] PrimPol tiene un dominio de dedo de zinc similar al de algunas primasas virales, que es esencial para la síntesis de translesión y la actividad de las primasas y puede regular la longitud del cebador. [18] A diferencia de la mayoría de las primasas, PrimPol es excepcionalmente capaz de iniciar cadenas de ADN con dNTP. [16]
La PriS, la subunidad pequeña de la primasa de las arqueas, tiene un papel en la síntesis translesional (TLS) y puede evitar las lesiones comunes del ADN. La mayoría de las arqueas carecen de las polimerasas especializadas que realizan la TLS en eucariotas y bacterias. [19] La PriS sola sintetiza preferentemente cadenas de ADN; pero en combinación con la PriL, la subunidad grande, aumenta la actividad de la ARN polimerasa. [20]
En Sulfolobus solfataricus , el heterodímero primasa PriSL puede actuar como primasa, polimerasa y transferasa terminal. Se cree que PriSL inicia la síntesis de cebadores con NTP y luego cambia a dNTP. La enzima puede polimerizar cadenas de ARN o ADN, y los productos de ADN pueden alcanzar una longitud de hasta 7000 nucleótidos (7 kb). Se sugiere que esta doble funcionalidad puede ser una característica común de las primasas arqueales. [11]
Las primasas multifuncionales AEP también aparecen en bacterias y fagos que las infectan. Pueden mostrar organizaciones de dominios novedosas con dominios que aportan aún más funciones más allá de la polimerización. [14]
La LigD bacteriana ( A0R3R7 ) está principalmente involucrada en la vía NHEJ. Tiene un dominio de polimerasa/primasa de la superfamilia AEP, un dominio de 3'-fosfoesterasa y un dominio de ligasa. También es capaz de desarrollar actividad de primasa, ADN y ARN polimerasa y transferasa terminal. La actividad de polimerización de ADN puede producir cadenas de más de 7000 nucleótidos (7 kb) de longitud, mientras que la polimerización de ARN produce cadenas de hasta 1 kb de longitud. [21]
Las enzimas AEP están muy extendidas y se pueden encontrar codificadas en elementos genéticos móviles, incluidos virus/fagos y plásmidos. Se utilizan como única proteína de replicación o en combinación con otras proteínas asociadas a la replicación, como las helicasas y, con menor frecuencia, las ADN polimerasas. [22] Mientras que la presencia de AEP en virus eucariotas y arqueales es esperable porque reflejan a sus hospedadores, [22] los virus bacterianos y los plásmidos también codifican con tanta frecuencia enzimas de la superfamilia AEP como primasas de la familia DnaG. [14] Se ha descubierto una gran diversidad de familias de AEP en varios plásmidos bacterianos mediante estudios de genómica comparativa . [14] Actualmente se desconoce su historia evolutiva, ya que las que se encuentran en bacterias y bacteriófagos parecen demasiado diferentes de sus homólogos arqueoeucariotas para una transferencia horizontal de genes reciente . [22]
La helicasa similar a MCM en la cepa ATCC 14579 de Bacillus cereus (BcMCM; Q81EV1 ) es una helicasa SF6 fusionada con una primasa AEP. La enzima tiene funciones de primasa y polimerasa además de la función de helicasa. El gen que la codifica se encuentra en un profago. [17] Tiene homología con el ORF904 del plásmido pRN1 de Sulfolobus islandicus , que tiene un dominio PrimPol de AEP. [23] El virus vaccinia D5 y la primasa HSV también son ejemplos de fusión de AEP-helicasa. [12] [6]
PolpTN2 es una primasa de Archaeal que se encuentra en el plásmido TN2. Es una fusión de dominios homólogos a PriS y PriL y exhibe actividad de primasa y ADN polimerasa, así como función de transferasa terminal. A diferencia de la mayoría de las primasas, PolpTN2 forma cebadores compuestos exclusivamente de dNTP. [13] Inesperadamente, cuando se truncó el dominio similar a PriL, PolpTN2 también pudo sintetizar ADN en la plantilla de ARN, es decir, actuó como una ADN polimerasa dependiente de ARN (transcriptasa inversa). [13]
Incluso las primasas DnaG pueden tener funciones adicionales, si se les asignan los dominios adecuados. El fago T7 gp4 es una fusión de primasa-helicasa DnaG y realiza ambas funciones en la replicación. [5]