Fibrodisplasia osificante progresiva ( / ˌ f aɪ b r oʊ d ɪ ˈ s p l eɪ ʒ ( i ) ə ɒ ˈ s ɪ f ɪ k æ n z p r ə ˈ ɡ r ɛ s ɪ v ə / ; [1] abbr FOP , también llamada enfermedad de Münchmeyer o anteriormente miositis osificante progresiva , es una enfermedad del tejido conectivo extremadamente rara en la que el tejido conectivo fibroso , como músculos , tendones y ligamentos , se convierte en tejido óseo . Es la única afección médica conocida en la que un sistema de órganos se transforma en otro. [2] Es un trastorno grave e incapacitante que no tiene cura.
La FOP es causada por una mutación del gen ACVR1 . La mutación afecta el mecanismo de reparación del cuerpo, provocando que el tejido fibroso, incluidos músculos , tendones y ligamentos , se osifique , ya sea de forma espontánea o cuando se daña como resultado de un trauma. En muchos casos, lesiones menores pueden hacer que las articulaciones se fusionen permanentemente a medida que se forma hueso nuevo, reemplazando el tejido muscular dañado. Esta nueva formación ósea (conocida como "osificación heterotópica") eventualmente forma un esqueleto secundario y restringe progresivamente la capacidad de movimiento del paciente. El hueso formado como resultado de este proceso es idéntico al hueso "normal", sólo que en lugares inadecuados. La evidencia circunstancial sugiere que la enfermedad puede causar degradación de las articulaciones aparte de su característico crecimiento óseo. [3]
Se ha demostrado que la extirpación quirúrgica del crecimiento óseo adicional hace que el cuerpo "repare" el área afectada con hueso adicional. Aunque la tasa de crecimiento óseo puede variar según el paciente, la afección finalmente deja a quienes la padecen inmovilizados a medida que el hueso nuevo reemplaza la musculatura y se fusiona con el esqueleto existente. Esto le ha valido a la FOP el sobrenombre de " enfermedad del hombre de piedra ". [4]
Por razones desconocidas, los niños que nacen con FOP a menudo tienen el dedo gordo del pie malformado , a veces les falta una articulación o, en otros casos, simplemente presentan un bulto notable en la articulación menor. [5] El primer "brote" que conduce a la formación de hueso FOP generalmente ocurre antes de los 10 años. [5] El crecimiento óseo generalmente progresa desde la parte superior del cuerpo hacia abajo, tal como crecen los huesos en los fetos. Un niño con FOP normalmente desarrollará huesos adicionales comenzando en el cuello, luego en los hombros, los brazos, el área del pecho y finalmente en los pies. [6]
Específicamente, la osificación suele observarse primero en las regiones dorsal, axial, craneal y proximal del cuerpo. Posteriormente la enfermedad progresa en las regiones ventral, apendicular, caudal y distal. [5] Sin embargo, no necesariamente ocurre en este orden debido a brotes causados por lesiones. A menudo, los bultos parecidos a tumores que caracterizan un brote de la enfermedad aparecen repentinamente.
El crecimiento óseo que se produce durante los brotes puede provocar la pérdida de movilidad de las articulaciones afectadas, lo que incluye, si la mandíbula/mandíbula está afectada, la incapacidad de abrir completamente la boca, lo que limita el habla y la alimentación. Una aparición específica de un brote de esta afección en las articulaciones del pie y el tobillo puede provocar una capacidad limitada para apoyar el pie en el suelo. [ cita necesaria ] El crecimiento óseo también puede provocar la inmovilización de la cadera o la rodilla, lo que afecta la capacidad del individuo para caminar. La formación extra de hueso alrededor de la caja torácica restringe la expansión de los pulmones y el diafragma, provocando complicaciones respiratorias. [5]
Dado que el trastorno solo ocurre en 1 de cada 2 millones de personas y es increíblemente raro, la afección puede diagnosticarse erróneamente como cáncer o fibrosis . Esto lleva a los médicos a solicitar biopsias que pueden exacerbar el crecimiento del hueso FOP. [7] La presencia de dedos de los pies o pulgares malformados en aquellos que nacen con FOP ayuda a distinguir este trastorno de otros problemas esqueléticos. [8]
Con un tratamiento médico adecuado, la edad media de supervivencia es de 40 años. Sin embargo, el diagnóstico tardío, los traumatismos y las infecciones pueden disminuir la esperanza de vida. [9]
La FOP es causada por un alelo autosómico dominante en el cromosoma 2q23-24. [10] El alelo tiene expresividad variable, pero penetrancia completa . La mayoría de los casos son causados por mutaciones espontáneas en los gametos ; la mayoría de las personas con FOP no pueden o eligen no tener hijos. Una enfermedad similar pero menos catastrófica es la displasia fibrosa , que es causada por una mutación poscigótica .
Una mutación en el gen ACVR1 (también conocido como quinasa 2 similar a la activina (ALK2)) es responsable de la enfermedad. [10] ACVR1 codifica el receptor de activina tipo 1, un receptor BMP tipo 1. La mutación provoca la sustitución del codón 206 de arginina a histidina en la proteína ACVR1. [11] [12] Esta sustitución provoca una activación anormal de ACVR1, lo que lleva a la transformación del tejido conectivo y del tejido muscular en un esqueleto secundario. Esto hace que las células endoteliales se transformen en células madre mesenquimales y luego en hueso. [13] Normalmente, el gen ACVR1 codifica la quinasa transmembrana tipo 1 del receptor de activina que se une a los receptores BMP (BMPR tipo I y BMPR tipo II) para la señalización de la condrogénesis . Las BMP pertenecen a una superfamilia de proteínas conocidas como proteínas del factor de crecimiento transformante beta ( TGF- β ). La unión de la proteína ACVR1 a los receptores BMP inicia una cascada de señalización que es crucial para inducir la formación de hueso endocondral durante el desarrollo, así como la homeostasis esquelética y tisular . [14]
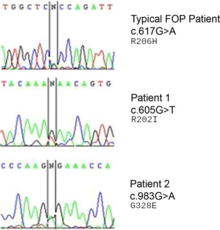
La FOP es un trastorno autosómico dominante . Por lo tanto, un hijo de un padre heterocigoto afectado y un padre no afectado tiene un 50% de probabilidad de estar afectado. Dos individuos afectados pueden producir hijos no afectados. Dos individuos no afectados pueden producir una descendencia afectada como resultado de la mutación del gen. La forma homocigota dominante es más grave que la forma heterocigota. [15]
La proteína que causa la osificación normalmente es desactivada por una proteína inhibidora después de que los huesos del feto se forman en el útero, pero en pacientes con FOP, la proteína sigue funcionando. La formación ósea aberrante en pacientes con FOP ocurre cuando el tejido conectivo lesionado o las células musculares en los sitios de lesión o crecimiento expresan incorrectamente una enzima para la reparación ósea durante la apoptosis (muerte celular autorregulada), lo que resulta en linfocitos que contienen un exceso de proteína morfogenética ósea 4 (BMP4). ) proporcionada durante la respuesta del sistema inmunológico. El hueso resultante se produce independientemente del esqueleto normal, formando sus propios elementos esqueléticos discretos. Estos elementos, sin embargo, pueden fusionarse con el hueso esquelético normal. [16] En este proceso se respetan el diafragma, la lengua y los músculos extraoculares, así como el músculo cardíaco y liso . [5] Dado que la enzima incorrecta permanece sin resolver dentro de la respuesta inmune, el cuerpo continúa proporcionando linfocitos que contienen BMP4 incorrectos. BMP4 es un producto que contribuye al desarrollo del esqueleto en el embrión normal. [17]
El gen ACVR1 codifica un receptor de proteína morfogénica ósea (BMP); este gen está mutado en FOP. Es responsable del crecimiento y desarrollo de huesos y músculos. La mutación típica, R202H, hace que el inhibidor FKBP1A se una menos estrechamente al bucle GS de activación. [18] El resultado es que ACVR1 no se desactiva de manera efectiva y se produce un crecimiento excesivo de hueso y cartílago y fusión de las articulaciones. [19] Las mutaciones atípicas que involucran otros residuos funcionan de manera similar. En algunos casos, el receptor puede terminar indicando que está activo sin estar unido a su ligando activador. [20]
La mayoría de los casos de FOP fueron el resultado de una nueva mutación genética: estas personas no tenían antecedentes de este trastorno en particular en su familia. Hay algunos casos en los que el individuo ha heredado la mutación de uno de los padres afectados. [19]
Generalmente, la FOP se puede diagnosticar con radiografías . El diagnóstico precoz de este trastorno mediante radiología es muy importante para evitar investigaciones invasivas innecesarias como las biopsias . El trauma más pequeño o trivial o las inyecciones intramusculares pueden amplificar la progresión de la enfermedad a través de la inflamación, de ahí la preferencia de la radiología. Los médicos deben ser conscientes de esta rara entidad, ya que con frecuencia se diagnostica erróneamente como cáncer u otras entidades benignas como una infección, lo que da lugar a biopsias que a menudo pueden acelerar la progresión de la enfermedad. [21]
Los brotes pueden medirse clínicamente por niveles elevados de fosfatasa alcalina y fosfatasa alcalina específica de los huesos . [22] Otro signo revelador de FOP es un dedo gordo del pie acortado con un primer metatarsiano distal malformado y una primera falange y/o articulación interfalángica faltante o anormal. [23]
Si bien la FOP sigue sin cura, un avance prometedor reside en el tratamiento aprobado, Sohonos ( palovaroteno ). [24] En particular, los intentos de extirpar quirúrgicamente hueso en un paciente con FOP pueden provocar un crecimiento explosivo de hueso nuevo. [25] Mientras están bajo anestesia , las personas con FOP pueden encontrar dificultades con la intubación , enfermedad pulmonar restrictiva y cambios en el sistema de conducción eléctrica del corazón . [26] Se deben evitar las actividades que aumentan el riesgo de caídas o lesiones de tejidos blandos, ya que incluso un traumatismo menor puede provocar una osificación heterotópica . [27]
Aunque no existen tratamientos definitivos eficaces para el trastorno, existen tratamientos intermitentes, como medicamentos antiinflamatorios, para suprimir la inflamación como resultado de brotes o inflamación por daño muscular. Actualmente, la cirugía generalmente no se recomienda para personas con FOP, ya que puede provocar una rápida formación de hueso en los sitios de incisión o donde se han aplicado suturas al músculo o al tejido conectivo. Se puede considerar una cirugía que salve vidas; sin embargo, desarrollar un plan quirúrgico con el aporte de un especialista en FOP puede considerarse la mejor práctica. La liberación quirúrgica de las contracturas articulares generalmente no tiene éxito y corre el riesgo de una nueva osificación heterotópica inducida por el trauma. [28]
Hasta 2017 [update], se han confirmado aproximadamente 800 casos de FOP en todo el mundo, lo que convierte a la FOP en una de las enfermedades más raras conocidas. [29] La incidencia estimada de FOP es de 0,5 casos por millón de personas y afecta a todas las etnias. [29]
Los informes médicos que describen a personas afectadas por FOP se remontan al Dr. Guy Patin en 1692. [29] La FOP originalmente se llamaba miositis osificante progresiva y se pensaba que era causada por una inflamación muscular ( miositis ) que causaba la formación de hueso. [29] Victor A. McKusick cambió el nombre de la enfermedad en 1970 tras el descubrimiento de que el proceso de la enfermedad también afectaba a tejidos blandos distintos de los músculos (por ejemplo, ligamentos ). [29]
El caso de FOP más conocido es el de Harry Eastlack (1933-1973). Su condición comenzó a desarrollarse a la edad de diez años, y cuando murió por neumonía en noviembre de 1973, seis días antes de cumplir 40 años, su cuerpo se había osificado por completo, dejándolo solo capaz de mover los labios. Eastlack nunca conoció a otra persona con FOP durante su vida. [30]
Eastlack donó su cuerpo a la ciencia y su esqueleto se encuentra ahora en el Museo Mütter de Filadelfia , y ha demostrado ser una fuente invaluable de información en el estudio de la FOP. Otra persona con FOP, Carol Orzel (20 de abril de 1959 - febrero de 2018), también donó su cuerpo al museo y su esqueleto se exhibió allí, junto al de Eastlack, en febrero de 2019. [31] [32]
Los ensayos clínicos de isotretinoína , etidronato con corticosteroides orales y maleato de perhexilina no han logrado demostrar eficacia, aunque el curso variable de la enfermedad y la pequeña prevalencia inducen incertidumbre. [22]
Un puñado de compañías farmacéuticas centradas en enfermedades raras se encuentran actualmente en distintas etapas de investigación sobre diferentes enfoques terapéuticos para la FOP.
En agosto de 2015, la Oficina de Desarrollo de Productos Huérfanos de la Administración de Alimentos y Medicamentos de EE. UU. (FDA) otorgó a La Jolla Pharmaceuticals la designación de medicamento huérfano para dos nuevos compuestos para FOP. Los compuestos son inhibidores de la proteína quinasa de molécula pequeña diseñados para bloquear selectivamente ACVR1 (ALK2). [38]
En agosto de 2015, Clementia Pharmaceuticals también comenzó la inscripción de niños (de 6 años en adelante) en su ensayo clínico de Fase II que investiga el palovaroteno para el tratamiento de la FOP. [39] Los estudios preclínicos demostraron que el palovaroteno, un agonista del receptor gamma del ácido retinoico, bloqueó la formación ósea anormal en modelos animales mediante la inhibición de los sistemas de mensajeros secundarios en la vía de BMP. [40] Clementia obtuvo la licencia de palovaroteno de Roche Pharmaceuticals, que previamente evaluó el compuesto en más de 800 personas, incluidos voluntarios sanos y pacientes con enfermedad pulmonar obstructiva crónica. El palovaroteno recibió la designación Fast Track de la FDA y la designación de huérfano para el tratamiento de FOP tanto de la FDA como de la Agencia Europea de Medicamentos (EMA). [39]
En septiembre de 2015, Regeneron anunció nuevos conocimientos sobre el mecanismo de la enfermedad que implica la activación del receptor ACVR1 por la activina A. En 2016, la empresa inició un estudio de fase 1 de su anticuerpo de activina, REGN 2477 , en voluntarios sanos; en 2017 se realizó un ensayo de fase 2 en pacientes con FOP. [41]
Otro posible enfoque terapéutico implica la interferencia de ARN específica de alelo que se dirige al ARNm mutado para su degradación y al mismo tiempo preserva la expresión normal del gen ACVR1. [42]
Una mayor investigación sobre los mecanismos de formación de hueso heterotópico en FOP podría ayudar en el desarrollo de tratamientos para otros trastornos que implican la formación de hueso extraesquelético.
Los progenitores fibro/adipogénicos (FAP) pueden ser el tipo de célula causante de la enfermedad responsable de la formación de hueso ectópico dependiente de activina A tanto en los músculos como en los tendones de ratones portadores de la FOP que causa la mutación ACVR1 (R206H). [43]
En diciembre de 2019, Ipsen emitió una suspensión clínica parcial para personas menores de 14 años, debido a informes de fusión temprana de placas de crecimiento.
Recientemente, a partir de 2021 [update], un posible candidato terapéutico, saracatinib , se encuentra en ensayos clínicos de fase III como un potente inhibidor de la osificación heterotópica en ratones de tipo salvaje y mutantes ACVR1. [44]