

La espermatogénesis es el proceso mediante el cual se desarrollan espermatozoides haploides a partir de células germinales en los túbulos seminíferos del testículo . Este proceso comienza con la división mitótica de las células madre ubicadas cerca de la membrana basal de los túbulos. [1] Estas células se llaman células madre espermatogoniales . La división mitótica de estas produce dos tipos de células. Las células tipo A reponen las células madre y las células tipo B se diferencian en espermatocitos primarios . El espermatocito primario se divide meióticamente ( meiosis I) en dos espermatocitos secundarios; cada espermatocito secundario se divide en dos espermátidas haploides iguales mediante la Meiosis II. Las espermátidas se transforman en espermatozoides (espermatozoides) mediante el proceso de espermiogénesis . Estos se convierten en espermatozoides maduros, también conocidos como espermatozoides . [2] Así, el espermatocito primario da origen a dos células, los espermatocitos secundarios, y los dos espermatocitos secundarios por su subdivisión producen cuatro espermatozoides y cuatro células haploides. [3]
Los espermatozoides son los gametos masculinos maduros en muchos organismos que se reproducen sexualmente. Así, la espermatogénesis es la versión masculina de la gametogénesis , de la cual el equivalente femenino es la ovogénesis . En los mamíferos ocurre en los túbulos seminíferos de los testículos masculinos de forma escalonada. La espermatogénesis depende en gran medida de las condiciones óptimas para que el proceso se produzca correctamente y es esencial para la reproducción sexual . La metilación del ADN y la modificación de histonas han sido implicadas en la regulación de este proceso. [4] Comienza durante la pubertad y generalmente continúa ininterrumpidamente hasta la muerte, aunque se puede discernir una ligera disminución en la cantidad de esperma producido con el aumento de la edad (ver Infertilidad masculina ).
La espermatogénesis comienza en la parte inferior de los tubos seminíferos y, progresivamente, las células van profundizando en los tubos y avanzando a lo largo de ellos hasta que los espermatozoides maduros alcanzan la luz, donde se depositan los espermatozoides maduros. La división ocurre de forma asincrónica; si el tubo se corta transversalmente se podrían observar diferentes estados de maduración. Un grupo de células con diferentes estados de maduración que se están generando al mismo tiempo se denomina onda espermatogénica. [5]
La espermatogénesis produce gametos masculinos maduros, comúnmente llamados espermatozoides pero más específicamente conocidos como espermatozoides , que son capaces de fertilizar al gameto femenino homólogo, el ovocito , durante la concepción para producir un individuo unicelular conocido como cigoto . Esta es la piedra angular de la reproducción sexual e implica que los dos gametos contribuyan con la mitad del conjunto normal de cromosomas ( haploide ) para dar como resultado un cigoto cromosómicamente normal ( diploide ).
Para preservar la cantidad de cromosomas en la descendencia, que difiere según la especie , uno de cada gameto debe tener la mitad de la cantidad habitual de cromosomas presentes en otras células del cuerpo. De lo contrario, la descendencia tendrá el doble de cromosomas normales y pueden producirse anomalías graves. En los seres humanos, las anomalías cromosómicas que surgen de una espermatogénesis incorrecta provocan defectos congénitos y defectos congénitos anormales ( síndrome de Down , síndrome de Klinefelter ) y, en la mayoría de los casos, aborto espontáneo del feto en desarrollo.
La espermatogénesis tiene lugar dentro de varias estructuras del sistema reproductivo masculino . Las etapas iniciales ocurren dentro de los testículos y progresan hacia el epidídimo donde los gametos en desarrollo maduran y se almacenan hasta la eyaculación . Los túbulos seminíferos de los testículos son el punto de partida del proceso, donde las células madre espermatogoniales adyacentes a la pared del túbulo interno se dividen en dirección centrípeta, comenzando en las paredes y avanzando hacia la parte más interna, o luz , para producir espermatozoides inmaduros. [2] La maduración ocurre en el epidídimo. La ubicación [Testículos/Escroto] es específicamente importante ya que el proceso de espermatogénesis requiere una temperatura más baja para producir espermatozoides viables, específicamente 1°-8 °C menos que la temperatura corporal normal de 37 °C (98,6 °F). [6] Clínicamente, las pequeñas fluctuaciones de temperatura, como las de una correa de soporte atlética, no causan ningún deterioro en la viabilidad o el recuento de espermatozoides. [7]
Para los seres humanos, se estima que todo el proceso de espermatogénesis dura 74 días [8] [9] (según biopsias marcadas con tritio) y aproximadamente 120 días [10] (según mediciones del reloj del ADN). Incluyendo el transporte en sistema de ductales, la duración es de 3 meses. Los testículos producen entre 200 y 300 millones de espermatozoides al día. [11] Sin embargo, sólo alrededor de la mitad o 100 millones de estos se convierten en espermatozoides viables. [12]
Todo el proceso de espermatogénesis se puede dividir en varias etapas distintas, cada una de las cuales corresponde a un tipo particular de célula humana. En la siguiente tabla, la ploidía, el número de copias y los recuentos de cromosomas/cromátidas son para una célula, generalmente antes de la síntesis y división del ADN (en G1, si corresponde). El espermatocito primario se detiene después de la síntesis de ADN y antes de la división.


La espermatocitogénesis es la forma masculina de gametocitogénesis y da como resultado la formación de espermatocitos que poseen la mitad del complemento normal de material genético. En la espermatocitogénesis, un espermatogonio diploide , que reside en el compartimento basal de los túbulos seminíferos, se divide mitóticamente, produciendo dos células intermedias diploides llamadas espermatocitos primarios . Cada espermatocito primario luego pasa al compartimento adluminal de los túbulos seminíferos y duplica su ADN y posteriormente sufre meiosis I para producir dos espermatocitos secundarios haploides , que luego se dividirán una vez más en espermátidas haploides . Esta división implica fuentes de variación genética, como la inclusión aleatoria de cualquiera de los cromosomas parentales y el cruce cromosómico que aumenta la variabilidad genética del gameto. La maquinaria de respuesta al daño del ADN (DDR) juega un papel importante en la espermatogénesis. La proteína FMRP se une a los cromosomas meióticos y regula la dinámica de la maquinaria DDR durante la espermatogénesis. [13] La FMRP parece ser necesaria para la reparación del daño del ADN .
Cada división celular de un espermatogonio a una espermátida es incompleta; las células permanecen conectadas entre sí mediante puentes de citoplasma para permitir un desarrollo sincrónico. No todas las espermatogonias se dividen para producir espermatocitos; de lo contrario, se agotaría el suministro de espermatogonias. En cambio, las células madre espermatogoniales se dividen mitóticamente para producir copias de sí mismas, asegurando un suministro constante de espermatogonias para impulsar la espermatogénesis. [14]
La espermatidogénesis es la creación de espermátidas a partir de espermatocitos secundarios. Los espermatocitos secundarios producidos anteriormente entran rápidamente en la meiosis II y se dividen para producir espermátidas haploides. La brevedad de esta etapa significa que rara vez se ven espermatocitos secundarios en los estudios histológicos .
Durante la espermiogénesis, las espermátidas comienzan a formar una cola mediante el crecimiento de microtúbulos en uno de los centriolos, que se convierte en un cuerpo basal. Estos microtúbulos forman un axonema . Posteriormente el centríolo se modifica en el proceso de reducción del centrosoma . [15] La parte anterior de la cola (llamada pieza media) se espesa porque las mitocondrias están dispuestas alrededor del axonema para asegurar el suministro de energía. El ADN de las espermátidas también se empaqueta y se condensa mucho. El ADN se empaqueta en primer lugar con proteínas básicas nucleares específicas, que posteriormente se reemplazan con protaminas durante el alargamiento de las espermátidas. La cromatina compacta resultante es transcripcionalmente inactiva. El aparato de Golgi rodea el núcleo ahora condensado, convirtiéndose en el acrosoma .
Luego, la maduración tiene lugar bajo la influencia de la testosterona, que elimina el citoplasma y los orgánulos innecesarios restantes . El exceso de citoplasma, conocido como cuerpos residuales , es fagocitado por las células de Sertoli circundantes en los testículos . Los espermatozoides resultantes ahora están maduros pero carecen de motilidad. Los espermatozoides maduros se liberan de las células protectoras de Sertoli hacia la luz del túbulo seminífero en un proceso llamado espermiación .
Los espermatozoides inmóviles son transportados al epidídimo en el líquido testicular secretado por las células de Sertoli con la ayuda de la contracción peristáltica . Mientras que en el epidídimo los espermatozoides ganan motilidad y se vuelven capaces de fertilizar. Sin embargo, el transporte de los espermatozoides maduros a través del resto del sistema reproductivo masculino se logra mediante la contracción muscular en lugar de la motilidad recientemente adquirida por los espermatozoides.
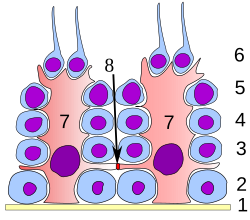
En todas las etapas de diferenciación, las células espermatogénicas están en estrecho contacto con las células de Sertoli, que se cree que brindan apoyo estructural y metabólico a los espermatozoides en desarrollo. Una sola célula de Sertoli se extiende desde la membrana basal hasta la luz del túbulo seminífero, aunque los procesos citoplasmáticos son difíciles de distinguir al nivel del microscopio óptico.
Las células de Sertoli cumplen una serie de funciones durante la espermatogénesis y apoyan a los gametos en desarrollo de las siguientes maneras:
Las moléculas de adhesión intercelular ICAM-1 y la ICAM-1 soluble tienen efectos antagónicos sobre las uniones estrechas que forman la barrera hematotesticular. [17] Las moléculas de ICAM-2 regulan la adhesión de las espermátidas en el lado apical de la barrera (hacia la luz ). [17]
El proceso de espermatogénesis es muy sensible a las fluctuaciones del medio ambiente, particularmente a las hormonas y la temperatura. Se requiere testosterona en grandes concentraciones locales para mantener el proceso, que se logra mediante la unión de testosterona por la proteína fijadora de andrógenos presente en los túbulos seminíferos. La testosterona es producida por las células intersticiales, también conocidas como células de Leydig , que residen adyacentes a los túbulos seminíferos.
El epitelio seminífero es sensible a las temperaturas elevadas en humanos y algunas otras especies, y se verá afectado negativamente por temperaturas tan altas como la temperatura corporal normal. Además, las espermatogonias no alcanzan la madurez a la temperatura corporal en la mayoría de los mamíferos, ya que la β-polimerasa y la recombinasa espermatogénica necesitan una temperatura óptima específica. [18] En consecuencia, los testículos se encuentran fuera del cuerpo en un saco de piel llamado escroto . La temperatura óptima se mantiene a 2 °C ( hombre ) (8 °C ratón ) por debajo de la temperatura corporal. Esto se logra regulando el flujo sanguíneo [19] y acercándolo y alejándolo del calor del cuerpo mediante el músculo cremastérico y el músculo liso dartos en el escroto.
Un mecanismo importante es el intercambio térmico entre los torrentes sanguíneos arterial y venoso testicular. Las disposiciones anatómicas especializadas constan de dos zonas que se enrollan a lo largo de la arteria espermática interna. Esta disposición anatómica prolonga el tiempo de contacto y el intercambio térmico entre los torrentes sanguíneos arterial y venoso testicular y puede, en parte, explicar el gradiente de temperatura entre la sangre arterial aórtica y testicular reportado en perros y carneros. Además, la reducción de la presión del pulso se produce en el tercio proximal de la longitud enrollada de la arteria espermática interna. [ se necesita aclaración ] [20] [21] Además, la actividad de la recombinasa espermatogénica disminuye, y se supone que esto es un factor importante en la degeneración de los testículos. [ se necesita aclaración ] [22]
Las deficiencias dietéticas (como las vitaminas B, E y A), los esteroides anabólicos , los metales (cadmio y plomo), la exposición a los rayos X, las dioxinas , el alcohol y las enfermedades infecciosas también afectarán negativamente la tasa de espermatogénesis. [23] Además, la línea germinal masculina es susceptible al daño en el ADN causado por el estrés oxidativo, y este daño probablemente tenga un impacto significativo en la fertilización y el embarazo. [24] La exposición a pesticidas también afecta la espermatogénesis. [25]
El control hormonal de la espermatogénesis varía entre especies. En los seres humanos el mecanismo no se comprende completamente; sin embargo, se sabe que el inicio de la espermatogénesis ocurre en la pubertad debido a la interacción del hipotálamo , la glándula pituitaria y las células de Leydig . Si se extirpa la glándula pituitaria, la hormona folículo estimulante (FSH) y la testosterona aún pueden iniciar la espermatogénesis . [26] A diferencia de la FSH, la hormona luteinizante (LH) parece tener poco papel en la espermatogénesis aparte de inducir la producción de testosterona gonadal. [26] [27]
La FSH estimula tanto la producción de proteína fijadora de andrógenos (ABP) por las células de Sertoli como la formación de la barrera hematotesticular . La ABP es esencial para concentrar la testosterona en niveles lo suficientemente altos como para iniciar y mantener la espermatogénesis. Los niveles de testosterona intratesticular son de 20 a 100 o de 50 a 200 veces más altos que la concentración encontrada en la sangre, aunque existe una variación de 5 a 10 veces entre hombres sanos. [28] [29] La producción de testosterona no permanece constante durante todo el día, sino que sigue un ritmo circadiano. El pico máximo de testosterona se produce a las 8 de la mañana, lo que explica por qué los hombres sufren con frecuencia erecciones matutinas. En los hombres más jóvenes, los picos de testosterona son mayores. La FSH puede iniciar el secuestro de testosterona en los testículos, pero una vez desarrollada sólo se requiere testosterona para mantener la espermatogénesis. [26] Sin embargo, aumentar los niveles de FSH aumentará la producción de espermatozoides al prevenir la apoptosis de las espermatogonias tipo A. La hormona inhibina actúa para disminuir los niveles de FSH. Los estudios de modelos de roedores sugieren que las gonadotropinas (tanto LH como FSH) apoyan el proceso de espermatogénesis al suprimir las señales proapoptóticas y, por lo tanto, promueven la supervivencia de las células espermatogénicas. [30]
Las propias células de Sertoli median partes de la espermatogénesis mediante la producción de hormonas. Son capaces de producir las hormonas estradiol e inhibina. Las células de Leydig también son capaces de producir estradiol además de su principal producto, la testosterona. Se ha descubierto que el estrógeno es esencial para la espermatogénesis en animales. [31] [32] Sin embargo, se descubrió que un hombre con síndrome de insensibilidad al estrógeno (un ERα defectuoso) produce espermatozoides con un recuento de espermatozoides normal , aunque con una viabilidad de espermatozoides anormalmente baja ; No está claro si era estéril o no. [33] Los niveles de estrógeno demasiado altos pueden ser perjudiciales para la espermatogénesis debido a la supresión de la secreción de gonadotropinas y, por extensión, la producción intratesticular de testosterona. [34] La conexión entre la espermatogénesis y los niveles de prolactina parece ser moderada, y los niveles óptimos de prolactina reflejan una producción eficiente de esperma. [27] [35]
Los trastornos de la espermatogénesis pueden causar oligospermia , que es semen con una baja concentración de espermatozoides [36] y es un hallazgo común en la infertilidad masculina .
≠