La duplicación genética (o duplicación cromosómica o amplificación genética ) es un mecanismo importante a través del cual se genera nuevo material genético durante la evolución molecular . Puede definirse como cualquier duplicación de una región de ADN que contiene un gen . Las duplicaciones genéticas pueden surgir como producto de varios tipos de errores en la maquinaria de replicación y reparación del ADN , así como a través de la captura fortuita por elementos genéticos egoístas. Las fuentes comunes de duplicaciones genéticas incluyen recombinación ectópica , evento de retrotransposición , aneuploidía , poliploidía y deslizamiento de replicación . [1]
Las duplicaciones surgen de un evento denominado entrecruzamiento desigual que ocurre durante la meiosis entre cromosomas homólogos desalineados. La probabilidad de que esto ocurra es una función del grado de intercambio de elementos repetitivos entre dos cromosomas. Los productos de esta recombinación son una duplicación en el sitio del intercambio y una deleción recíproca. La recombinación ectópica está mediada típicamente por la similitud de secuencia en los puntos de ruptura duplicados, que forman repeticiones directas. Los elementos genéticos repetitivos, como los elementos transponibles , ofrecen una fuente de ADN repetitivo que puede facilitar la recombinación, y a menudo se encuentran en los puntos de ruptura de la duplicación en plantas y mamíferos. [2]

El deslizamiento de replicación es un error en la replicación del ADN que puede producir duplicaciones de secuencias genéticas cortas. Durante la replicación , la ADN polimerasa comienza a copiar el ADN. En algún momento durante el proceso de replicación, la polimerasa se disocia del ADN y la replicación se detiene. Cuando la polimerasa se vuelve a unir a la cadena de ADN, alinea la cadena replicante en una posición incorrecta y, por accidente, copia la misma sección más de una vez. El deslizamiento de replicación también suele verse facilitado por secuencias repetitivas, pero solo requiere unas pocas bases de similitud. [ cita requerida ]
Los retrotransposones , principalmente L1 , pueden actuar ocasionalmente sobre el ARNm celular. Las transcripciones se transcriben de forma inversa a ADN y se insertan en un lugar aleatorio del genoma, creando retrogenes. La secuencia resultante generalmente carece de intrones y a menudo contiene secuencias poli(A) que también están integradas en el genoma. Muchos retrogenes muestran cambios en la regulación génica en comparación con sus secuencias génicas parentales, lo que a veces da como resultado funciones novedosas. Los retrogenes pueden moverse entre diferentes cromosomas para dar forma a la evolución cromosómica. [3]
La aneuploidía se produce cuando la no disyunción en un solo cromosoma da como resultado un número anormal de cromosomas. La aneuploidía suele ser perjudicial y en los mamíferos suele provocar abortos espontáneos. Algunos individuos aneuploides son viables, por ejemplo, la trisomía 21 en humanos, que provoca el síndrome de Down . La aneuploidía suele alterar la dosificación de genes de formas que son perjudiciales para el organismo; por lo tanto, es poco probable que se propague a través de las poblaciones.
La poliploidía , o duplicación de todo el genoma , es un producto de la no disyunción durante la meiosis que da como resultado copias adicionales de todo el genoma. La poliploidía es común en las plantas, pero también ha ocurrido en animales, con dos rondas de duplicación de todo el genoma ( evento 2R ) en el linaje de vertebrados que conducen a los humanos. [4] También ha ocurrido en las levaduras hemiascomicetas hace unos 100 millones de años. [5] [6]
Después de una duplicación completa del genoma, hay un período relativamente corto de inestabilidad genómica, pérdida extensa de genes, niveles elevados de sustitución de nucleótidos y recableado de la red reguladora. [7] [8] Además, los efectos de la dosis genética juegan un papel importante. [9] Por lo tanto, la mayoría de los duplicados se pierden en un período corto, sin embargo, una fracción considerable de duplicados sobrevive. [10] Curiosamente, los genes involucrados en la regulación se retienen preferentemente. [11] [12] Además, la retención de genes reguladores, más notablemente los genes Hox , ha llevado a la innovación adaptativa.
Se ha observado una rápida evolución y divergencia funcional a nivel de la transcripción de genes duplicados, generalmente por mutaciones puntuales en motivos cortos de unión a factores de transcripción. [13] [14] Además, la rápida evolución de los motivos de fosforilación de proteínas, generalmente incrustados en regiones intrínsecamente desordenadas de rápida evolución, es otro factor que contribuye a la supervivencia y la rápida adaptación/neofuncionalización de genes duplicados. [15] Por lo tanto, parece existir un vínculo entre la regulación genética (al menos a nivel postraduccional) y la evolución del genoma. [15]
La poliploidía también es una fuente conocida de especiación, ya que los descendientes, que tienen un número diferente de cromosomas en comparación con las especies parentales, a menudo no pueden cruzarse con organismos no poliploides. Se cree que las duplicaciones de todo el genoma son menos perjudiciales que la aneuploidía, ya que la dosis relativa de genes individuales debería ser la misma.

Las comparaciones de genomas demuestran que las duplicaciones de genes son comunes en la mayoría de las especies investigadas. Esto se indica por números de copias variables ( variación del número de copias ) en el genoma de los humanos [16] [17] o las moscas de la fruta. [18] Sin embargo, ha sido difícil medir la tasa a la que ocurren tales duplicaciones. Estudios recientes produjeron una primera estimación directa de la tasa de duplicación de genes en todo el genoma en C. elegans , el primer eucariota multicelular para el que tal estimación estuvo disponible. La tasa de duplicación de genes en C. elegans es del orden de 10 −7 duplicaciones/gen/generación, es decir, en una población de 10 millones de gusanos, uno tendrá una duplicación de genes por generación. Esta tasa es dos órdenes de magnitud mayor que la tasa espontánea de mutación puntual por sitio de nucleótido en esta especie. [19] Estudios más antiguos (indirectos) informaron tasas de duplicación específicas de locus en bacterias, Drosophila y humanos que oscilaban entre 10 −3 y 10 −7 /gen/generación. [20] [21] [22]
Las duplicaciones de genes son una fuente esencial de novedad genética que puede conducir a la innovación evolutiva. La duplicación crea redundancia genética, donde la segunda copia del gen a menudo está libre de presión selectiva , es decir, las mutaciones del mismo no tienen efectos nocivos para su organismo anfitrión. Si una copia de un gen experimenta una mutación que afecta su función original, la segunda copia puede servir como una "pieza de repuesto" y continuar funcionando correctamente. Por lo tanto, los genes duplicados acumulan mutaciones más rápido que un gen funcional de una sola copia, a lo largo de generaciones de organismos, y es posible que una de las dos copias desarrolle una función nueva y diferente. Algunos ejemplos de dicha neofuncionalización son la aparente mutación de un gen digestivo duplicado en una familia de peces de hielo en un gen anticongelante y la duplicación que conduce a un nuevo gen de veneno de serpiente [23] y la síntesis de 1 beta-hidroxitestosterona en cerdos. [24]
Se cree que la duplicación de genes desempeña un papel importante en la evolución ; esta postura ha sido sostenida por miembros de la comunidad científica durante más de 100 años. [25] Susumu Ohno fue uno de los desarrolladores más famosos de esta teoría en su libro clásico Evolution by gene duplication (1970). [26] Ohno argumentó que la duplicación de genes es la fuerza evolutiva más importante desde la aparición del ancestro común universal . [27] Los principales eventos de duplicación del genoma pueden ser bastante comunes. Se cree que todo el genoma de la levadura experimentó una duplicación hace unos 100 millones de años. [28] Las plantas son los duplicadores de genoma más prolíficos. Por ejemplo, el trigo es hexaploide (un tipo de poliploide ), lo que significa que tiene seis copias de su genoma.
Otro posible destino de los genes duplicados es que ambas copias tengan la misma libertad de acumular mutaciones degenerativas, siempre que los defectos sean complementados por la otra copia. Esto conduce a una " subfuncionalización " neutra (un proceso de evolución neutra constructiva ) o modelo DDC (duplicación-degeneración-complementación), [29] [30] en el que la funcionalidad del gen original se distribuye entre las dos copias. No se puede perder ningún gen, ya que ambos realizan ahora funciones importantes no redundantes, pero en última instancia ninguno es capaz de lograr una funcionalidad nueva.
La subfuncionalización puede ocurrir a través de procesos neutrales en los que las mutaciones se acumulan sin efectos perjudiciales o beneficiosos. Sin embargo, en algunos casos la subfuncionalización puede ocurrir con claros beneficios adaptativos. Si un gen ancestral es pleiotrópico y realiza dos funciones, a menudo ninguna de estas dos funciones puede modificarse sin afectar a la otra función. De esta manera, la partición de las funciones ancestrales en dos genes separados puede permitir la especialización adaptativa de las subfunciones, proporcionando así un beneficio adaptativo. [31]
A menudo, la variación genómica resultante conduce a trastornos neurológicos dependientes de la dosis de genes, como el síndrome similar al de Rett y la enfermedad de Pelizaeus-Merzbacher . [32] Es probable que estas mutaciones perjudiciales se pierdan de la población y no se conserven ni desarrollen funciones novedosas. Sin embargo, muchas duplicaciones, de hecho, no son perjudiciales ni beneficiosas, y estas secuencias neutrales pueden perderse o propagarse a través de la población a través de fluctuaciones aleatorias mediante la deriva genética .
Los dos genes que existen después de un evento de duplicación génica se denominan parálogos y, por lo general, codifican proteínas con una función y/o estructura similar. Por el contrario, los genes ortólogos presentes en diferentes especies derivan originalmente de la misma secuencia ancestral. (Véase Homología de secuencias en genética ).
Es importante (aunque a menudo difícil) diferenciar entre parálogos y ortólogos en la investigación biológica. Los experimentos sobre la función de los genes humanos a menudo se pueden llevar a cabo en otras especies si se puede encontrar un homólogo de un gen humano en el genoma de esa especie, pero solo si el homólogo es ortólogo. Si son parálogos y resultaron de un evento de duplicación génica, es probable que sus funciones sean demasiado diferentes. Una o más copias de genes duplicados que constituyen una familia génica pueden verse afectadas por la inserción de elementos transponibles que causan una variación significativa entre ellos en su secuencia y finalmente pueden volverse responsables de la evolución divergente . Esto también puede hacer que las posibilidades y la tasa de conversión génica entre los homólogos de los genes duplicados se deban a una menor o nula similitud en sus secuencias.
Los parálogos se pueden identificar en genomas individuales mediante una comparación de secuencias de todos los modelos genéticos anotados entre sí. Dicha comparación se puede realizar en secuencias de aminoácidos traducidas (por ejemplo, BLASTp, tBLASTx) para identificar duplicaciones antiguas o en secuencias de nucleótidos de ADN (por ejemplo, BLASTn, megablast) para identificar duplicaciones más recientes. La mayoría de los estudios para identificar duplicaciones genéticas requieren coincidencias recíprocas o coincidencias recíprocas difusas, donde cada parálogo debe ser la mejor coincidencia del otro en una comparación de secuencias. [33]
La mayoría de las duplicaciones genéticas existen como repeticiones de bajo número de copias (LCR), secuencias altamente repetitivas como elementos transponibles. Se encuentran principalmente en regiones pericentronómicas , subteloméricas e intersticiales de un cromosoma. Muchas LCR, debido a su tamaño (>1 Kb), similitud y orientación, son altamente susceptibles a duplicaciones y deleciones.
Las tecnologías como los microarrays genómicos , también llamados hibridación genómica comparativa de arrays (array CGH), se utilizan para detectar anomalías cromosómicas, como microduplicaciones, de manera de alto rendimiento a partir de muestras de ADN genómico. En particular, la tecnología de microarrays de ADN puede monitorear simultáneamente los niveles de expresión de miles de genes en muchos tratamientos o condiciones experimentales, lo que facilita enormemente los estudios evolutivos de la regulación genética después de la duplicación o especiación de genes . [34] [35]
Las duplicaciones de genes también se pueden identificar mediante el uso de plataformas de secuenciación de última generación. El método más sencillo para identificar duplicaciones en los datos de resecuenciación genómica es mediante el uso de lecturas de secuenciación de extremos emparejados. Las duplicaciones en tándem se indican mediante pares de lecturas de secuenciación que se asignan en orientaciones anormales. Mediante una combinación de mayor cobertura de secuencia y orientación de asignación anormal, es posible identificar duplicaciones en los datos de secuenciación genómica.
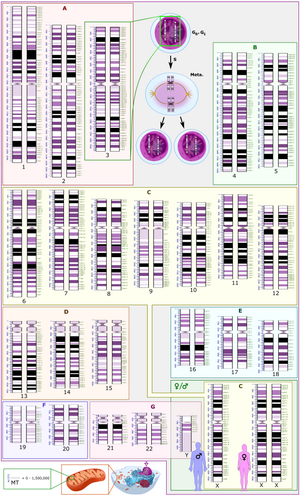
El Sistema Internacional de Nomenclatura Citogenómica Humana (ISCN) es un estándar internacional para la nomenclatura de los cromosomas humanos , que incluye nombres de bandas, símbolos y términos abreviados utilizados en la descripción de los cromosomas humanos y las anomalías cromosómicas. Las abreviaturas incluyen dup para las duplicaciones de partes de un cromosoma. [36] Por ejemplo, dup(17p12) causa la enfermedad de Charcot-Marie-Tooth tipo 1A. [37]
La duplicación de genes no constituye necesariamente un cambio duradero en el genoma de una especie. De hecho, estos cambios a menudo no duran más allá del organismo huésped inicial. Desde la perspectiva de la genética molecular , la amplificación de genes es una de las muchas formas en que un gen puede sobreexpresarse . La amplificación genética puede ocurrir artificialmente, como con el uso de la técnica de reacción en cadena de la polimerasa para amplificar cadenas cortas de ADN in vitro utilizando enzimas , o puede ocurrir naturalmente, como se describió anteriormente. Si es una duplicación natural, aún puede tener lugar en una célula somática , en lugar de una célula de la línea germinal (que sería necesaria para un cambio evolutivo duradero).
Las duplicaciones de oncogenes son una causa común de muchos tipos de cáncer . En tales casos, la duplicación genética ocurre en una célula somática y afecta solo al genoma de las propias células cancerosas, no a todo el organismo, y mucho menos a cualquier descendencia posterior. Una clasificación y cuantificación exhaustivas recientes a nivel de paciente de los eventos impulsores en cohortes de TCGA revelaron que hay en promedio 12 eventos impulsores por tumor, de los cuales 1,5 son amplificaciones de oncogenes. [38]
Las duplicaciones de todo el genoma también son frecuentes en los cánceres, detectándose en el 30% al 36% de los tumores de los tipos de cáncer más comunes. [40] [41] Su papel exacto en la carcinogénesis no está claro, pero en algunos casos conducen a la pérdida de la segregación de la cromatina, lo que lleva a cambios en la conformación de la cromatina que a su vez conducen a modificaciones epigenéticas y transcripcionales oncogénicas. [42]