Los isótopos son especies nucleares distintas (o nucleidos ) del mismo elemento químico . Tienen el mismo número atómico (número de protones en sus núcleos ) y posición en la tabla periódica (y por lo tanto pertenecen al mismo elemento químico), pero diferentes números de nucleones ( números másicos ) debido a diferentes números de neutrones en sus núcleos. Si bien todos los isótopos de un elemento dado tienen propiedades químicas similares, tienen diferentes masas atómicas y propiedades físicas. [1]
El término isótopo se deriva de las raíces griegas isos (ἴσος "igual") y topos (τόπος "lugar"), que significan "el mismo lugar"; por lo tanto, el significado detrás del nombre es que diferentes isótopos de un solo elemento ocupan la misma posición en la tabla periódica . [2] Fue acuñado por la médica y escritora escocesa Margaret Todd en una sugerencia de 1913 al químico británico Frederick Soddy , quien popularizó el término. [3]
El número de protones dentro del núcleo del átomo se denomina número atómico y es igual al número de electrones en el átomo neutro (no ionizado). Cada número atómico identifica un elemento específico, pero no el isótopo; un átomo de un elemento dado puede tener un amplio rango en su número de neutrones . El número de nucleones (tanto protones como neutrones) en el núcleo es el número másico del átomo , y cada isótopo de un elemento dado tiene un número másico diferente.
Por ejemplo, el carbono-12 , el carbono-13 y el carbono-14 son tres isótopos del elemento carbono con números másicos 12, 13 y 14, respectivamente. El número atómico del carbono es 6, lo que significa que cada átomo de carbono tiene 6 protones, por lo que los números de neutrones de estos isótopos son 6, 7 y 8, respectivamente.
Un nucleido es una especie de átomo con un número específico de protones y neutrones en el núcleo, por ejemplo, el carbono-13 con 6 protones y 7 neutrones. El concepto de nucleido (que se refiere a especies nucleares individuales) enfatiza las propiedades nucleares sobre las químicas, mientras que el concepto de isótopo (que agrupa todos los átomos de cada elemento) enfatiza las químicas sobre las nucleares. El número de neutrones afecta en gran medida las propiedades nucleares, pero su efecto sobre las propiedades químicas es insignificante para la mayoría de los elementos. Incluso para los elementos más ligeros, cuya relación entre el número de neutrones y el número atómico varía más entre isótopos, generalmente solo tiene un pequeño efecto, aunque importa en algunas circunstancias (para el hidrógeno, el elemento más ligero, el efecto isotópico es lo suficientemente grande como para afectar fuertemente a la biología). El término isótopos (originalmente también elementos isotópicos [4] , ahora a veces nucleidos isotópicos [5] ) pretende implicar una comparación (como sinónimos o isómeros ). Por ejemplo, los nucleidos12
6do
,13
6do
,14
6do
son isótopos (nucleidos con el mismo número atómico pero diferentes números de masa [6] ), pero40
18Arkansas
,40
19K
,40
20California
son isóbaros (nucleidos con el mismo número de masa [7] ). Sin embargo, isótopo es el término más antiguo y, por lo tanto, es más conocido que nucleido y todavía se usa a veces en contextos en los que nucleido podría ser más apropiado, como la tecnología nuclear y la medicina nuclear .
Un isótopo y/o nucleido se especifica mediante el nombre del elemento en particular (esto indica el número atómico) seguido de un guion y el número másico (p. ej. , helio-3 , helio-4 , carbono-12 , carbono-14 , uranio-235 y uranio-239 ). [8] Cuando se utiliza un símbolo químico , p. ej., "C" para el carbono, la notación estándar (ahora conocida como "notación AZE" porque A es el número másico , Z el número atómico y E para el elemento ) es para indicar el número másico (número de nucleones) con un superíndice en la parte superior izquierda del símbolo químico y para indicar el número atómico con un subíndice en la parte inferior izquierda (p. ej. ,3
2Él
,4
2Él
,12
6do
,14
6do
,235
92tú
, y239
92tú
). [9] Debido a que el número atómico se da por el símbolo del elemento, es común indicar solo el número de masa en el superíndice y omitir el subíndice del número atómico (por ejemplo,3
Él
,4
Él
,12
do
,14
do
,235
tú
, y239
tú
). La letra m (para metaestable) a veces se añade después del número de masa para indicar un isómero nuclear , un estado nuclear metaestable o energéticamente excitado (a diferencia del estado fundamental de menor energía ), por ejemplo180 m
73Ejército de reserva
( tántalo-180m ).
La pronunciación común de la notación AZE es diferente a cómo se escribe:4
2Él
se pronuncia comúnmente como helio-cuatro en lugar de cuatro-dos-helio, y235
92tú
como uranio dos-treinta y cinco (inglés americano) o uranio-dos-tres-cinco (británico) en lugar de 235-92-uranio.
Algunos isótopos/nucleidos son radiactivos y, por lo tanto, se los denomina radioisótopos o radionucleidos , mientras que otros nunca se han desintegrado radiactivamente y se los denomina isótopos estables o nucleidos estables . Por ejemplo,14
do
es una forma radiactiva de carbono, mientras que12
do
y13
do
Son isótopos estables. Existen alrededor de 339 nucleidos naturales en la Tierra, [10] de los cuales 286 son nucleidos primordiales , lo que significa que han existido desde la formación del Sistema Solar .
Los nucleidos primordiales incluyen 35 nucleidos con vidas medias muy largas (más de 100 millones de años) y 251 que se consideran formalmente como " nucleidos estables ", [10] porque no se ha observado que se desintegran. En la mayoría de los casos, por razones obvias, si un elemento tiene isótopos estables, esos isótopos predominan en la abundancia elemental encontrada en la Tierra y en el Sistema Solar. Sin embargo, en los casos de tres elementos ( telurio , indio y renio ), el isótopo más abundante que se encuentra en la naturaleza es en realidad uno (o dos) radioisótopos del elemento con vidas medias extremadamente largas, a pesar de que estos elementos tienen uno o más isótopos estables.
La teoría predice que muchos nucleidos aparentemente "estables" son radiactivos, con vidas medias extremadamente largas (descartando la posibilidad de la desintegración de protones , que haría que todos los nucleidos fueran en última instancia inestables). Algunos nucleidos estables son en teoría energéticamente susceptibles a otras formas conocidas de desintegración, como la desintegración alfa o la desintegración beta doble, pero todavía no se han observado productos de desintegración, por lo que se dice que estos isótopos son "observativamente estables". Las vidas medias predichas para estos nucleidos a menudo exceden en gran medida la edad estimada del universo y, de hecho, también hay 31 radionucleidos conocidos (ver nucleido primordial ) con vidas medias más largas que la edad del universo.
Si se suman los nucleidos radiactivos que se han creado artificialmente, actualmente se conocen 3.339 nucleidos . [11] Entre ellos, 905 son estables o tienen vidas medias superiores a 60 minutos. Véase la lista de nucleidos para obtener más información.
La existencia de isótopos fue sugerida por primera vez en 1913 por el radioquímico Frederick Soddy , basándose en estudios de cadenas de desintegración radiactiva que indicaban alrededor de 40 especies diferentes denominadas radioelementos (es decir, elementos radiactivos) entre el uranio y el plomo, aunque la tabla periódica solo permitía 11 elementos entre el plomo y el uranio inclusive. [12] [13] [14]
Varios intentos de separar químicamente estos nuevos radioelementos habían fracasado. [15] Por ejemplo, Soddy había demostrado en 1910 que el mesotorio (posteriormente demostrado que era 228 Ra), el radio ( 226 Ra, el isótopo de vida más larga) y el torio X ( 224 Ra) son imposibles de separar. [16] Los intentos de colocar los radioelementos en la tabla periódica llevaron a Soddy y Kazimierz Fajans a proponer independientemente su ley de desplazamiento radiactivo en 1913, en el sentido de que la desintegración alfa producía un elemento dos lugares a la izquierda en la tabla periódica, mientras que la emisión de la desintegración beta producía un elemento un lugar a la derecha. [17] [18] [19] [20] Soddy reconoció que la emisión de una partícula alfa seguida de dos partículas beta conducía a la formación de un elemento químicamente idéntico al elemento inicial pero con una masa cuatro unidades más ligera y con diferentes propiedades radiactivas.
Soddy propuso que varios tipos de átomos (que difieren en propiedades radiactivas) podrían ocupar el mismo lugar en la tabla. [14] Por ejemplo, la desintegración alfa del uranio-235 forma torio-231, mientras que la desintegración beta del actinio-230 forma torio-230. [15] El término "isótopo", que en griego significa "en el mismo lugar", [14] fue sugerido a Soddy por Margaret Todd , una médica escocesa y amiga de la familia, durante una conversación en la que le explicó sus ideas. [16] [21] [22] [23] [24] [25] Recibió el Premio Nobel de Química de 1921 en parte por su trabajo sobre isótopos. [26]

En 1914, T. W. Richards encontró variaciones entre el peso atómico del plomo de diferentes fuentes minerales, atribuibles a variaciones en la composición isotópica debido a diferentes orígenes radiactivos. [15] [26]
La primera evidencia de la existencia de múltiples isótopos de un elemento estable (no radiactivo) fue encontrada por JJ Thomson en 1912 como parte de su exploración de la composición de los rayos canal (iones positivos). [27] Thomson canalizó corrientes de iones de neón a través de campos magnéticos y eléctricos paralelos, midió su desviación colocando una placa fotográfica en su camino y calculó su relación masa/carga utilizando un método que se conoció como el método de la parábola de Thomson. Cada corriente creaba una mancha brillante en la placa en el punto en el que impactaba. Thomson observó dos manchas de luz parabólicas separadas en la placa fotográfica (ver imagen), lo que sugería dos especies de núcleos con diferentes relaciones masa/carga. Escribió: "Por lo tanto, creo que no puede haber duda de que lo que se ha llamado neón no es un simple gas sino una mezcla de dos gases, uno de los cuales tiene un peso atómico de aproximadamente 20 y el otro de aproximadamente 22. La parábola debida al gas más pesado es siempre mucho más débil que la debida al más ligero, de modo que probablemente el gas más pesado forme solo un pequeño porcentaje de la mezcla". [28]
Posteriormente, F. W. Aston descubrió múltiples isótopos estables para numerosos elementos utilizando un espectrógrafo de masas . En 1919, Aston estudió el neón con suficiente resolución para demostrar que las dos masas isotópicas están muy cerca de los números enteros 20 y 22 y que ninguna es igual a la masa molar conocida (20,2) del gas neón. Este es un ejemplo de la regla de números enteros de Aston para masas isotópicas, que establece que las grandes desviaciones de las masas molares elementales con respecto a los números enteros se deben principalmente al hecho de que el elemento es una mezcla de isótopos. Aston demostró de manera similar en 1920 que la masa molar del cloro (35,45) es un promedio ponderado de las masas casi integrales de los dos isótopos 35 Cl y 37 Cl. [29] [30]
Después del descubrimiento del neutrón por James Chadwick en 1932, [31] se aclaró la causa última de la existencia de isótopos, es decir, los núcleos de diferentes isótopos de un elemento dado tienen diferentes números de neutrones, aunque tengan el mismo número de protones.
Un átomo neutro tiene el mismo número de electrones que de protones. Por lo tanto, los diferentes isótopos de un elemento dado tienen todos el mismo número de electrones y comparten una estructura electrónica similar. Debido a que el comportamiento químico de un átomo está determinado en gran medida por su estructura electrónica, los diferentes isótopos exhiben un comportamiento químico casi idéntico.
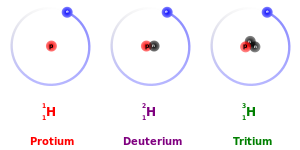
La principal excepción a esto es el efecto isotópico cinético : debido a sus masas mayores, los isótopos más pesados tienden a reaccionar algo más lentamente que los isótopos más ligeros del mismo elemento. Esto es mucho más pronunciado en el caso del protio (1
yo
), deuterio (2
yo
) y tritio (3
yo
), porque el deuterio tiene el doble de masa que el protio y el tritio tiene tres veces la masa del protio. [32] Estas diferencias de masa también afectan el comportamiento de sus respectivos enlaces químicos, al cambiar el centro de gravedad ( masa reducida ) de los sistemas atómicos. Sin embargo, para los elementos más pesados, la diferencia de masa relativa entre isótopos es mucho menor, por lo que los efectos de la diferencia de masa en la química suelen ser insignificantes. (Los elementos pesados también tienen relativamente más neutrones que los elementos más ligeros, por lo que la relación entre la masa nuclear y la masa electrónica colectiva es ligeramente mayor). También hay un efecto isotópico de equilibrio .

De manera similar, dos moléculas que difieren solo en los isótopos de sus átomos ( isotopólogos ) tienen estructuras electrónicas idénticas y, por lo tanto, propiedades físicas y químicas casi indistinguibles (nuevamente, con el deuterio y el tritio como principales excepciones). Los modos vibracionales de una molécula están determinados por su forma y por las masas de sus átomos constituyentes; por lo tanto, los diferentes isotopólogos tienen diferentes conjuntos de modos vibracionales. Debido a que los modos vibracionales permiten que una molécula absorba fotones de energías correspondientes, los isotopólogos tienen diferentes propiedades ópticas en el rango infrarrojo .
Los núcleos atómicos están formados por protones y neutrones unidos entre sí por la fuerza fuerte residual . Como los protones tienen carga positiva, se repelen entre sí. Los neutrones, que son eléctricamente neutros, estabilizan el núcleo de dos maneras. Su copresencia separa ligeramente a los protones, lo que reduce la repulsión electrostática entre ellos, y ejercen la fuerza nuclear atractiva entre sí y sobre los protones. Por esta razón, se necesitan uno o más neutrones para que dos o más protones se unan en un núcleo. A medida que aumenta el número de protones, también aumenta la relación de neutrones a protones necesaria para garantizar un núcleo estable (ver gráfico a la derecha). Por ejemplo, aunque la relación neutrón:protón de3
2Él
es 1:2, la relación neutrón:protón de238
92tú
es mayor que 3:2. Una serie de elementos más ligeros tienen nucleidos estables con una relación de 1:1 ( Z = N ). El nucleido40
20California
El calcio-40 es, según las observaciones, el nucleido estable más pesado, con el mismo número de neutrones y protones. Todos los nucleidos estables más pesados que el calcio-40 contienen más neutrones que protones.
De los 80 elementos con un isótopo estable, el mayor número de isótopos estables observados para cualquier elemento es diez (para el elemento estaño ). Ningún elemento tiene nueve u ocho isótopos estables. Cinco elementos tienen siete isótopos estables, ocho tienen seis isótopos estables, diez tienen cinco isótopos estables, nueve tienen cuatro isótopos estables, cinco tienen tres isótopos estables, 16 tienen dos isótopos estables (contando180 m
73Ejército de reserva
como estable), y 26 elementos tienen un solo isótopo estable (de estos, 19 son los llamados elementos mononucleídicos , que tienen un solo isótopo estable primordial que domina y fija el peso atómico del elemento natural con alta precisión; también se producen 3 elementos mononucleídicos radiactivos). [33] En total, hay 251 nucleidos que no se han observado en desintegración. Para los 80 elementos que tienen uno o más isótopos estables, el número promedio de isótopos estables es 251/80 ≈ 3,14 isótopos por elemento.
La relación protón:neutrón no es el único factor que afecta a la estabilidad nuclear. Depende también de la uniformidad o imparidad de su número atómico Z , número neutrónico N y, en consecuencia, de su suma, el número másico A . La imparidad tanto de Z como de N tiende a reducir la energía de enlace nuclear , haciendo que los núcleos impares, en general, sean menos estables. Esta notable diferencia de energía de enlace nuclear entre núcleos vecinos, especialmente de isóbaros impares A , tiene consecuencias importantes: los isótopos inestables con un número no óptimo de neutrones o protones se desintegran por desintegración beta (incluida la emisión de positrones ), captura de electrones u otros modos de desintegración menos comunes, como la fisión espontánea y la desintegración en cúmulos .
La mayoría de los nucleidos estables son pares-protón-neutrón-par, donde todos los números Z , N y A son pares. Los nucleidos estables impares- A se dividen (de manera aproximadamente uniforme) en nucleidos impares-protón-neutrón-par y pares-protón-neutrón-impar. Los nucleidos estables impares-protón-neutrón-impar son los menos comunes.
Los 146 nucleidos de protones pares y neutrones pares (EE) comprenden aproximadamente el 58 % de todos los nucleidos estables y todos tienen espín 0 debido al apareamiento. También hay 24 nucleidos pares-pares primordiales de larga duración. Como resultado, cada uno de los 41 elementos pares del 2 al 82 tiene al menos un isótopo estable , y la mayoría de estos elementos tienen varios isótopos primordiales. La mitad de estos elementos pares tienen seis o más isótopos estables. La extrema estabilidad del helio-4 debido a un doble apareamiento de 2 protones y 2 neutrones evita que cualquier nucleido que contenga cinco (5
2Él
,5
3Li
) u ocho (8
4Ser
) los nucleones existen el tiempo suficiente para servir como plataformas para la acumulación de elementos más pesados a través de la fusión nuclear en las estrellas (véase el proceso triple alfa ).
Sólo cinco nucleidos estables contienen un número impar de protones y un número impar de neutrones. Los primeros cuatro nucleidos "impar-impar" se encuentran en nucleidos de baja masa, para los cuales cambiar un protón a un neutrón o viceversa conduciría a una relación protón-neutrón muy desequilibrada (2
1yo
,6
3Li
,10
5B
, y14
7norte
; espines 1, 1, 3, 1). El único otro nucleido impar-impar completamente "estable",180 m
73Ejército de reserva
(espín 9), se cree que es el más raro de los 251 nucleidos estables y es el único isómero nuclear primordial , del que aún no se ha observado que se descomponga a pesar de los intentos experimentales. [34]
Se conocen muchos radionucleidos impar-impar (como el estado fundamental del tantalio-180) con vidas medias comparativamente cortas. Por lo general, se desintegran en sus isóbaros pares-pares cercanos que tienen protones y neutrones apareados. De los nueve nucleidos impar-impar primordiales (cinco estables y cuatro radiactivos con vidas medias largas), solo14
7norte
es el isótopo más común de un elemento común. Esto se debe a que forma parte del ciclo CNO . Los nucleidos6
3Li
y10
5B
son isótopos minoritarios de elementos que son raros en comparación con otros elementos ligeros, mientras que los otros seis isótopos representan solo un pequeño porcentaje de la abundancia natural de sus elementos.
53 nucleidos estables tienen un número par de protones y un número impar de neutrones. Son una minoría en comparación con los isótopos par-par, que son aproximadamente tres veces más numerosos. Entre los 41 elementos par- Z que tienen un nucleido estable, solo dos elementos (argón y cerio) no tienen nucleidos estables par-impares. Un elemento (estaño) tiene tres. Hay 24 elementos que tienen un nucleido par-impares y 13 que tienen dos nucleidos impares-pares. De 35 radionucleidos primordiales existen cuatro nucleidos par-impares (ver tabla a la derecha), incluido el fisible . 235
92tú
Debido a sus números de neutrones impares, los nucleidos pares-impares tienden a tener grandes secciones transversales de captura de neutrones , debido a la energía que resulta de los efectos de apareamiento de neutrones. Estos nucleidos estables de protones pares-neutrones impares tienden a ser poco comunes en abundancia en la naturaleza, generalmente porque, para formarse y entrar en abundancia primordial, deben haber escapado a la captura de neutrones para formar otros isótopos pares-pares estables, durante el proceso s y el proceso r de captura de neutrones, durante la nucleosíntesis en las estrellas . Por esta razón, solo195
78En
y9
4Ser
son los isótopos más abundantes de su elemento en la naturaleza.
48 nucleidos estables de protones pares e impares, estabilizados por sus neutrones apareados, forman la mayoría de los isótopos estables de los elementos impares; los pocos nucleidos de protones pares e impares constituyen los demás. Hay 41 elementos impares con Z = 1 a 81, de los cuales 39 tienen isótopos estables ( tecnecio (
43Tc
) y prometio (
61P.m
) no tienen isótopos estables). De estos 39 elementos Z impares, 30 elementos (incluido el hidrógeno-1 donde 0 neutrones es par ) tienen un isótopo impar-par estable y nueve elementos: cloro (
17Cl
), potasio (
19K
), cobre (
29Cu
), galio (
31Georgia
), bromo (
35Es
), plata (
47Ag
), antimonio (
51Sb
), iridio (
77Ir
) y talio (
81El
), tienen dos isótopos estables pares-impares cada uno. Esto hace un total de 30 + 2(9) = 48 isótopos estables pares-impares.
También hay cinco isótopos pares-impares radiactivos primordiales de larga duración,87
37Rb
,115
49En
,187
75Re
,151
63UE
, y209
83Bi
Se ha descubierto recientemente que los dos últimos se desintegran y tienen vidas medias superiores a 10 18 años.
Los actínidos con un número de neutrones impar son generalmente fisionables (con neutrones térmicos ), mientras que aquellos con un número de neutrones par generalmente no lo son, aunque son fisionables con neutrones rápidos . Todos los nucleidos impar-impares estables observacionalmente tienen un espín entero distinto de cero. Esto se debe a que el neutrón desapareado y el protón desapareado tienen una mayor atracción nuclear entre sí si sus espines están alineados (produciendo un espín total de al menos 1 unidad), en lugar de antialineados. Véase el deuterio para el caso más simple de este comportamiento nuclear.
Solo195
78En
,9
4Ser
, y14
7norte
tienen un número de neutrones impar y son el isótopo más abundante de forma natural de su elemento.
Los elementos están compuestos de un nucleido ( elementos mononucleídicos ) o de más de un isótopo natural. Los isótopos inestables (radiactivos) son primordiales o posprimordiales. Los isótopos primordiales fueron un producto de la nucleosíntesis estelar u otro tipo de nucleosíntesis como la espalación de rayos cósmicos , y han persistido hasta el presente porque su tasa de desintegración es muy lenta (por ejemplo, uranio-238 y potasio-40 ). Los isótopos posprimordiales se crearon por bombardeo de rayos cósmicos como nucleidos cosmogénicos (por ejemplo, tritio , carbono-14 ), o por la desintegración de un isótopo primordial radiactivo en un nucleido radiogénico hijo radiactivo (por ejemplo, uranio a radio ). Algunos isótopos se sintetizan naturalmente como nucleidos nucleogénicos , por alguna otra reacción nuclear natural , como cuando los neutrones de la fisión nuclear natural son absorbidos por otro átomo.
Como se ha comentado anteriormente, solo 80 elementos tienen isótopos estables, y 26 de ellos tienen solo un isótopo estable. Por tanto, aproximadamente dos tercios de los elementos estables se dan de forma natural en la Tierra en múltiples isótopos estables, siendo diez el mayor número de isótopos estables para un elemento, en el caso del estaño (
50Sn
). Hay alrededor de 94 elementos que se encuentran naturalmente en la Tierra (hasta el plutonio inclusive), aunque algunos se detectan solo en cantidades muy pequeñas, como el plutonio-244 . Los científicos estiman que los elementos que se encuentran naturalmente en la Tierra (algunos solo como radioisótopos) se presentan como 339 isótopos ( nucleidos ) en total. [35] Solo 251 de estos nucleidos naturales son estables, en el sentido de que nunca se ha observado que se descompongan hasta el momento actual. Otros 35 nucleidos primordiales (para un total de 286 nucleidos primordiales) son radiactivos con vidas medias conocidas, pero tienen vidas medias más largas que 100 millones de años, lo que les permite existir desde el comienzo del Sistema Solar. Consulte la lista de nucleidos para obtener más detalles.
Todos los nucleidos estables conocidos se producen de forma natural en la Tierra; los demás nucleidos naturales son radiactivos, pero se producen en la Tierra debido a sus vidas medias relativamente largas o debido a otros medios de producción natural continua. Entre ellos se incluyen los nucleidos cosmogénicos antes mencionados , los nucleidos nucleogénicos y cualquier nucleido radiogénico formado por la desintegración continua de un nucleido radiactivo primordial, como el radón y el radio del uranio.
En los reactores nucleares y en los aceleradores de partículas se han creado unos 3000 nucleidos radiactivos adicionales que no se encuentran en la naturaleza. También se han observado mediante análisis espectroscópicos muchos nucleidos de vida corta que no se encuentran de forma natural en la Tierra, que se crean de forma natural en estrellas o supernovas . Un ejemplo es el aluminio-26 , que no se encuentra de forma natural en la Tierra, pero se encuentra en abundancia a escala astronómica.
Las masas atómicas tabuladas de los elementos son promedios que dan cuenta de la presencia de múltiples isótopos con diferentes masas. Antes del descubrimiento de los isótopos, los valores no enteros de masa atómica determinados empíricamente confundían a los científicos. Por ejemplo, una muestra de cloro contiene 75,8 % de cloro-35 y 24,2 % de cloro-37 , lo que da una masa atómica promedio de 35,5 unidades de masa atómica .
Según la teoría cosmológica generalmente aceptada, en el Big Bang solo se crearon isótopos de hidrógeno y helio, trazas de algunos isótopos de litio y berilio, y quizás algo de boro , mientras que todos los demás nucleidos se sintetizaron más tarde, en estrellas y supernovas, y en interacciones entre partículas energéticas como los rayos cósmicos, y nucleidos producidos previamente. (Véase nucleosíntesis para más detalles de los diversos procesos que se cree que son responsables de la producción de isótopos). Las respectivas abundancias de isótopos en la Tierra resultan de las cantidades formadas por estos procesos, su propagación a través de la galaxia y las tasas de desintegración de los isótopos que son inestables. Después de la coalescencia inicial del Sistema Solar , los isótopos se redistribuyeron según la masa, y la composición isotópica de los elementos varía ligeramente de un planeta a otro. Esto a veces permite rastrear el origen de los meteoritos .
La masa atómica ( m r ) de un isótopo (nucleido) está determinada principalmente por su número másico (es decir, el número de nucleones en su núcleo). Se deben pequeñas correcciones a la energía de enlace del núcleo (ver defecto de masa ), la ligera diferencia de masa entre el protón y el neutrón y la masa de los electrones asociados al átomo, esto último porque la relación electrón:nucleón difiere entre isótopos.
El número másico es una cantidad adimensional . La masa atómica, por el contrario, se mide utilizando la unidad de masa atómica basada en la masa del átomo de carbono-12. Se denota con los símbolos "u" (unidad de masa atómica unificada) o "Da" ( dalton ).
Las masas atómicas de los isótopos naturales de un elemento determinan el peso atómico estándar del elemento. Cuando el elemento contiene N isótopos, se aplica la siguiente expresión para la masa atómica promedio :
donde m 1 , m 2 , ..., m N son las masas atómicas de cada isótopo individual, y x 1 , ..., x N son las abundancias relativas de estos isótopos.
Existen varias aplicaciones que aprovechan las propiedades de los diversos isótopos de un elemento determinado. La separación de isótopos es un desafío tecnológico importante, en particular con elementos pesados como el uranio o el plutonio. Los elementos más ligeros como el litio, el carbono, el nitrógeno y el oxígeno se separan comúnmente por difusión gaseosa de sus compuestos, como el CO y el NO. La separación del hidrógeno y el deuterio es inusual porque se basa en propiedades químicas en lugar de físicas, por ejemplo en el proceso de sulfuro de Girdler . Los isótopos de uranio se han separado en masa mediante difusión gaseosa, centrifugación gaseosa, separación por ionización láser y (en el Proyecto Manhattan ) mediante un tipo de espectrometría de masas de producción .
Así, los elementos químicamente idénticos -o isótopos, como los llamé por primera vez en esta carta a Nature, porque ocupan el mismo lugar en la Tabla Periódica...
p. 208: Hasta 1913 utilizamos la frase 'elementos radioactivos químicamente no separables' y en ese momento la palabra isótopo fue sugerida en una discusión de salón con la Dra. Margaret Todd en la casa del suegro de Soddy, Sir
George Beilby
.