El indio es un elemento químico de símbolo In y número atómico 49. Es un metal de transición de color blanco plateado y uno de los elementos más blandos. Químicamente, el indio es similar al galio y al talio , y sus propiedades son en gran medida intermedias entre las de los dos. [11] Fue descubierto en 1863 por Ferdinand Reich y Hieronymous Theodor Richter mediante métodos espectroscópicos y recibió su nombre por la línea azul índigo de su espectro. [12]
El indio es un elemento tecnológico crítico que se utiliza principalmente en la producción de pantallas planas como óxido de indio y estaño (ITO) , un revestimiento transparente y conductor que se aplica al vidrio. [13] [14] [15] El indio también se utiliza en la industria de semiconductores , [16] en aleaciones de metales de bajo punto de fusión, como soldaduras y sellos de alto vacío de metal blando. Se produce exclusivamente como subproducto durante el procesamiento de los minerales de otros metales, principalmente a partir de esfalrita y otros minerales de sulfuro de zinc . [17]
El indio no tiene ninguna función biológica y sus compuestos son tóxicos cuando se inhalan o se inyectan en el torrente sanguíneo, aunque se absorben mal después de la ingestión. [18] [19]
El nombre proviene de la palabra latina indicum que significa violeta o índigo . [20]

El indio es un metal post-transición de color blanco plateado brillante, altamente dúctil con un lustre brillante . [21] Es tan blando ( dureza Mohs 1.2) que se puede cortar con un cuchillo y deja una línea visible como un lápiz cuando se frota sobre papel. [22] Es un miembro del grupo 13 en la tabla periódica y sus propiedades son en su mayoría intermedias entre sus vecinos verticales galio y talio . Al igual que el estaño , se escucha un grito agudo cuando se dobla el indio: un sonido crepitante debido al maclado de cristales . [21] Al igual que el galio, el indio puede mojar el vidrio. Como ambos, el indio tiene un punto de fusión bajo , 156,60 °C (313,88 °F); más alto que su homólogo más ligero, el galio, pero más bajo que su homólogo más pesado, el talio, e más bajo que el estaño. [23] El punto de ebullición es 2072 °C (3762 °F), más alto que el del talio, pero más bajo que el del galio, a la inversa de la tendencia general de los puntos de fusión, pero de manera similar a las tendencias hacia abajo de los otros grupos de metales post-transición debido a la debilidad del enlace metálico con pocos electrones deslocalizados . [24]
La densidad del indio, 7,31 g/cm 3 , es también mayor que la del galio, pero menor que la del talio. Por debajo de la temperatura crítica , 3,41 K , el indio se convierte en un superconductor . El indio cristaliza en el sistema cristalino tetragonal centrado en el cuerpo en el grupo espacial I 4/ mmm ( parámetros reticulares : a = 325 pm , c = 495 pm): [23] esta es una estructura cúbica centrada en las caras ligeramente distorsionada , donde cada átomo de indio tiene cuatro vecinos a 324 pm de distancia y ocho vecinos ligeramente más lejos (336 pm). [25] El indio tiene mayor solubilidad en mercurio líquido que cualquier otro metal (más del 50 por ciento en masa de indio a 0 °C). [26] El indio muestra una respuesta viscoplástica dúctil , que se ha descubierto que es independiente del tamaño en tensión y compresión. Sin embargo, tiene un efecto de tamaño en la flexión y la indentación, asociado a una escala de longitud del orden de 50-100 μm, [27] significativamente grande en comparación con otros metales.
El indio tiene 49 electrones, con una configuración electrónica de [ Kr ]4d 10 5s 2 5p 1 . En los compuestos, el indio dona más comúnmente los tres electrones más externos para convertirse en indio(III), In 3+ . En algunos casos, el par de electrones 5s no se dona, lo que resulta en indio(I), In + . La estabilización del estado monovalente se atribuye al efecto del par inerte , en el que los efectos relativistas estabilizan el orbital 5s, observado en elementos más pesados. El talio ( el homólogo más pesado del indio ) muestra un efecto aún más fuerte, lo que hace que la oxidación a talio(I) sea más probable que a talio(III), [28] mientras que el galio (el homólogo más ligero del indio) comúnmente muestra solo el estado de oxidación +3. Por lo tanto, aunque el talio (III) es un agente oxidante moderadamente fuerte , el indio (III) no lo es, y muchos compuestos de indio (I) son poderosos agentes reductores . [29] Si bien la energía requerida para incluir los electrones s en el enlace químico es más baja para el indio entre los metales del grupo 13, las energías de enlace disminuyen hacia abajo en el grupo, de modo que para el indio, la energía liberada al formar dos enlaces adicionales y alcanzar el estado +3 no siempre es suficiente para compensar la energía necesaria para involucrar a los electrones 5s. [30] El óxido y el hidróxido de indio (I) son más básicos y el óxido y el hidróxido de indio (III) son más ácidos. [30]
Se informan varios potenciales de electrodo estándar, dependiendo de la reacción en estudio, [31] para el indio, lo que refleja la disminución de la estabilidad del estado de oxidación +3: [25]
El indio metálico no reacciona con el agua, pero se oxida con agentes oxidantes más fuertes como los halógenos para dar compuestos de indio(III). No forma boruro , siliciuro o carburo , y el hidruro InH3 tiene , en el mejor de los casos, una existencia transitoria en soluciones etéreas a bajas temperaturas, siendo lo suficientemente inestable como para polimerizar espontáneamente sin coordinación. [29] El indio es bastante básico en solución acuosa, mostrando solo ligeras características anfóteras , y a diferencia de sus homólogos más ligeros, el aluminio y el galio, es insoluble en soluciones alcalinas acuosas. [32]
El indio tiene 39 isótopos conocidos, cuyo número másico varía entre 97 y 135. Solo dos isótopos se encuentran de forma natural como nucleidos primordiales : el indio-113, el único isótopo estable , y el indio-115, que tiene una vida media de 4,41 × 1014 años, cuatro órdenes de magnitud mayor que la edad del Universo y casi 30.000 veces mayor que la vida media del torio-232 . [33] La vida media del 115 In es muy larga porque la desintegración beta a 115 Sn está prohibida por el espín . [34] El indio-115 constituye el 95,7% de todo el indio. El indio es uno de los tres elementos conocidos (los otros son el telurio y el renio ) cuyo isótopo estable es menos abundante en la naturaleza que los radioisótopos primordiales de larga vida. [35]
El isótopo artificial más estable es el indio-111 , con una vida media de aproximadamente 2,8 días. Todos los demás isótopos tienen vidas medias inferiores a 5 horas. El indio también tiene 47 estados meta, entre los cuales el indio-114m1 (vida media de aproximadamente 49,51 días) es el más estable, más estable que el estado fundamental de cualquier isótopo de indio que no sea el primordial. Todos se desintegran por transición isomérica . Los isótopos de indio más ligeros que el 113 In se desintegran predominantemente por captura de electrones o emisión de positrones para formar isótopos de cadmio , mientras que los isótopos de indio más pesados que el 113 In se desintegran predominantemente por desintegración beta-menos para formar isótopos de estaño. [33]
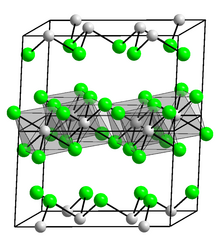
El óxido de indio (III) , In2O3 , se forma cuando el metal indio se quema en el aire o cuando se calienta el hidróxido o el nitrato. [36] El In2O3 adopta una estructura similar a la alúmina y es anfótero, es decir, capaz de reaccionar tanto con ácidos como con bases. El indio reacciona con agua para producir hidróxido de indio (III) soluble , que también es anfótero; con álcalis para producir indatos (III); y con ácidos para producir sales de indio (III):
También se conocen sesqui-calcogenuros análogos con azufre , selenio y telurio . [37] El indio forma los trihaluros esperados . La cloración, bromación y yodación de In producen InCl 3 incoloro , InBr 3 e InI 3 amarillo . Los compuestos son ácidos de Lewis , algo similares a los trihaluros de aluminio más conocidos. Nuevamente, al igual que el compuesto de aluminio relacionado, InF 3 es polimérico. [38]
La reacción directa del indio con los nitruros produce los semiconductores grises o semimetálicos III–V . Muchos de ellos se descomponen lentamente en el aire húmedo, por lo que es necesario almacenarlos con cuidado para evitar el contacto con la atmósfera. El nitruro de indio es atacado fácilmente por ácidos y álcalis. [39]
Los compuestos de indio (I) no son comunes. El cloruro, el bromuro y el yoduro tienen colores intensos, a diferencia de los trihaluros originales a partir de los cuales se preparan. El fluoruro solo se conoce como un gas inestable. [40] El polvo negro de óxido de indio (I) se produce cuando el óxido de indio (III) se descompone al calentarlo a 700 °C. [36]
Con menor frecuencia, el indio forma compuestos en estado de oxidación +2 e incluso estados de oxidación fraccionarios. Por lo general, estos materiales presentan enlaces In-In, más notablemente en los haluros In 2 X 4 y [In 2 X 6 ] 2− , [41] y varios subcalcogenuros como In 4 Se 3 . [42] Se sabe que varios otros compuestos combinan indio(I) e indio(III), como In I 6 (In III Cl 6 )Cl 3 , [43] In I 5 (In III Br 4 ) 2 (In III Br 6 ), [44] e In I In III Br 4 . [41]
Los compuestos de organoindio presentan enlaces In–C. La mayoría son derivados de In(III), pero el ciclopentadienilindio(I) es una excepción. Fue el primer compuesto de organoindio(I) conocido, [45] y es polimérico, y consiste en cadenas en zigzag de átomos de indio alternados y complejos de ciclopentadienilo . [46] Quizás el compuesto de organoindio más conocido sea el trimetilindio , In(CH 3 ) 3 , utilizado para preparar ciertos materiales semiconductores. [47] [48]
En 1863, los químicos alemanes Ferdinand Reich y Hieronymous Theodor Richter estaban probando minerales de las minas alrededor de Freiberg, Sajonia . Disolvieron los minerales pirita , arsenopirita , galena y esfalrita en ácido clorhídrico y destilaron cloruro de zinc crudo . Reich, que era daltónico , empleó a Richter como asistente para detectar las líneas espectrales coloreadas. Sabiendo que los minerales de esa región a veces contienen talio , buscaron las líneas verdes del espectro de emisión de talio. En cambio, encontraron una línea azul brillante. Debido a que esa línea azul no coincidía con ningún elemento conocido, plantearon la hipótesis de que un nuevo elemento estaba presente en los minerales. Llamaron al elemento indio, del color índigo visto en su espectro, en honor al latín indicum , que significa 'de la India '. [49] [12] [50] [51]
Richter logró aislar el metal en 1864. [52] Un lingote de 0,5 kg (1,1 lb) fue presentado en la Feria Mundial de 1867. [53] Reich y Richter luego se pelearon cuando este último afirmó ser el único descubridor. [51]

El indio se crea mediante el proceso s (captura lenta de neutrones) de larga duración (hasta miles de años) en estrellas de masa baja a media (rango de masa entre 0,6 y 10 masas solares ). Cuando un átomo de plata-109 captura un neutrón, se transmuta en plata-110, que luego sufre una desintegración beta para convertirse en cadmio-110. Al capturar más neutrones, se convierte en cadmio-115, que se desintegra en indio-115 mediante otra desintegración beta . Esto explica por qué el isótopo radiactivo es más abundante que el estable. [54] El isótopo estable de indio, indio-113, es uno de los núcleos p , cuyo origen no se entiende completamente; Aunque se sabe que el indio-113 se produce directamente en los procesos s y r (captura rápida de neutrones), y también es hijo del muy longevo cadmio-113, que tiene una vida media de unos ocho cuatrillones de años, esto no puede explicar todo el indio-113. [55] [56]
El indio es el 68.º elemento más abundante en la corteza terrestre, con aproximadamente 50 ppb . Esto es similar a la abundancia en la corteza de plata , bismuto y mercurio . Muy rara vez forma sus propios minerales o se presenta en forma elemental. Se conocen menos de 10 minerales de indio, como la roquesita (CuInS 2 ), y ninguno se presenta en concentraciones suficientes para una extracción económica. [57] En cambio, el indio suele ser un componente traza de minerales minerales más comunes, como la esfalrita y la calcopirita . [58] [59] De estos, se puede extraer como subproducto durante la fundición. [17] Si bien el enriquecimiento de indio en estos depósitos es alto en relación con su abundancia en la corteza, es insuficiente, a los precios actuales, para sustentar la extracción de indio como producto principal. [57]
Existen diferentes estimaciones de las cantidades de indio contenidas en los minerales de otros metales. [60] [61] Sin embargo, estas cantidades no son extraíbles sin la minería de los materiales anfitriones (véase Producción y disponibilidad). Por lo tanto, la disponibilidad de indio está determinada fundamentalmente por la velocidad a la que se extraen estos minerales, y no por su cantidad absoluta. Este es un aspecto que a menudo se olvida en el debate actual, por ejemplo, por el grupo Graedel en Yale en sus evaluaciones de criticidad, [62] lo que explica los tiempos de agotamiento paradójicamente bajos que citan algunos estudios. [63] [17]

El indio se produce exclusivamente como subproducto durante el procesamiento de los minerales de otros metales. Su principal material de origen son los minerales de zinc sulfídicos, donde se encuentra principalmente alojado en la esfalrita. [17] También se extraen cantidades menores de los minerales de cobre sulfídicos. Durante el proceso de tostación-lixiviación-electroobtención de la fundición de zinc , el indio se acumula en los residuos ricos en hierro. De estos, se puede extraer de diferentes maneras. También se puede recuperar directamente de las soluciones del proceso. La purificación adicional se realiza por electrólisis . [65] El proceso exacto varía con el modo de funcionamiento de la fundición. [21] [17]
Su condición de subproducto significa que la producción de indio está limitada por la cantidad de minerales de zinc (y cobre) sulfídicos extraídos cada año. Por lo tanto, su disponibilidad debe analizarse en términos de potencial de suministro. El potencial de suministro de un subproducto se define como la cantidad que es económicamente extraíble de sus materiales anfitriones por año en las condiciones actuales del mercado (es decir, tecnología y precio). [66] Las reservas y los recursos no son relevantes para los subproductos, ya que no se pueden extraer independientemente de los productos principales. [17] Estimaciones recientes sitúan el potencial de suministro de indio en un mínimo de 1.300 t/año a partir de minerales de zinc sulfídicos y 20 t/año a partir de minerales de cobre sulfídicos. [17] Estas cifras son significativamente mayores que la producción actual (655 t en 2016). [67] Por lo tanto, serán posibles importantes aumentos futuros en la producción de subproductos de indio sin aumentos significativos en los costos de producción o el precio. El precio medio del indio en 2016 fue de 240 dólares EE.UU./kg , frente a los 705 dólares EE.UU./kg de 2014. [68]
China es un productor líder de indio (290 toneladas en 2016), seguido de Corea del Sur (195 t), Japón (70 t) y Canadá (65 t). [67] La refinería de Teck Resources en Trail, Columbia Británica , es un gran productor de indio de una sola fuente, con una producción de 32,5 toneladas en 2005, 41,8 toneladas en 2004 y 36,1 toneladas en 2003.
El principal consumo mundial de indio es la producción de LCD . La demanda aumentó rápidamente desde finales de los años 1990 hasta 2010 con la popularidad de los monitores de ordenador y los televisores LCD, que ahora representan el 50% del consumo de indio. [15] La mayor eficiencia de fabricación y el reciclaje (especialmente en Japón) mantienen un equilibrio entre la demanda y la oferta. Según el PNUMA , la tasa de reciclaje del indio al final de su vida útil es inferior al 1%. [69]

En 1924, se descubrió que el indio tenía la valiosa propiedad de estabilizar metales no ferrosos , y ese se convirtió en el primer uso significativo del elemento. [70] La primera aplicación a gran escala del indio fue el recubrimiento de cojinetes en motores de aviones de alto rendimiento durante la Segunda Guerra Mundial , para protegerlos contra daños y corrosión ; este ya no es un uso importante del elemento. [65] Se encontraron nuevos usos en aleaciones fusibles , soldaduras y electrónica . En la década de 1950, se utilizaron pequeñas perlas de indio para los emisores y colectores de transistores de unión de aleación PNP . A mediados y finales de la década de 1980, el desarrollo de semiconductores de fosfuro de indio y películas delgadas de óxido de indio y estaño para pantallas de cristal líquido (LCD) despertó mucho interés. En 1992, la aplicación de película delgada se había convertido en el uso final más grande. [71] [72]
El óxido de indio (III) y el óxido de indio y estaño (ITO) se utilizan como revestimiento conductor transparente sobre sustratos de vidrio en paneles electroluminiscentes . [73] El óxido de indio y estaño se utiliza como filtro de luz en lámparas de vapor de sodio de baja presión . La radiación infrarroja se refleja de nuevo en la lámpara, lo que aumenta la temperatura dentro del tubo y mejora el rendimiento de la lámpara. [72]
El indio tiene muchas aplicaciones relacionadas con los semiconductores . Algunos compuestos de indio, como el antimoniuro de indio y el fosfuro de indio , [74] son semiconductores con propiedades útiles: un precursor suele ser el trimetilindio (TMI), que también se utiliza como dopante semiconductor en semiconductores compuestos II-VI . [75] InAs e InSb se utilizan para transistores de baja temperatura e InP para transistores de alta temperatura. [65] Los semiconductores compuestos InGaN e InGaP se utilizan en diodos emisores de luz (LED) y diodos láser. [76] El indio se utiliza en la energía fotovoltaica como semiconductor de seleniuro de cobre, indio y galio (CIGS), también llamado células solares CIGS , un tipo de célula solar de película fina de segunda generación . [77] El indio se utiliza en transistores de unión bipolar PNP con germanio : cuando se suelda a baja temperatura, el indio no estresa el germanio. [65]

El alambre de indio se utiliza como sello de vacío y conductor térmico en aplicaciones criogénicas y de ultra alto vacío , en aplicaciones de fabricación como juntas que se deforman para llenar huecos. [78] Debido a su gran plasticidad y adhesión a los metales, las láminas de indio se utilizan a veces para soldadura en frío en circuitos de microondas y juntas de guía de ondas , donde la soldadura directa es complicada. El indio es un ingrediente de la aleación de galio-indio-estaño galinstan , que es líquida a temperatura ambiente y reemplaza al mercurio en algunos termómetros . [79] Otras aleaciones de indio con bismuto , cadmio , plomo y estaño , que tienen puntos de fusión más altos pero aún bajos (entre 50 y 100 °C), se utilizan en sistemas de rociadores contra incendios y reguladores de calor. [65]
El indio es uno de los muchos sustitutos del mercurio en las baterías alcalinas para evitar que el zinc se corroa y libere gas hidrógeno . [80] El indio se agrega a algunas aleaciones de amalgama dental para disminuir la tensión superficial del mercurio y permitir menos mercurio y una amalgamación más fácil. [81]
La alta sección transversal de captura de neutrones del indio para neutrones térmicos lo hace adecuado para su uso en barras de control para reactores nucleares , típicamente en una aleación de 80% plata , 15% indio y 5% cadmio . [82] En ingeniería nuclear, las reacciones (n,n') de 113 In y 115 In se utilizan para determinar magnitudes de flujos de neutrones. [83]
En 2009, el profesor Mas Subramanian y el ex estudiante de posgrado Andrew Smith de la Universidad Estatal de Oregón descubrieron que el indio se puede combinar con itrio y manganeso para formar un pigmento azul intenso , no tóxico, inerte y resistente a la decoloración , el azul YInMn , el primer pigmento azul inorgánico nuevo descubierto en 200 años. [84]
El indio-111 radiactivo (en cantidades muy pequeñas) se utiliza en pruebas de medicina nuclear , como radiotrazador para seguir el movimiento de proteínas marcadas y glóbulos blancos para diagnosticar diferentes tipos de infecciones. [85] [86] Los compuestos de indio en su mayoría no se absorben tras la ingestión y solo se absorben moderadamente por inhalación; tienden a almacenarse temporalmente en los músculos , la piel y los huesos antes de ser excretados, y la vida media biológica del indio es de aproximadamente dos semanas en los seres humanos. [87] También se etiqueta con análogos de la hormona del crecimiento como el octreótido para encontrar receptores de la hormona del crecimiento en tumores neuroendocrinos . [88]
El indio no tiene ningún papel metabólico en ningún organismo. De manera similar a las sales de aluminio, los iones de indio (III) pueden ser tóxicos para el riñón cuando se administran por inyección. [19] El óxido de indio y estaño y el fosfuro de indio dañan los sistemas pulmonar e inmunológico, predominantemente a través del indio iónico, [90] aunque el óxido de indio hidratado es más de cuarenta veces más tóxico cuando se inyecta, medido por la cantidad de indio introducido. [19]
Las personas pueden estar expuestas al indio en el lugar de trabajo por inhalación, ingestión, contacto con la piel y contacto con los ojos. El pulmón de indio es una enfermedad pulmonar caracterizada por proteinosis alveolar pulmonar y fibrosis pulmonar, descrita por primera vez por investigadores japoneses en 2003. Hasta 2010 [actualizar], se habían descrito 10 casos, aunque más de 100 trabajadores del indio habían documentado anomalías respiratorias. [18] El Instituto Nacional de Seguridad y Salud Ocupacional ha establecido un límite de exposición recomendado (REL) de 0,1 mg/m 3 durante una jornada laboral de ocho horas. [91]
{{cite book}}: CS1 maint: nombres numéricos: lista de autores ( enlace ){{cite journal}}: Requiere citar revista |journal=( ayuda ) ; Falta o está vacío |title=( ayuda )