La fisiología cardíaca o función del corazón es el estudio del funcionamiento sano y sin alteraciones del corazón : abarca el flujo sanguíneo, la estructura del miocardio , el sistema de conducción eléctrica del corazón, el ciclo cardíaco y el gasto cardíaco, y cómo estos interactúan y dependen unos de otros.



El corazón funciona como una bomba y actúa como una bomba doble en el sistema cardiovascular para proporcionar una circulación continua de sangre por todo el cuerpo. Esta circulación incluye la circulación sistémica y la circulación pulmonar . Ambos circuitos transportan sangre, pero también pueden verse en términos de los gases que transportan. La circulación pulmonar recoge oxígeno de los pulmones y entrega dióxido de carbono para la exhalación. El circuito sistémico transporta oxígeno al cuerpo y devuelve sangre relativamente desoxigenada y dióxido de carbono al circuito pulmonar. [1]
La sangre fluye a través del corazón en una dirección, desde las aurículas hasta los ventrículos, y sale por la arteria pulmonar hacia la circulación pulmonar, y por la aorta hacia la circulación sistémica. La arteria pulmonar (también llamada tronco) se ramifica en las arterias pulmonares izquierda y derecha para irrigar cada pulmón. Las válvulas tricúspide, bicúspide, aórtica y pulmonar impiden que la sangre fluya en sentido inverso ( regurgitación ). [ cita requerida ]
La función del corazón derecho es recolectar sangre desoxigenada, en la aurícula derecha, desde el cuerpo a través de la vena cava superior, la vena cava inferior y el seno coronario y bombearla, a través de la válvula tricúspide, a través del ventrículo derecho , a través de la válvula pulmonar semilunar y hacia la arteria pulmonar en la circulación pulmonar donde el dióxido de carbono puede intercambiarse por oxígeno en los pulmones. Esto sucede a través del proceso pasivo de difusión . En el corazón izquierdo, la sangre oxigenada regresa a la aurícula izquierda a través de la vena pulmonar. Luego se bombea al ventrículo izquierdo a través de la válvula bicúspide y hacia la aorta para la circulación sistémica. Finalmente, en los capilares sistémicos se produce el intercambio con el líquido tisular y las células del cuerpo; el oxígeno y los nutrientes se suministran a las células para su metabolismo y se intercambian por dióxido de carbono y productos de desecho [1] En este caso, el oxígeno y los nutrientes salen de los capilares sistémicos para ser utilizados por las células en sus procesos metabólicos, y el dióxido de carbono y los productos de desecho ingresarán a la sangre. [1]
Los ventrículos son más fuertes y gruesos que las aurículas, y la pared muscular que rodea al ventrículo izquierdo es más gruesa que la pared que rodea al ventrículo derecho debido a la mayor fuerza necesaria para bombear la sangre a través de la circulación sistémica . Las aurículas facilitan la circulación principalmente al permitir un flujo venoso ininterrumpido al corazón, evitando la inercia del flujo venoso interrumpido que de otro modo se produciría en cada sístole ventricular. [2]
El tejido muscular cardíaco tiene autorritmicidad , la capacidad única de iniciar un potencial de acción cardíaca a una velocidad fija, difundiendo el impulso rápidamente de célula a célula para desencadenar la contracción de todo el corazón. Esta autorritmicidad todavía está modulada por los sistemas endocrino y nervioso . [1]
Existen dos tipos de células musculares cardíacas: los cardiomiocitos , que tienen la capacidad de contraerse fácilmente, y los cardiomiocitos modificados, las células marcapasos del sistema de conducción. Los cardiomiocitos constituyen la mayor parte (99 %) de las células de las aurículas y los ventrículos. Estas células contráctiles responden a los impulsos del potencial de acción de las células marcapasos y son responsables de las contracciones que bombean sangre a través del cuerpo. Las células marcapasos constituyen solo (1 % de las células) y forman el sistema de conducción del corazón. Por lo general, son mucho más pequeñas que las células contráctiles y tienen pocas de las miofibrillas o miofilamentos , lo que significa que tienen una contractilidad limitada. Su función es similar en muchos aspectos a las neuronas . [1] El haz de fibras de His y Purkinje son cardiomiocitos especializados que funcionan en el sistema de conducción.

Los cardiomiocitos son considerablemente más cortos y tienen diámetros más pequeños que los miocitos esqueléticos . El músculo cardíaco (al igual que el músculo esquelético) se caracteriza por estrías : las franjas de bandas oscuras y claras que resultan de la disposición organizada de miofilamentos y miofibrillas en el sarcómero a lo largo de la longitud de la célula. Los túbulos T (transversales) son invaginaciones profundas del sarcolema (membrana celular) que penetran en la célula, lo que permite que los impulsos eléctricos lleguen al interior . En el músculo cardíaco, los túbulos T solo se encuentran en las líneas Z. [1] Cuando un potencial de acción hace que las células se contraigan, se libera calcio del retículo sarcoplásmico de las células, así como de los túbulos T. La liberación de calcio desencadena el deslizamiento de las fibrillas de actina y miosina , lo que conduce a la contracción. [3] Un suministro abundante de mitocondrias proporciona la energía para las contracciones. Por lo general, los cardiomiocitos tienen un solo núcleo central, pero también pueden tener dos o más. [1]
Las células del músculo cardíaco se ramifican libremente y están conectadas por uniones conocidas como discos intercalados que ayudan a la contracción sincronizada del músculo. [4] El sarcolema (membrana) de las células adyacentes se une en los discos intercalados. Están formados por desmosomas , proteoglicanos de enlace especializados , uniones estrechas y una gran cantidad de uniones en hendidura que permiten el paso de iones entre las células y ayudan a sincronizar la contracción. El tejido conectivo intercelular también ayuda a unir fuertemente las células para soportar las fuerzas de contracción. [1]
El músculo cardíaco experimenta patrones de respiración aeróbica , metabolizando principalmente lípidos y carbohidratos. El oxígeno de los pulmones se une a la hemoglobina y también se almacena en la mioglobina , de modo que hay un suministro abundante de oxígeno disponible. Los lípidos y el glucógeno también se almacenan dentro del sarcoplasma y las mitocondrias los descomponen para liberar ATP . Las células experimentan contracciones de tipo espasmódico con largos períodos refractarios seguidos de breves períodos de relajación cuando el corazón se llena de sangre para el siguiente ciclo. [1]

No se sabe muy bien cómo se mueve la señal eléctrica en las aurículas. Parece que se mueve de forma radial, pero el haz de Bachmann y el músculo del seno coronario desempeñan un papel en la conducción entre las dos aurículas, que tienen una sístole casi simultánea . [5] [6] [7] Mientras que en los ventrículos, la señal es transportada por un tejido especializado llamado fibras de Purkinje que luego transmiten la carga eléctrica al miocardio . [8]
Si las células cardíacas embrionarias se separan en una placa de Petri y se mantienen vivas, cada una es capaz de generar su propio impulso eléctrico seguido de una contracción. Cuando se colocan juntas dos células musculares cardíacas embrionarias que laten de forma independiente, la célula con la frecuencia inherente más alta marca el ritmo y el impulso se propaga de la célula más rápida a la más lenta para desencadenar una contracción. A medida que se unen más células, la célula más rápida continúa asumiendo el control de la frecuencia. Un corazón adulto completamente desarrollado mantiene la capacidad de generar su propio impulso eléctrico, desencadenado por las células más rápidas, como parte del sistema de conducción cardíaca. Los componentes del sistema de conducción cardíaca incluyen el sincitio auricular y ventricular , el nódulo sinoatrial, el nódulo auriculoventricular, el haz de His (haz auriculoventricular), las ramas del haz y las células de Purkinje. [1]

El ritmo sinusal normal lo establece el nódulo sinoauricular (SA) , el marcapasos del corazón . El nódulo SA es una agrupación especializada de cardiomiocitos en las paredes superior y posterior de la aurícula derecha, muy cerca de la abertura de la vena cava superior . El nódulo SA tiene la tasa más alta de despolarización . [1]
Este impulso se propaga desde su inicio en el nódulo SA a través de las aurículas a través de vías internodales especializadas, hasta las células contráctiles del miocardio auricular y el nódulo auriculoventricular. Las vías internodales constan de tres bandas (anterior, media y posterior) que conducen directamente desde el nódulo SA hasta el siguiente nódulo en el sistema de conducción, el nódulo auriculoventricular. El impulso tarda aproximadamente 50 ms (milisegundos) en viajar entre estos dos nódulos. La importancia relativa de esta vía ha sido debatida ya que el impulso llegaría al nódulo auriculoventricular simplemente siguiendo la vía célula por célula a través de las células contráctiles del miocardio en las aurículas. Además, existe una vía especializada llamada haz de Bachmann o banda interauricular que conduce el impulso directamente desde la aurícula derecha a la aurícula izquierda. Independientemente de la vía, cuando el impulso llega al tabique auriculoventricular, el tejido conectivo del esqueleto cardíaco impide que el impulso se propague a las células miocárdicas de los ventrículos, excepto en el nódulo auriculoventricular. [1] El evento eléctrico, la onda de despolarización, es el desencadenante de la contracción muscular. La onda de despolarización comienza en la aurícula derecha y el impulso se propaga a través de las porciones superiores de ambas aurículas y luego hacia abajo a través de las células contráctiles. Las células contráctiles luego comienzan a contraerse desde la porción superior a la inferior de las aurículas, bombeando sangre de manera eficiente a los ventrículos. [1]
El nódulo auriculoventricular (AV) es un segundo grupo de células conductoras miocárdicas especializadas, ubicado en la porción inferior de la aurícula derecha dentro del tabique auriculoventricular. El tabique impide que el impulso se propague directamente a los ventrículos sin pasar por el nódulo AV. Hay una pausa crítica antes de que el nódulo AV se despolarice y transmita el impulso al haz auriculoventricular. Este retraso en la transmisión se debe en parte al pequeño diámetro de las células del nódulo, que ralentiza el impulso. Además, la conducción entre las células nodales es menos eficiente que entre las células conductoras. Estos factores significan que el impulso tarda aproximadamente 100 ms en pasar por el nódulo. Esta pausa es crítica para la función cardíaca, ya que permite que los cardiomiocitos auriculares completen su contracción que bombea sangre a los ventrículos antes de que el impulso se transmita a las células del propio ventrículo. Con una estimulación extrema por parte del nódulo SA, el nódulo AV puede transmitir impulsos a un máximo de 220 por minuto. Esto establece la frecuencia cardíaca máxima típica en un individuo joven y sano. Los corazones dañados o estimulados por fármacos pueden contraerse a frecuencias más altas, pero a estas frecuencias, el corazón ya no puede bombear sangre de manera eficaz. [1]
El haz de His, que se origina en el nódulo AV, avanza a través del tabique interventricular antes de dividirse en dos ramas del haz , comúnmente llamadas ramas izquierda y derecha del haz. La rama izquierda del haz tiene dos fascículos. La rama izquierda del haz irriga el ventrículo izquierdo y la rama derecha del haz, el ventrículo derecho. Dado que el ventrículo izquierdo es mucho más grande que el derecho, la rama izquierda del haz también es considerablemente más grande que la derecha. Porciones de la rama derecha del haz se encuentran en la banda moderadora e irrigan los músculos papilares derechos. Debido a esta conexión, cada músculo papilar recibe el impulso aproximadamente al mismo tiempo, por lo que comienzan a contraerse simultáneamente justo antes que el resto de las células contráctiles del miocardio de los ventrículos. Se cree que esto permite que se desarrolle tensión en las cuerdas tendinosas antes de la contracción del ventrículo derecho. No hay una banda moderadora correspondiente en el izquierdo. Ambas ramas del haz descienden y alcanzan el vértice del corazón, donde se conectan con las fibras de Purkinje. Este paso demora aproximadamente 25 ms. [1]
Las fibras de Purkinje son fibras conductoras miocárdicas adicionales que propagan el impulso a las células contráctiles miocárdicas en los ventrículos. Se extienden por todo el miocardio desde el ápice del corazón hacia el tabique auriculoventricular y la base del corazón. Las fibras de Purkinje tienen una velocidad de conducción inherente rápida y el impulso eléctrico llega a todas las células musculares ventriculares en aproximadamente 75 ms. Dado que el estímulo eléctrico comienza en el ápice, la contracción también comienza en el ápice y viaja hacia la base del corazón, de manera similar a apretar un tubo de pasta de dientes desde la parte inferior. Esto permite que la sangre sea bombeada fuera de los ventrículos y hacia la aorta y el tronco pulmonar. El tiempo total transcurrido desde el inicio del impulso en el nódulo SA hasta la despolarización de los ventrículos es de aproximadamente 225 ms. [1]
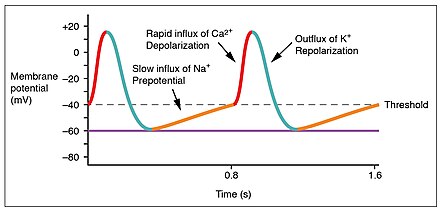
Los potenciales de acción son considerablemente diferentes entre los cardiomiocitos conductores y contractivos. Si bien los iones de sodio Na + y potasio K + desempeñan papeles esenciales, los iones de calcio Ca2 + también son críticos para ambos tipos de células. A diferencia de los músculos esqueléticos y las neuronas, las células conductoras cardíacas no tienen un potencial de reposo estable. Las células conductoras contienen una serie de canales de iones de sodio que permiten una entrada normal y lenta de iones de sodio que hace que el potencial de membrana aumente lentamente desde un valor inicial de −60 mV hasta aproximadamente −40 mV. El movimiento resultante de iones de sodio crea una despolarización espontánea (o despolarización prepotencial). [1]
En este punto, los canales de calcio se abren y el Ca 2+ entra en la célula, despolarizándola aún más a un ritmo más rápido hasta alcanzar un valor de aproximadamente +5 mV. En este punto, los canales de iones de calcio se cierran y los canales de potasio se abren, lo que permite la salida de K + y da como resultado la repolarización. Cuando el potencial de membrana alcanza aproximadamente −60 mV, los canales de K + se cierran y los canales de Na + se abren, y comienza nuevamente la fase prepotencial. Este proceso le da la autorritmicidad al músculo cardíaco. [1]
En las células contráctiles se observa un patrón eléctrico claramente diferente. En este caso, se produce una despolarización rápida, seguida de una fase de meseta y, a continuación, de una repolarización. Este fenómeno explica los largos períodos refractarios que necesitan las células musculares cardíacas para bombear sangre de forma eficaz antes de poder activarse por segunda vez. Estos miocitos cardíacos normalmente no inician su propio potencial eléctrico, aunque son capaces de hacerlo, sino que esperan a que les llegue un impulso. [1]
Las células contráctiles muestran una fase de reposo mucho más estable que las células conductoras, a aproximadamente -80 mV para las células de las aurículas y -90 mV para las células de los ventrículos. A pesar de esta diferencia inicial, los demás componentes de sus potenciales de acción son prácticamente idénticos. En ambos casos, cuando se estimulan con un potencial de acción, los canales dependientes del voltaje se abren rápidamente, iniciando el mecanismo de retroalimentación positiva de la despolarización. Esta rápida afluencia de iones con carga positiva eleva el potencial de membrana a aproximadamente +30 mV, momento en el que se cierran los canales de sodio. El período de despolarización rápida suele durar entre 3 y 5 ms. A la despolarización le sigue la fase de meseta, en la que el potencial de membrana disminuye con relativa lentitud. Esto se debe en gran parte a la apertura de los canales lentos de Ca2 + , lo que permite que el Ca2 + entre en la célula mientras que quedan abiertos pocos canales de K + , lo que permite que el K + salga de la célula. La fase de meseta relativamente larga dura aproximadamente 175 ms. Una vez que el potencial de membrana alcanza aproximadamente cero, los canales de Ca 2+ se cierran y los canales de K + se abren, permitiendo que el K + salga de la célula. La repolarización dura aproximadamente 75 ms. En este punto, el potencial de membrana cae hasta alcanzar niveles de reposo una vez más y el ciclo se repite. El evento completo dura entre 250 y 300 ms. [1]
El período refractario absoluto del músculo contráctil cardíaco dura aproximadamente 200 ms, y el período refractario relativo dura aproximadamente 50 ms, lo que suma un total de 250 ms. Este período prolongado es fundamental, ya que el músculo cardíaco debe contraerse para bombear sangre de manera eficaz y la contracción debe seguir los eventos eléctricos. Sin períodos refractarios prolongados, se producirían contracciones prematuras en el corazón y no serían compatibles con la vida. [1]

Los iones de calcio desempeñan dos papeles fundamentales en la fisiología del músculo cardíaco. Su entrada a través de los canales lentos de calcio es responsable de la fase de meseta prolongada y del período refractario absoluto. Los iones de calcio también se combinan con la proteína reguladora troponina en el complejo de troponina . Ambas funciones permiten que el miocardio funcione correctamente. [1]
Aproximadamente el 20 por ciento del calcio necesario para la contracción se obtiene a partir de la entrada de Ca 2+ durante la fase de meseta. El Ca 2+ restante para la contracción se libera del almacenamiento en el retículo sarcoplásmico. [1]
El patrón de despolarización prepotencial o espontánea, seguida de una rápida despolarización y repolarización, que acabamos de describir, se observa en el nódulo SA y en algunas otras células conductoras del corazón. Como el nódulo SA es el marcapasos, alcanza el umbral más rápido que cualquier otro componente del sistema de conducción. Iniciará los impulsos que se propagarán a las demás células conductoras. El nódulo SA, sin control nervioso o endocrino, iniciaría un impulso cardíaco aproximadamente 80-100 veces por minuto. Aunque cada componente del sistema de conducción es capaz de generar su propio impulso, la frecuencia se reduce progresivamente desde el nódulo SA hasta las fibras de Purkinje. Sin el nódulo SA, el nódulo AV generaría una frecuencia cardíaca de 40-60 latidos por minuto. Si el nódulo AV estuviera bloqueado, el haz auriculoventricular se activaría a una frecuencia de aproximadamente 30-40 impulsos por minuto. Las ramas del haz tendrían una frecuencia inherente de 20 a 30 impulsos por minuto, y las fibras de Purkinje se activarían a 15 a 20 impulsos por minuto. Si bien algunos atletas aeróbicos excepcionalmente entrenados muestran frecuencias cardíacas en reposo en el rango de 30 a 40 latidos por minuto (la cifra más baja registrada es 28 latidos por minuto para Miguel Indurain , un ciclista), para la mayoría de las personas, las frecuencias inferiores a 50 latidos por minuto indicarían una afección llamada bradicardia. Dependiendo del individuo específico, a medida que las frecuencias caen muy por debajo de este nivel, el corazón no podría mantener un flujo adecuado de sangre a los tejidos vitales, lo que inicialmente resulta en una pérdida decreciente de la función en todos los sistemas, pérdida de conocimiento y, en última instancia, la muerte. [1]

El período de tiempo que comienza con la contracción de las aurículas y termina con la relajación ventricular se conoce como ciclo cardíaco. El período de contracción que experimenta el corazón mientras bombea sangre a la circulación se llama sístole. El período de relajación que ocurre cuando las cámaras se llenan de sangre se llama diástole. Tanto las aurículas como los ventrículos experimentan sístole y diástole, y es esencial que estos componentes se regulen y coordinen cuidadosamente para garantizar que la sangre se bombee de manera eficiente al cuerpo. [1]

Los líquidos se desplazan desde las regiones de alta presión a las de menor presión. Por consiguiente, cuando las cámaras del corazón están relajadas (diástole), la sangre fluye hacia las aurículas desde la presión más alta de las venas. A medida que la sangre fluye hacia las aurículas, la presión aumenta, por lo que la sangre se moverá inicialmente de manera pasiva desde las aurículas hacia los ventrículos. Cuando el potencial de acción hace que los músculos de las aurículas se contraigan (sístole auricular), la presión dentro de las aurículas aumenta aún más, bombeando sangre hacia los ventrículos. Durante la sístole ventricular, la presión aumenta en los ventrículos, bombeando sangre hacia el tronco pulmonar desde el ventrículo derecho y hacia la aorta desde el ventrículo izquierdo. [1]
Al comienzo del ciclo cardíaco, tanto las aurículas como los ventrículos están relajados (diástole). La sangre fluye hacia la aurícula derecha desde las venas cavas superior e inferior y el seno coronario. La sangre fluye hacia la aurícula izquierda desde las cuatro venas pulmonares. Las dos válvulas auriculoventriculares, la tricúspide y la mitral, están abiertas, por lo que la sangre fluye sin impedimentos desde las aurículas hacia los ventrículos. Aproximadamente el 70-80 por ciento del llenado ventricular se produce por este método. Las dos válvulas semilunares, la pulmonar y la aórtica, están cerradas, lo que impide el reflujo de sangre hacia los ventrículos derecho e izquierdo desde el tronco pulmonar a la derecha y la aorta a la izquierda. [1]
La contracción de las aurículas sigue a la despolarización, representada por la onda P del ECG. A medida que los músculos auriculares se contraen desde la porción superior de las aurículas hacia el tabique auriculoventricular, aumenta la presión dentro de las aurículas y la sangre se bombea hacia los ventrículos a través de las válvulas auriculoventriculares abiertas (tricúspide y mitral o bicúspide). Al comienzo de la sístole auricular, los ventrículos normalmente están llenos con aproximadamente el 70-80 por ciento de su capacidad debido al flujo de entrada durante la diástole. La contracción auricular, también conocida como "patada auricular", contribuye con el 20-30 por ciento restante del llenado. La sístole auricular dura aproximadamente 100 ms y termina antes de la sístole ventricular, cuando el músculo auricular regresa a la diástole. [1] hala' Texto en negrita'
La sístole ventricular sigue a la despolarización de los ventrículos y está representada por el complejo QRS en el ECG. Puede dividirse convenientemente en dos fases, que duran un total de 270 ms. Al final de la sístole auricular y justo antes de la contracción ventricular, los ventrículos contienen aproximadamente 130 ml de sangre en un adulto en reposo y en posición de pie. Este volumen se conoce como volumen telediastólico (VTD) o precarga. [1]
Inicialmente, a medida que los músculos del ventrículo se contraen, la presión de la sangre dentro de la cámara aumenta, pero aún no es lo suficientemente alta como para abrir las válvulas semilunares (pulmonar y aórtica) y ser expulsada del corazón. Sin embargo, la presión sanguínea aumenta rápidamente por encima de la de las aurículas que ahora están relajadas y en diástole. Este aumento de presión hace que la sangre fluya de regreso hacia las aurículas, cerrando las válvulas tricúspide y mitral. Como la sangre no se expulsa de los ventrículos en esta etapa temprana, el volumen de sangre dentro de la cámara permanece constante. En consecuencia, esta fase inicial de la sístole ventricular se conoce como contracción isovolumétrica. [1]
En la segunda fase de la sístole ventricular, la fase de eyección ventricular, la contracción del músculo ventricular ha elevado la presión dentro del ventrículo hasta el punto de que es mayor que las presiones en el tronco pulmonar y la aorta. La sangre es bombeada desde el corazón, abriendo las válvulas semilunares pulmonar y aórtica. La presión generada por el ventrículo izquierdo será apreciablemente mayor que la presión generada por el ventrículo derecho, ya que la presión existente en la aorta será mucho mayor. Sin embargo, ambos ventrículos bombean la misma cantidad de sangre. Esta cantidad se conoce como volumen sistólico . El volumen sistólico normalmente estará en el rango de 70-80 mL. Dado que la sístole ventricular comenzó con un VTD de aproximadamente 130 mL de sangre, esto significa que todavía quedan 50-60 mL de sangre en el ventrículo después de la contracción. Este volumen de sangre se conoce como volumen sistólico final (VTS). [1]
La relajación ventricular, o diástole, sigue a la repolarización de los ventrículos y está representada por la onda T del ECG. También se divide en dos fases distintas y dura aproximadamente 430 ms. [1]
Durante la fase inicial de la diástole ventricular, a medida que el músculo ventricular se relaja, la presión sobre la sangre restante dentro del ventrículo comienza a disminuir. Cuando la presión dentro de los ventrículos cae por debajo de la presión en el tronco pulmonar y la aorta, la sangre fluye de regreso hacia el corazón, lo que produce la muesca dicrótica (pequeña depresión) que se observa en los registros de presión arterial. Las válvulas semilunares se cierran para evitar el reflujo hacia el corazón. Dado que las válvulas auriculoventriculares permanecen cerradas en este punto, no hay cambios en el volumen de sangre en el ventrículo, por lo que la fase inicial de la diástole ventricular se denomina fase de relajación ventricular isovolumétrica, también llamada fase de relajación ventricular isovolumétrica. [1]
En la segunda fase de la diástole ventricular, llamada diástole ventricular tardía, a medida que el músculo ventricular se relaja, la presión sobre la sangre dentro de los ventrículos disminuye aún más. Finalmente, cae por debajo de la presión en las aurículas. Cuando esto ocurre, la sangre fluye desde las aurículas hacia los ventrículos, abriendo las válvulas tricúspide y mitral. A medida que la presión disminuye dentro de los ventrículos, la sangre fluye desde las venas principales hacia las aurículas relajadas y desde allí hacia los ventrículos. Ambas cámaras están en diástole, las válvulas auriculoventriculares están abiertas y las válvulas semilunares permanecen cerradas. El ciclo cardíaco está completo. [1]
Uno de los métodos más simples para evaluar el estado del corazón es escucharlo con un estetoscopio . [1] En un corazón sano, solo hay dos ruidos cardíacos audibles , llamados S1 y S2. El primer ruido cardíaco S1, es el sonido creado por el cierre de las válvulas auriculoventriculares durante la contracción ventricular y normalmente se describe como "lub". El segundo ruido cardíaco, S2, es el sonido de las válvulas semilunares cerrándose durante la diástole ventricular y se describe como "dub". [1] Cada sonido consta de dos componentes, que reflejan la ligera diferencia en el tiempo a medida que se cierran las dos válvulas. [9] S2 puede dividirse en dos sonidos distintos, ya sea como resultado de la inspiración o de diferentes problemas valvulares o cardíacos. [9] También pueden estar presentes ruidos cardíacos adicionales y estos dan lugar a ritmos de galope . Un tercer ruido cardíaco , S3, generalmente indica un aumento en el volumen sanguíneo ventricular. Un cuarto ruido cardíaco S4 se conoce como galope auricular y se produce por el sonido de la sangre que se fuerza hacia un ventrículo rígido. La presencia combinada de S3 y S4 da como resultado un galope cuádruple. [1]

Los soplos cardíacos son sonidos cardíacos anormales que pueden ser patológicos o benignos y existen numerosos tipos. [10] Los soplos se clasifican por volumen, desde 1) el más silencioso, hasta 6) el más fuerte, y se evalúan por su relación con los sonidos cardíacos y la posición en el ciclo cardíaco. [9] Los fonocardiogramas pueden registrar estos sonidos. [1] Los soplos pueden ser el resultado del estrechamiento (estenosis), regurgitación o insuficiencia de cualquiera de las válvulas cardíacas principales, pero también pueden ser el resultado de una serie de otros trastornos, incluidos los defectos del tabique auricular y ventricular . [9] Un ejemplo de soplo es el soplo de Still , que presenta un sonido musical en los niños, no presenta síntomas y desaparece en la adolescencia. [11]
En casos de pericarditis, se puede escuchar un tipo diferente de sonido, el roce pericárdico, en el que las membranas inflamadas pueden rozarse entre sí. [12]
La frecuencia cardíaca en reposo de un recién nacido puede ser de 120 latidos por minuto (lpm) y disminuye gradualmente hasta la madurez y luego aumenta gradualmente de nuevo con la edad. La frecuencia cardíaca en reposo de un adulto varía de 60 a 100 lpm. El ejercicio y los niveles de condición física, la edad y la tasa metabólica basal pueden afectar la frecuencia cardíaca. La frecuencia cardíaca de un atleta puede ser inferior a 60 lpm. Durante el ejercicio, la frecuencia puede ser de 150 lpm con frecuencias máximas que alcanzan entre 200 y 220 lpm. [1]
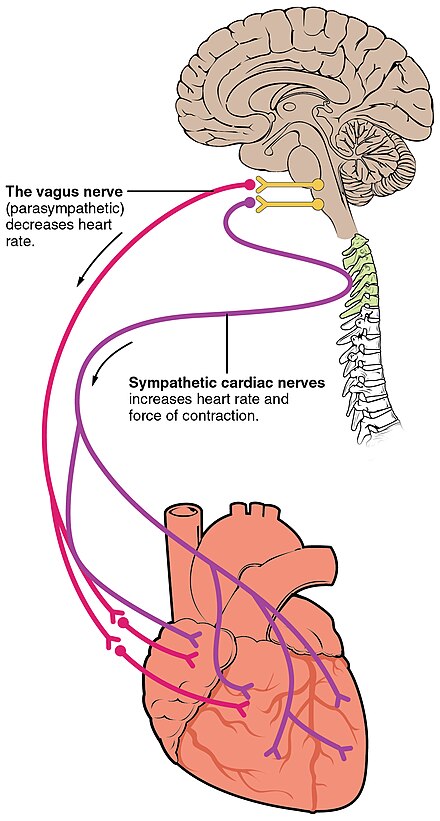

El ritmo sinusal normal de la frecuencia cardíaca es generado por el nódulo SA . También está influenciado por factores centrales a través de los nervios simpáticos y parasimpáticos [3] : 116–22 de los dos centros cardiovasculares pareados del bulbo raquídeo . La actividad aumenta a través de la estimulación simpática de los nervios cardioaceleradores y se inhibe a través de la estimulación parasimpática por el nervio vago . Durante el reposo, la estimulación vagal predomina normalmente ya que, si no se regula, el nódulo SA iniciaría un ritmo sinusal de aproximadamente 100 lpm. [1]
Los estímulos simpáticos y parasimpáticos fluyen a través del plexo cardíaco emparejado cerca de la base del corazón. Sin ninguna estimulación nerviosa, el nódulo SA establecería un ritmo sinusal de aproximadamente 100 lpm. Dado que las frecuencias en reposo son considerablemente menores que esto, se hace evidente que la estimulación parasimpática normalmente reduce la frecuencia cardíaca. [1] El centro cardioacelerador también envía fibras adicionales, formando los nervios cardíacos a través de los ganglios simpáticos (los ganglios cervicales más los ganglios torácicos superiores T1-T4) a los nódulos SA y AV, además de fibras adicionales a las aurículas y los ventrículos. Los ventrículos están más ricamente inervados por fibras simpáticas que por fibras parasimpáticas. La estimulación simpática provoca la liberación del neurotransmisor norepinefrina (también conocido como noradrenalina ) en la unión neuromuscular de los nervios cardíacos. Esto acorta el período de repolarización, acelerando así la tasa de despolarización y contracción, lo que resulta en un aumento de la frecuencia cardíaca. Abre canales de iones de sodio y calcio regulados por ligandos o químicos, lo que permite la entrada de iones con carga positiva. [1] La noradrenalina se une al receptor beta-1. Los medicamentos para la presión arterial alta se utilizan para bloquear estos receptores y, de esta manera, reducir la frecuencia cardíaca. [1]
Los centros cardiovasculares reciben información de una serie de receptores viscerales con impulsos que viajan a través de fibras sensoriales viscerales dentro de los nervios vago y simpático a través del plexo cardíaco. Entre estos receptores hay varios propiorreceptores , barorreceptores y quimiorreceptores , además de estímulos del sistema límbico que normalmente permiten la regulación precisa de la función cardíaca, a través de reflejos cardíacos. El aumento de la actividad física produce un aumento de las tasas de activación de varios propiorreceptores ubicados en los músculos, las cápsulas articulares y los tendones. Los centros cardiovasculares controlan estas tasas de activación aumentadas, suprimiendo la estimulación parasimpática o aumentando la estimulación simpática según sea necesario para aumentar el flujo sanguíneo. [1]
De manera similar, los barorreceptores son receptores de estiramiento ubicados en el seno aórtico, los cuerpos carotídeos, las venas cavas y otras ubicaciones, incluidos los vasos pulmonares y el lado derecho del corazón. Las tasas de activación de los barorreceptores representan la presión arterial, el nivel de actividad física y la distribución relativa de la sangre. Los centros cardíacos controlan la activación de los barorreceptores para mantener la homeostasis cardíaca, un mecanismo llamado reflejo barorreceptor. Con un aumento de la presión y el estiramiento, la tasa de activación de los barorreceptores aumenta y los centros cardíacos disminuyen la estimulación simpática y aumentan la estimulación parasimpática. A medida que la presión y el estiramiento disminuyen, la tasa de activación de los barorreceptores disminuye y los centros cardíacos aumentan la estimulación simpática y disminuyen la estimulación parasimpática. [1]
Existe un reflejo similar, llamado reflejo auricular o reflejo de Bainbridge , asociado con tasas variables de flujo sanguíneo a las aurículas. El aumento del retorno venoso estira las paredes de las aurículas donde se encuentran los barorreceptores especializados. Sin embargo, a medida que los barorreceptores auriculares aumentan su frecuencia de disparo y se estiran debido al aumento de la presión arterial, el centro cardíaco responde aumentando la estimulación simpática e inhibiendo la estimulación parasimpática para aumentar la frecuencia cardíaca. Lo opuesto también es cierto. [1]
Además del sistema nervioso autónomo , otros factores pueden afectar esto, como la epinefrina, la norepinefrina y las hormonas tiroideas; los niveles de varios iones, incluidos el calcio, el potasio y el sodio; la temperatura corporal; la hipoxia; y el equilibrio del pH. [1]
Los factores que aumentan la frecuencia cardíaca también provocan un aumento del volumen sistólico. Al igual que ocurre con los músculos esqueléticos, el corazón puede aumentar de tamaño y eficiencia con el ejercicio. [1] Por lo tanto, los atletas de resistencia, como los corredores de maratón, pueden tener un corazón hipertrofiado hasta en un 40 %. [3] : 1063–64 La diferencia entre el gasto cardíaco máximo y mínimo se conoce como reserva cardíaca y mide la capacidad residual para bombear sangre. [1] Las frecuencias cardíacas pueden alcanzar hasta 185–195 durante el ejercicio, dependiendo de la forma física de la persona. [3]

El gasto cardíaco (GC) es una medida de la cantidad de sangre bombeada por cada ventrículo (volumen sistólico, VS) en un minuto. Para calcularlo, se multiplica el volumen sistólico (VS) por la frecuencia cardíaca (FC), en latidos por minuto . [1] Se puede representar mediante la ecuación: GC = FC x VS [1]
El volumen sistólico final ( VS) se mide normalmente mediante un ecocardiograma para registrar el volumen diastólico final (VTD) y el volumen sistólico final (VTS), y calcular la diferencia: VS = VTD – VTS. El VS también se puede medir utilizando un catéter especializado, pero se trata de un procedimiento invasivo y mucho más peligroso para el paciente. Un VS medio para un individuo de 70 kg (150 lb) en reposo sería de aproximadamente 70 ml. Hay varias variables importantes, entre ellas el tamaño del corazón, la condición física y mental del individuo, el sexo, la contractilidad, la duración de la contracción, la precarga o VTD y la poscarga o resistencia. El rango normal para el VS sería de 55 a 100 ml. Una frecuencia cardíaca en reposo media sería de aproximadamente 75 lpm, pero podría oscilar entre 60 y 100 en algunos individuos. [1] Utilizando estos números (que se refieren a cada ventrículo, no a ambos), el CO medio es de 5,25 l/min, con un rango de 4,0 a 8,0 l/min. [1]

Los valores de volumen sistólico también se utilizan para calcular la fracción de eyección, que es la porción de sangre que se bombea o expulsa del corazón con cada contracción. Para calcular la fracción de eyección, el valor sistólico se divide por el volumen de eyección total. A pesar del nombre, la fracción de eyección normalmente se expresa como un porcentaje. Las fracciones de eyección varían aproximadamente entre el 55 y el 70 por ciento, con una media del 58 por ciento. [1]
Muchos de los factores que regulan la frecuencia cardíaca también afectan la función cardíaca al alterar el volumen sistólico . Si bien intervienen diversas variables, el volumen sistólico depende de la diferencia entre el volumen telediastólico y el volumen telesistólico. Los tres factores principales que intervienen son la precarga , la poscarga y la contractilidad . [1]
La precarga es otra forma de expresar el VTD. Por lo tanto, cuanto mayor sea el VTD, mayor será la precarga. Un factor principal es el tiempo de llenado ventricular. Cuanto más rápidas sean las contracciones, más corto será el tiempo de llenado y tanto el VTD como la precarga serán menores. [1]
La relación entre el estiramiento y la contracción ventricular se ha establecido en el mecanismo de Frank-Starling , que dice que la fuerza de contracción es directamente proporcional a la longitud inicial de la fibra muscular, de modo que cuanto mayor sea el estiramiento del ventrículo, mayor será la contracción. Cualquier estimulación simpática del sistema venoso aumentará el retorno venoso al corazón y el llenado ventricular. [1]
Los ventrículos deben desarrollar una cierta tensión para bombear sangre contra la resistencia del sistema vascular. Esta tensión se denomina poscarga . Cuando la resistencia aumenta, en particular debido a una lesión valvular estenótica , la poscarga debe aumentar necesariamente. También puede producirse una disminución de la resistencia vascular normal. Diferentes respuestas cardíacas actúan para restablecer la homeostasis de la presión y el flujo sanguíneo. [1]
La capacidad del miocardio para contraerse (su contractilidad ) controla el volumen sistólico, que determina el volumen sistólico final. Cuanto mayor sea la contracción, mayor será el volumen sistólico y menor el volumen sistólico final. Los factores inotrópicos positivos o negativos a través de la estimulación simpática y parasimpática respectivamente, pueden aumentar o disminuir la fuerza de las contracciones. La estimulación simpática desencadena la liberación de noradrenalina de los nervios cardíacos y también estimula la corteza suprarrenal para que secrete tanto adrenalina como noradrenalina. Estas secreciones aumentan la frecuencia cardíaca, la tasa metabólica posterior y la contractilidad. La estimulación parasimpática estimula la liberación de acetilcolina (ACh) del nervio vago , que disminuye la contractilidad, y el volumen sistólico, que aumenta el volumen sistólico final. [ cita requerida ]
Se han desarrollado varios fármacos sintéticos que pueden actuar como estimulantes o inhibidores inotrópicos. Los inotrópicos estimulantes, como la digoxina , provocan concentraciones más altas de iones de calcio que aumentan la contractilidad. El exceso de calcio ( hipercalcemia ) también es un inotrópico positivo. Los fármacos que son inotrópicos negativos incluyen los betabloqueantes y los bloqueadores de los canales de calcio . La hipoxia , la acidosis y la hipercalemia también son agentes inotrópicos negativos. [ cita requerida ]
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )