En química y física molecular , las moléculas fluxionales (o no rígidas ) son moléculas que sufren una dinámica tal que algunos o todos sus átomos se intercambian entre posiciones equivalentes a simetría. [1] Debido a que prácticamente todas las moléculas son fluxionales en algunos aspectos, por ejemplo, las rotaciones de enlaces en la mayoría de los compuestos orgánicos , el término fluxional depende del contexto y el método utilizado para evaluar la dinámica. A menudo, una molécula se considera fluxional si su firma espectroscópica muestra un ensanchamiento de líneas (más allá de lo dictado por el principio de incertidumbre de Heisenberg ) debido al intercambio químico. [2] En algunos casos, donde las velocidades son lentas, la fluxionalidad no se detecta espectroscópicamente, sino mediante etiquetado isotópico y otros métodos. [3]
Muchos compuestos organometálicos exhiben fluxionalidad. [4] Sin embargo, la fluxionalidad es omnipresente.
Los cambios dependientes de la temperatura en los espectros de RMN resultan de la dinámica asociada con las moléculas fluxionales cuando esa dinámica avanza a velocidades comparables a las diferencias de frecuencia observadas por la RMN. El experimento se llama DNMR y normalmente implica registrar espectros a varias temperaturas. En el caso ideal, los espectros de baja temperatura pueden asignarse al "límite de intercambio lento", mientras que los espectros registrados a temperaturas más altas corresponden a moléculas en el "límite de intercambio rápido". Normalmente, los espectros de alta temperatura son más simples que los registrados a bajas temperaturas, ya que a altas temperaturas, los sitios equivalentes se promedian. Antes de la aparición de DNMR, la cinética de las reacciones se medía en mezclas que no estaban en equilibrio, monitoreando el acercamiento al equilibrio.
Muchos procesos moleculares exhiben fluxionalidad que puede estudiarse en la escala de tiempo de RMN. [5] Más allá de los ejemplos destacados a continuación, otros ejemplos clásicos incluyen el reordenamiento de Cope en bullvaleno y la inversión de silla en ciclohexano .
Para procesos que son demasiado lentos para el análisis DNMR tradicional, es aplicable la técnica de transferencia de saturación por espín (SST, también llamada EXSY para espectroscopia de intercambio). Esta técnica de transferencia de magnetización proporciona información sobre la velocidad, siempre que las velocidades excedan 1/ T 1 . [6]
Aunque son menos comunes, algunas dinámicas también son observables en la escala de tiempo de la espectroscopia IR . Un ejemplo es la transferencia de electrones en un dímero de valencia mixta de grupos metálicos . La aplicación de la ecuación de coalescencia de dos señales separadas por 10 cm −1 da el siguiente resultado: [7]
Claramente, los procesos que inducen la ampliación de líneas en la escala de tiempo de IR deben ser mucho más rápidos que los casos que se intercambian en la escala de tiempo de RMN.
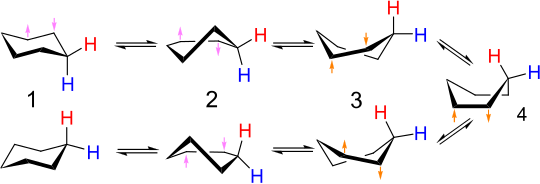
La interconversión de confórmeros de silla equivalentes de ciclohexano (y muchos otros compuestos cíclicos) se denomina inversión de anillo . Los enlaces carbono-hidrógeno que son axiales en una configuración se vuelven ecuatoriales en la otra y viceversa. A temperatura ambiente, las dos conformaciones de silla se equilibran rápidamente . Los espectros de RMN de protón y carbono 13 del ciclohexano muestran solo singletes cerca de la temperatura ambiente. A bajas temperaturas, el singlete en el espectro de 1 H NMR se desacopla, pero el espectro de 13 C NMR permanece sin cambios. [9]

Una molécula fluxional prototípica es el pentafluoruro de fósforo . Su espectro de RMN de 19 F consta de un doblete acoplado a 31 P, lo que indica que los centros de flúor ecuatorial y axial se intercambian rápidamente en la escala de tiempo de RMN. La espectroscopia de RMN de flúor-19 , incluso a temperaturas tan bajas como -100 °C, no logra distinguir los ambientes de flúor axiales de los ecuatoriales. La aparente equivalencia surge de la baja barrera para la pseudorotación mediante el mecanismo de Berry , mediante el cual los átomos de flúor axiales y ecuatoriales intercambian rápidamente posiciones. [10] El pentacarbonilo de hierro (Fe(CO) 5 ) sigue el patrón establecido para PF 5 : solo se observa una señal en el espectro de RMN de 13 C cerca de la temperatura ambiente), mientras que a bajas temperaturas, se pueden observar dos señales en una proporción de 2:3. resuelto. En el tetrafluoruro de azufre (SF 4 ), se observa un patrón similar aunque este compuesto tiene sólo cuatro ligandos.
Un ion fluxional bien estudiado es el ion metanio , CH+
5. [11] Incluso en el cero absoluto no existe una estructura molecular rígida; los átomos de H están siempre en movimiento. Más precisamente, la distribución espacial de protones en CH+
5es muchas veces más ancho que su molécula madre CH 4 , metano. [12] [13]
Si bien la no rigidez es común para las especies pentacoordinadas, las especies de seis coordenadas generalmente adoptan una geometría molecular octaédrica más rígida , presentando una matriz compacta de seis átomos ligados que rodean un átomo central. Dichos compuestos se reorganizan intramolecularmente mediante el giro de Ray-Dutt y el giro de Bailar , pero las barreras para estos procesos suelen ser altas, de modo que estos procesos no conducen a un ensanchamiento de la línea. Para algunos compuestos, la dinámica se produce mediante la disociación de un ligando, dando un intermedio pentacoordinado, que está sujeto a los mecanismos discutidos anteriormente. Otro mecanismo más, exhibido por el Fe(CO) 4 (SiMe 3 ) 2 y complejos de hidruros relacionados, es la mezcla intramolecular de ligandos sobre las caras del tetraedro definidas por los cuatro ligandos de CO. [14]
Un ejemplo clásico de molécula fluxional es la dimetilformamida (DMF). [15]

A temperaturas cercanas a los 100 °C, el espectro de RMN 1 H de 500 MHz de DMF muestra solo una señal para los grupos metilo. Sin embargo, cerca de la temperatura ambiente se observan señales separadas para los grupos metilo no equivalentes. El tipo de cambio se puede calcular a la temperatura en la que las dos señales simplemente se fusionan. Esta "temperatura de coalescencia" depende del campo de medición. La ecuación relevante es:
donde Δν o es la diferencia en Hz entre las frecuencias de los sitios de intercambio. Estas frecuencias se obtienen del espectro limitante de RMN de baja temperatura. A estas temperaturas más bajas, la dinámica continúa, por supuesto, pero la contribución de la dinámica al ensanchamiento de la línea es insignificante.
Por ejemplo, si Δν o = 1 ppm a 500 MHz
El compuesto Fe(η 5 -C 5 H 5 )(η 1 -C 5 H 5 )(CO) 2 presenta el fenómeno del "silbido de anillo".
A 30 °C, el espectro de 1 H NMR muestra solo dos picos, uno típico (δ5,6) del η 5 -C 5 H 5 y el otro asignado a η 1 -C 5 H 5 . El singlete asignado al ligando η 1 -C 5 H 5 se divide a bajas temperaturas debido al lento salto del centro de Fe de carbono a carbono en el ligando η 1 -C 5 H 5 . [16] Se han propuesto dos mecanismos, y el consenso favorece la vía de 1,2 cambios. [17]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )