
En el análisis químico , la cromatografía es una técnica de laboratorio para la separación de una mezcla en sus componentes. La mezcla se disuelve en un disolvente fluido (gas o líquido) llamado fase móvil , que la transporta a través de un sistema (una columna, un tubo capilar, una placa o una lámina) en el que se fija un material llamado fase estacionaria . Debido a que los diferentes constituyentes de la mezcla tienden a tener diferentes afinidades por la fase estacionaria y se retienen durante diferentes períodos de tiempo dependiendo de sus interacciones con sus sitios de superficie, los constituyentes viajan a diferentes velocidades aparentes en el fluido móvil, lo que hace que se separen. La separación se basa en la partición diferencial entre las fases móvil y estacionaria. Las diferencias sutiles en el coeficiente de partición de un compuesto dan como resultado una retención diferencial en la fase estacionaria y, por lo tanto, afectan la separación. [1]
La cromatografía puede ser preparativa o analítica . El propósito de la cromatografía preparativa es separar los componentes de una mezcla para su uso posterior y, por lo tanto, es una forma de purificación . [2] [3] Este proceso está asociado con mayores costos debido a su modo de producción. [4] [2] La cromatografía analítica se realiza normalmente con cantidades más pequeñas de material y tiene como objetivo establecer la presencia o medir las proporciones relativas de analitos en una mezcla. Los dos tipos no son mutuamente excluyentes. [5]
La cromatografía, pronunciada / ˌkrōʊməˈtɒɡrəfi / , se deriva del griego χρῶμα chrōma , que significa " color " , y γράφειν gráphein , que significa "escribir". La combinación de estos dos términos fue heredada directamente de la invención de la técnica utilizada por primera vez para separar pigmentos biológicos . [6]
La cromatografía fue ideada por primera vez en la Universidad de Kazán por el científico ruso nacido en Italia Mikhail Tsvet en 1900. [7] [8] Desarrolló la técnica y acuñó el término cromatografía en la primera década del siglo XX, principalmente para la separación de pigmentos vegetales como la clorofila , los carotenos y las xantofilas . Dado que estos componentes se separan en bandas de diferentes colores (verde, naranja y amarillo, respectivamente), inspiraron directamente el nombre de la técnica. Los nuevos tipos de cromatografía desarrollados durante las décadas de 1930 y 1940 hicieron que la técnica fuera útil para muchos procesos de separación . [9]
La técnica de la cromatografía se desarrolló sustancialmente como resultado del trabajo de Archer John Porter Martin y Richard Laurence Millington Synge durante las décadas de 1940 y 1950, por el que ganaron el Premio Nobel de Química en 1952. [10] Establecieron los principios y las técnicas básicas de la cromatografía de partición, y su trabajo fomentó el rápido desarrollo de varios métodos cromatográficos: cromatografía en papel , cromatografía de gases y lo que se conocería como cromatografía líquida de alto rendimiento . Desde entonces, la tecnología ha avanzado rápidamente. Los investigadores descubrieron que los principios principales de la cromatografía de Tsvet se podían aplicar de muchas formas diferentes, lo que dio como resultado las diferentes variedades de cromatografía descritas a continuación. Los avances están mejorando continuamente el rendimiento técnico de la cromatografía, lo que permite la separación de moléculas cada vez más similares.
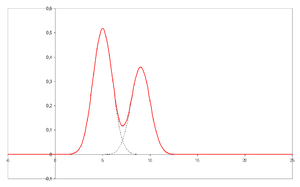
 En el eje x se representa el tiempo de retención y en el eje y una señal (obtenida, por ejemplo, mediante un espectrofotómetro , un espectrómetro de masas o una variedad de otros detectores) correspondiente a la respuesta creada por los analitos que salen del sistema. En el caso de un sistema óptimo, la señal es proporcional a la concentración del analito específico separado.
En el eje x se representa el tiempo de retención y en el eje y una señal (obtenida, por ejemplo, mediante un espectrofotómetro , un espectrómetro de masas o una variedad de otros detectores) correspondiente a la respuesta creada por los analitos que salen del sistema. En el caso de un sistema óptimo, la señal es proporcional a la concentración del analito específico separado.La cromatografía se basa en el concepto de coeficiente de partición. Cualquier soluto se reparte entre dos disolventes inmiscibles. Cuando uno hace que un disolvente sea inmóvil (por adsorción en una matriz de soporte sólido) y otro móvil, se obtiene el resultado en las aplicaciones más comunes de la cromatografía. Si el soporte de la matriz, o fase estacionaria, es polar (por ejemplo, celulosa , sílice , etc.), se trata de cromatografía de fase directa. De lo contrario, esta técnica se conoce como fase reversa, donde se utiliza una fase estacionaria no polar (por ejemplo, un derivado no polar de C-18 ).
La cromatografía en columna es una técnica de separación en la que el lecho estacionario se encuentra dentro de un tubo. Las partículas de la fase estacionaria sólida o del soporte recubierto con una fase estacionaria líquida pueden llenar todo el volumen interior del tubo (columna empacada) o concentrarse sobre o a lo largo de la pared interior del tubo dejando un camino abierto y sin restricciones para la fase móvil en la parte media del tubo (columna tubular abierta). Las diferencias en las velocidades de movimiento a través del medio se calculan para diferentes tiempos de retención de la muestra. [12] [13] En 1978, W. Clark Still introdujo una versión modificada de la cromatografía en columna llamada cromatografía en columna flash (flash). [14] [15] La técnica es muy similar a la cromatografía en columna tradicional, excepto que el disolvente se impulsa a través de la columna aplicando presión positiva. Esto permitió que la mayoría de las separaciones se realizaran en menos de 20 minutos, con separaciones mejoradas en comparación con el método antiguo. Los sistemas de cromatografía flash modernos se venden como cartuchos de plástico preenvasados y el disolvente se bombea a través del cartucho. Los sistemas también pueden conectarse con detectores y colectores de fracciones para proporcionar automatización. La introducción de bombas de gradiente dio como resultado separaciones más rápidas y un menor uso de solventes.
En la adsorción en lecho expandido , se utiliza un lecho fluidizado en lugar de una fase sólida formada por un lecho empacado. Esto permite omitir los pasos de limpieza iniciales, como la centrifugación y la filtración, para caldos de cultivo o suspensiones de células rotas.
La cromatografía de fosfocelulosa aprovecha la afinidad de unión de muchas proteínas que se unen al ADN por la fosfocelulosa. Cuanto más fuerte sea la interacción de una proteína con el ADN, mayor será la concentración de sal necesaria para eluir esa proteína. [16]
La cromatografía plana es una técnica de separación en la que la fase estacionaria está presente como o sobre un plano. El plano puede ser un papel, que sirve como tal o está impregnado por una sustancia que actúa como lecho estacionario ( cromatografía en papel ) o una capa de partículas sólidas esparcidas sobre un soporte como una placa de vidrio ( cromatografía de capa fina ). Los diferentes compuestos de la mezcla de muestra recorren diferentes distancias según la intensidad con la que interactúan con la fase estacionaria en comparación con la fase móvil. El factor de retención específico (R f ) de cada sustancia química se puede utilizar para ayudar a identificar una sustancia desconocida.


La cromatografía en papel es una técnica que consiste en colocar un pequeño punto o línea de solución de muestra sobre una tira de papel cromatográfico . El papel se coloca en un recipiente con una capa superficial de disolvente y se sella. A medida que el disolvente sube a través del papel, se encuentra con la mezcla de muestra, que comienza a viajar por el papel con el disolvente. Este papel está hecho de celulosa , una sustancia polar , y los compuestos dentro de la mezcla viajan más lejos si son menos polares. Las sustancias más polares se unen al papel de celulosa más rápidamente y, por lo tanto, no viajan tan lejos.

La cromatografía en capa fina (TLC) es una técnica de laboratorio ampliamente utilizada para separar diferentes sustancias bioquímicas en función de sus atracciones relativas a las fases estacionaria y móvil. Es similar a la cromatografía en papel . Sin embargo, en lugar de utilizar una fase estacionaria de papel, implica una fase estacionaria de una capa fina de adsorbente como gel de sílice , alúmina o celulosa sobre un sustrato plano e inerte . La TLC es muy versátil; se pueden separar múltiples muestras simultáneamente en la misma capa, lo que la hace muy útil para aplicaciones de detección, como la prueba de niveles de fármacos y la pureza del agua. [17]
La posibilidad de contaminación cruzada es baja, ya que cada separación se realiza en una nueva capa. En comparación con el papel, tiene la ventaja de que se procesa más rápido, se separa mejor, se realiza un mejor análisis cuantitativo y se puede elegir entre diferentes adsorbentes. Para lograr una resolución aún mejor y una separación más rápida que utilice menos solvente, se puede utilizar la cromatografía en capa fina de alto rendimiento . Un uso popular más antiguo había sido diferenciar cromosomas observando la distancia en el gel (la separación era un paso separado).
El principio básico de la cromatografía de desplazamiento es el siguiente: una molécula con una alta afinidad por la matriz cromatográfica (el desplazador) compite eficazmente por los sitios de unión y, por lo tanto, desplaza a todas las moléculas con menores afinidades. [18] Existen claras diferencias entre la cromatografía de desplazamiento y la cromatografía de elución. En el modo de elución, las sustancias normalmente emergen de una columna en picos gaussianos estrechos. Se desea una amplia separación de los picos, preferiblemente hasta la línea base, para una máxima purificación. La velocidad a la que cualquier componente de una mezcla se desplaza por la columna en el modo de elución depende de muchos factores. Pero para que dos sustancias se desplacen a diferentes velocidades y, por lo tanto, se resuelvan, deben existir diferencias sustanciales en alguna interacción entre las biomoléculas y la matriz cromatográfica. Los parámetros operativos se ajustan para maximizar el efecto de esta diferencia. En muchos casos, la separación de la línea base de los picos solo se puede lograr con la elución en gradiente y cargas bajas en la columna. Por lo tanto, dos desventajas de la cromatografía en modo de elución, especialmente a escala preparativa, son la complejidad operativa, debido al bombeo de disolvente en gradiente, y el bajo rendimiento, debido a las bajas cargas de la columna. La cromatografía de desplazamiento tiene ventajas sobre la cromatografía de elución en que los componentes se resuelven en zonas consecutivas de sustancias puras en lugar de "picos". Debido a que el proceso aprovecha la no linealidad de las isotermas, se puede separar una mayor cantidad de alimentación de columna en una columna dada y los componentes purificados se recuperan en concentraciones significativamente más altas.
La cromatografía de gases (GC), también conocida a veces como cromatografía de gases-líquidos (GLC), es una técnica de separación en la que la fase móvil es un gas. La separación por cromatografía de gases siempre se lleva a cabo en una columna, que normalmente está "empacada" o "capilar". Las columnas empaquetadas son los caballos de batalla de rutina de la cromatografía de gases, ya que son más baratas y fáciles de usar y, a menudo, ofrecen un rendimiento adecuado. Las columnas capilares generalmente brindan una resolución muy superior y, aunque son más caras, se están utilizando ampliamente, especialmente para mezclas complejas. Además, las columnas capilares se pueden dividir en tres clases: columnas tubulares abiertas de capa porosa (PLOT), columnas tubulares abiertas con revestimiento de pared (WCOT) y columnas tubulares abiertas con revestimiento de soporte (SCOT). Las columnas PLOT son únicas en el sentido de que la fase estacionaria se adsorbe a las paredes de la columna, mientras que las columnas WCOT tienen una fase estacionaria que está unida químicamente a las paredes. Las columnas SCOT son, en cierto modo, una combinación de los dos tipos mencionados, ya que tienen partículas de soporte adheridas a las paredes de la columna, pero esas partículas tienen una fase líquida unida químicamente a ellas. [19] Ambos tipos de columnas están hechas de materiales no adsorbentes y químicamente inertes. El acero inoxidable y el vidrio son los materiales habituales para las columnas rellenas y el cuarzo o la sílice fundida para las columnas capilares.
La cromatografía de gases se basa en un equilibrio de partición del analito entre una fase estacionaria sólida o líquida viscosa (a menudo un material líquido a base de silicona) y un gas móvil (más a menudo helio). La fase estacionaria se adhiere al interior de un tubo de vidrio o sílice fundida de diámetro pequeño (comúnmente 0,53 - 0,18 mm de diámetro interior) (una columna capilar) o una matriz sólida dentro de un tubo de metal más grande (una columna empaquetada). Se utiliza ampliamente en química analítica ; aunque las altas temperaturas utilizadas en GC lo hacen inadecuado para biopolímeros o proteínas de alto peso molecular (el calor los desnaturaliza), se encuentra con frecuencia en bioquímica , es muy adecuado para su uso en los campos petroquímico , de monitoreo y remediación ambiental y químico industrial . También se utiliza ampliamente en la investigación química.
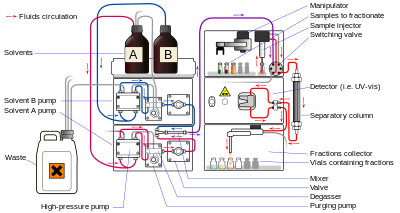
La cromatografía líquida (LC) es una técnica de separación en la que la fase móvil es un líquido. Puede llevarse a cabo en una columna o en un plano. La cromatografía líquida actual, que generalmente utiliza partículas de relleno muy pequeñas y una presión relativamente alta, se denomina cromatografía líquida de alto rendimiento .
En la HPLC, la muestra es forzada por un líquido a alta presión (la fase móvil) a través de una columna que está llena de una fase estacionaria compuesta de partículas de forma irregular o esférica, una capa monolítica porosa o una membrana porosa. Los monolitos son "medios cromatográficos similares a esponjas" [2] y están formados por un bloque interminable de partes orgánicas o inorgánicas. La HPLC se divide históricamente en dos subclases diferentes según la polaridad de las fases móvil y estacionaria. Los métodos en los que la fase estacionaria es más polar que la fase móvil (por ejemplo, tolueno como fase móvil, sílice como fase estacionaria) se denominan cromatografía líquida de fase normal (NPLC) y el opuesto (por ejemplo, mezcla de agua y metanol como fase móvil y C18 (octadecilsililo) como fase estacionaria) se denomina cromatografía líquida de fase inversa (RPLC).
La cromatografía de fluidos supercríticos es una técnica de separación en la que la fase móvil es un fluido situado por encima y relativamente cerca de su temperatura y presión críticas.
A continuación se enumeran técnicas específicas bajo este amplio título.
La cromatografía de afinidad [20] se basa en la interacción selectiva no covalente entre un analito y moléculas específicas. Es muy específica, pero no muy robusta. [21] Se utiliza a menudo en bioquímica en la purificación de proteínas unidas a etiquetas. Estas proteínas de fusión se marcan con compuestos como etiquetas His , biotina o antígenos , que se unen específicamente a la fase estacionaria. Después de la purificación, estas etiquetas suelen eliminarse y se obtiene la proteína pura.
La cromatografía de afinidad a menudo utiliza la afinidad de una biomolécula por los cationes de un metal (Zn, Cu, Fe, etc.). Las columnas suelen prepararse manualmente y pueden diseñarse específicamente para las proteínas de interés. Las columnas de afinidad tradicionales se utilizan como un paso preparatorio para eliminar biomoléculas no deseadas o como un paso primario en el análisis de una proteína con propiedades físicas desconocidas. [22]
Sin embargo, existen técnicas de cromatografía líquida que sí utilizan las propiedades de la cromatografía de afinidad. La cromatografía de afinidad de metales inmovilizados (IMAC) [23] [24] es útil para separar las moléculas mencionadas anteriormente en función de la afinidad relativa por el metal. A menudo, estas columnas se pueden cargar con diferentes metales para crear una columna con una afinidad específica. [25]
La cromatografía de intercambio iónico (generalmente denominada cromatografía iónica) utiliza un mecanismo de intercambio iónico para separar analitos en función de sus respectivas cargas. Por lo general, se realiza en columnas, pero también puede ser útil en modo planar. La cromatografía de intercambio iónico utiliza una fase estacionaria cargada para separar compuestos cargados, incluidos aniones , cationes , aminoácidos , péptidos y proteínas . En los métodos convencionales, la fase estacionaria es una resina de intercambio iónico que lleva grupos funcionales cargados que interactúan con grupos de carga opuesta del compuesto para retener. Hay dos tipos de cromatografía de intercambio iónico: intercambio catiónico e intercambio aniónico. En la cromatografía de intercambio catiónico, la fase estacionaria tiene carga negativa y el ion intercambiable es un catión, mientras que, en la cromatografía de intercambio aniónico, la fase estacionaria tiene carga positiva y el ion intercambiable es un anión. [26] La cromatografía de intercambio iónico se usa comúnmente para purificar proteínas usando FPLC .
La cromatografía de exclusión por tamaño (SEC) también se conoce como cromatografía de permeación en gel (GPC) o cromatografía de filtración en gel y separa las moléculas según su tamaño (o más exactamente según su diámetro hidrodinámico o volumen hidrodinámico). Las moléculas más pequeñas pueden entrar en los poros del medio y, por lo tanto, las moléculas quedan atrapadas y se eliminan del flujo de la fase móvil. El tiempo de residencia promedio en los poros depende del tamaño efectivo de las moléculas del analito. Sin embargo, las moléculas que son más grandes que el tamaño promedio de poro del relleno quedan excluidas y, por lo tanto, no sufren prácticamente ninguna retención; dichas especies son las primeras en eluirse. Generalmente es una técnica de cromatografía de baja resolución y, por lo tanto, a menudo se reserva para el paso final de "pulido" de una purificación. También es útil para determinar la estructura terciaria y la estructura cuaternaria de las proteínas purificadas, especialmente porque se puede llevar a cabo en condiciones de solución nativa.
Una columna de adsorción cromatográfica de lecho expandido (EBA) para un proceso de separación bioquímica comprende un distribuidor de líquido de ecualización de presión que tiene una función de autolimpieza debajo de una placa de tamiz de bloqueo poroso en la parte inferior del lecho expandido, un conjunto de boquillas de la parte superior que tiene una función de limpieza por contraflujo en la parte superior del lecho expandido, una mejor distribución del licor de alimentación añadido al lecho expandido que garantiza que el fluido que pasa a través de la capa de lecho expandido muestra un estado de flujo de pistón. La capa de lecho expandido muestra un estado de flujo de pistón. La columna de separación cromatográfica de lecho expandido tiene ventajas de aumentar la eficiencia de separación del lecho expandido.
La cromatografía de adsorción en lecho expandido (EBA) es una técnica conveniente y eficaz para la captura de proteínas directamente de una muestra cruda no clarificada. En la cromatografía EBA, el lecho sedimentado se expande primero mediante un flujo ascendente de tampón de equilibrio. A continuación, el crudo de alimentación, que es una mezcla de proteínas solubles, contaminantes, células y restos celulares, pasa hacia arriba a través del lecho expandido. Las proteínas objetivo se capturan en el adsorbente, mientras que las partículas y los contaminantes pasan a través de él. Un cambio al tampón de elución mientras se mantiene el flujo ascendente da como resultado la desorción de la proteína objetivo en modo de lecho expandido. Alternativamente, si se invierte el flujo, las partículas adsorbidas se sedimentarán rápidamente y las proteínas se pueden desorber mediante un tampón de elución. El modo utilizado para la elución (lecho expandido o lecho sedimentado) depende de las características de la alimentación. Después de la elución, el adsorbente se limpia con una solución de limpieza in situ (CIP) predefinida, y la limpieza se realiza seguida de la regeneración de la columna (para su uso posterior) o del almacenamiento.
La cromatografía de fase reversa (RPC) es cualquier procedimiento de cromatografía líquida en el que la fase móvil es significativamente más polar que la fase estacionaria. Se denomina así porque en la cromatografía líquida de fase normal, la fase móvil es significativamente menos polar que la fase estacionaria. Las moléculas hidrófobas en la fase móvil tienden a adsorberse a la fase estacionaria relativamente hidrófoba. Las moléculas hidrófilas en la fase móvil tenderán a eluirse primero. Las columnas de separación generalmente comprenden una cadena de carbono C8 o C18 unida a un sustrato de partículas de sílice.
La cromatografía de interacción hidrofóbica (HIC) es una técnica de purificación y análisis que separa analitos, como las proteínas, basándose en interacciones hidrofóbicas entre ese analito y la matriz cromatográfica. Puede proporcionar un enfoque ortogonal no desnaturalizante para la separación en fase inversa, preservando las estructuras nativas y potencialmente la actividad de la proteína. En la cromatografía de interacción hidrofóbica, el material de la matriz se sustituye ligeramente con grupos hidrofóbicos. Estos grupos pueden variar desde grupos metilo, etilo, propilo, butilo, octilo o fenilo. [27] A altas concentraciones de sal, las cadenas laterales no polares en la superficie de las proteínas "interactúan" con los grupos hidrofóbicos; es decir, ambos tipos de grupos son excluidos por el solvente polar (los efectos hidrofóbicos se aumentan con el aumento de la fuerza iónica). Por lo tanto, la muestra se aplica a la columna en un tampón que es altamente polar, lo que impulsa una asociación de parches hidrofóbicos en el analito con la fase estacionaria. El eluyente suele ser un tampón acuoso con concentraciones de sal decrecientes, concentraciones crecientes de detergente (que altera las interacciones hidrofóbicas) o cambios en el pH. El tipo de sal utilizado es de importancia crítica, ya que las sales más cosmotrópicas , según se define en la serie de Hofmeister, proporcionan la mayor estructuración de agua alrededor de la molécula y la presión hidrofóbica resultante. El sulfato de amonio se utiliza con frecuencia para este propósito. La adición de disolventes orgánicos u otros componentes menos polares puede ayudar a mejorar la resolución.
En general, la cromatografía de interacción hidrofóbica (HIC) es ventajosa si la muestra es sensible a los cambios de pH o a los disolventes agresivos que se utilizan normalmente en otros tipos de cromatografía, pero no a las altas concentraciones de sal. Normalmente, lo que varía es la cantidad de sal en el tampón. En 2012, Müller y Franzreb describieron los efectos de la temperatura en la HIC utilizando albúmina de suero bovino (BSA) con cuatro tipos diferentes de resina hidrofóbica. El estudio alteró la temperatura para afectar la afinidad de unión de la BSA sobre la matriz. Se concluyó que el ciclo de temperatura de 40 a 10 grados Celsius no sería adecuado para lavar eficazmente toda la BSA de la matriz, pero podría ser muy eficaz si la columna solo se utilizara unas pocas veces. [28] El uso de la temperatura para efectuar el cambio permite a los laboratorios reducir los costos de compra de sal y ahorrar dinero.
Si se quieren evitar las altas concentraciones de sal junto con las fluctuaciones de temperatura, se puede utilizar un método más hidrófobo para competir con la muestra y eluirla. Este método de HIC, denominado independiente de la sal, mostró un aislamiento directo de inmunoglobulina G humana (IgG) del suero con un rendimiento satisfactorio y utilizó β-ciclodextrina como competidor para desplazar a la IgG de la matriz. [29] Esto abre en gran medida la posibilidad de utilizar HIC con muestras sensibles a la sal, ya que sabemos que las altas concentraciones de sal precipitan las proteínas.
La cromatografía hidrodinámica (HDC) se deriva del fenómeno observado de que las gotas grandes se mueven más rápido que las pequeñas. [30] En una columna, esto sucede porque se evita que el centro de masa de las gotas más grandes esté tan cerca de los lados de la columna como las gotas más pequeñas debido a su mayor tamaño general. [31] Las gotas más grandes se eluirán primero desde el medio de la columna, mientras que las gotas más pequeñas se adhieren a los lados de la columna y eluyen al final. Esta forma de cromatografía es útil para separar analitos por masa molar (o masa molecular), tamaño, forma y estructura cuando se usa junto con detectores de dispersión de luz , viscosímetros y refractómetros . [32] Los dos tipos principales de HDC son el tubo abierto y la columna empaquetada . El tubo abierto ofrece tiempos de separación rápidos para partículas pequeñas, mientras que la HDC de columna empaquetada puede aumentar la resolución y es más adecuada para partículas con una masa molecular promedio mayor que daltons . [33] La HDC se diferencia de otros tipos de cromatografía porque la separación solo tiene lugar en el volumen intersticial, que es el volumen que rodea y se encuentra entre las partículas en una columna empaquetada. [34]
La HDC comparte el mismo orden de elución que la cromatografía de exclusión por tamaño (SEC), pero los dos procesos aún varían de muchas maneras. [33] En un estudio que compara los dos tipos de separación, Isenberg, Brewer, Côté y Striegel utilizan ambos métodos para la caracterización de polisacáridos y concluyen que la HDC acoplada con la dispersión de luz multiángulo (MALS) logra una distribución de masa molar más precisa en comparación con la MALS fuera de línea que la SEC en un tiempo significativamente menor. [35] Esto se debe en gran medida a que la SEC es una técnica más destructiva debido a que los poros en la columna degradan el analito durante la separación, lo que tiende a afectar la distribución de masa. [35] Sin embargo, la principal desventaja de la HDC es la baja resolución de los picos de analito, lo que hace que la SEC sea una opción más viable cuando se usa con productos químicos que no son fácilmente degradables y donde la elución rápida no es importante. [36]
HDC juega un papel especialmente importante en el campo de la microfluídica . El primer aparato exitoso para el sistema HDC-on-a-chip fue propuesto por Chmela, et al. en 2002. [37] Su diseño fue capaz de lograr separaciones utilizando un canal de 80 mm de largo en la escala de tiempo de 3 minutos para partículas con diámetros que van desde 26 a 110 nm, pero los autores expresaron la necesidad de mejorar los parámetros de retención y dispersión . [37] En una publicación de 2010 de Jellema, Markesteijn, Westerweel y Verpoorte, la implementación de HDC con un flujo bidireccional recirculante dio como resultado una separación basada en el tamaño de alta resolución con solo un canal de 3 mm de largo. [38] Tener un canal tan corto y una alta resolución se consideró especialmente impresionante considerando que los estudios anteriores utilizaron canales de 80 mm de longitud. [37] Para una aplicación biológica, en 2007, Huh, et al. Propusieron un dispositivo de clasificación microfluídica basado en HDC y gravedad, que fue útil para evitar que partículas potencialmente peligrosas con un diámetro mayor a 6 micrones ingresaran al torrente sanguíneo al inyectar agentes de contraste en ultrasonidos . [39] Este estudio también generó avances para la sustentabilidad ambiental en microfluídica debido a la falta de electrónica externa que impulse el flujo, lo que resultó ser una ventaja de usar un dispositivo basado en la gravedad.

En algunos casos, la selectividad proporcionada por el uso de una columna puede ser insuficiente para proporcionar resolución de analitos en muestras complejas. La cromatografía bidimensional tiene como objetivo aumentar la resolución de estos picos mediante el uso de una segunda columna con diferentes propiedades fisicoquímicas ( clasificación química ). [40] [41] Dado que el mecanismo de retención en este nuevo soporte sólido es diferente de la separación en primera dimensión, puede ser posible separar compuestos mediante cromatografía bidimensional que son indistinguibles mediante cromatografía unidimensional. Además, la separación en la segunda dimensión ocurre más rápido que en la primera dimensión. [40] Un ejemplo de una separación TDC es cuando la muestra se coloca en una esquina de una placa cuadrada, se revela, se seca al aire, luego se gira 90° y, por lo general, se vuelve a revelar en un segundo sistema de solvente.
La cromatografía bidimensional se puede aplicar a las separaciones GC o LC. [40] [41] El enfoque de corte central selecciona una región específica de interés en la primera dimensión para la separación, [42] y el enfoque integral utiliza todos los analitos en la separación de segunda dimensión. [40] [41]
La técnica de lecho móvil simulado (SMB) es una variante de la cromatografía líquida de alto rendimiento; se utiliza para separar partículas y/o compuestos químicos que serían difíciles o imposibles de resolver de otra manera. Esta mayor separación se logra mediante una disposición de válvulas y columnas que se utiliza para alargar la fase estacionaria indefinidamente. En la técnica de lecho móvil de la cromatografía preparativa, la entrada de la alimentación y la recuperación del analito son simultáneas y continuas, pero debido a las dificultades prácticas con un lecho en movimiento continuo, se propuso la técnica de lecho móvil simulado. En la técnica de lecho móvil simulado, en lugar de mover el lecho, las posiciones de entrada de la muestra y de salida del analito se mueven continuamente, dando la impresión de un lecho móvil. La cromatografía de lecho móvil real (TMBC) es solo un concepto teórico. Su simulación, SMBC, se logra mediante el uso de una multiplicidad de columnas en serie y una disposición compleja de válvulas. Esta disposición de válvulas permite la alimentación de muestra y solvente y la extracción de analito y desechos en ubicaciones apropiadas de cualquier columna, lo que permite cambiar a intervalos regulares la entrada de muestra en una dirección, la entrada de solvente en la dirección opuesta, mientras que también se cambian las posiciones de extracción de analito y desechos de manera adecuada.
La pirólisis-cromatografía de gases-espectrometría de masas es un método de análisis químico en el que la muestra se calienta hasta su descomposición para producir moléculas más pequeñas que se separan mediante cromatografía de gases y se detectan mediante espectrometría de masas.
La pirólisis es la descomposición térmica de materiales en una atmósfera inerte o al vacío. La muestra se pone en contacto directo con un alambre de platino o se coloca en un tubo de muestra de cuarzo y se calienta rápidamente a 600–1000 °C. Dependiendo de la aplicación, se utilizan temperaturas incluso más altas. En los pirolizadores reales se utilizan tres técnicas de calentamiento diferentes: horno isotérmico, calentamiento inductivo (filamento de punto de Curie) y calentamiento resistivo utilizando filamentos de platino. Las moléculas grandes se escinden en sus puntos más débiles y producen fragmentos más pequeños y volátiles. Estos fragmentos se pueden separar mediante cromatografía de gases. Los cromatogramas de GC de pirólisis suelen ser complejos porque se forma una amplia gama de diferentes productos de descomposición. Los datos se pueden utilizar como huellas dactilares para demostrar la identidad del material o los datos de GC/MS se utilizan para identificar fragmentos individuales para obtener información estructural. Para aumentar la volatilidad de los fragmentos polares, se pueden agregar varios reactivos de metilación a una muestra antes de la pirólisis.
Además del uso de pirolizadores dedicados, la GC de pirólisis de muestras sólidas y líquidas se puede realizar directamente dentro de los inyectores de vaporizador de temperatura programable (PTV) que proporcionan un calentamiento rápido (hasta 30 °C/s) y altas temperaturas máximas de 600–650 °C. Esto es suficiente para algunas aplicaciones de pirólisis. La principal ventaja es que no se debe comprar ningún instrumento dedicado y la pirólisis se puede realizar como parte del análisis de GC de rutina. En este caso, se deben utilizar revestimientos de entrada de cuarzo para GC. Se pueden adquirir datos cuantitativos y también se publican buenos resultados de derivatización dentro del inyector PTV.
La cromatografía líquida rápida de proteínas (FPLC) es una forma de cromatografía líquida que se utiliza a menudo para analizar o purificar mezclas de proteínas. Como en otras formas de cromatografía, la separación es posible porque los diferentes componentes de una mezcla tienen diferentes afinidades por dos materiales, un fluido en movimiento (la "fase móvil") y un sólido poroso (la fase estacionaria). En la FPLC, la fase móvil es una solución acuosa o "tampón". El caudal del tampón se controla mediante una bomba de desplazamiento positivo y normalmente se mantiene constante, mientras que la composición del tampón se puede variar extrayendo fluidos en diferentes proporciones de dos o más depósitos externos. La fase estacionaria es una resina compuesta de perlas, normalmente de agarosa reticulada , empaquetadas en una columna cilíndrica de vidrio o plástico. Las resinas FPLC están disponibles en una amplia gama de tamaños de perlas y ligandos de superficie según la aplicación.
La cromatografía en contracorriente (CCC) es un tipo de cromatografía líquido-líquido, donde tanto la fase estacionaria como la móvil son líquidas y la fase estacionaria líquida se mantiene estancada por una fuerte fuerza centrífuga. [43]
El principio de funcionamiento del instrumento CCC requiere una columna que consiste en un tubo abierto enrollado alrededor de una bobina. La bobina gira en un movimiento giratorio de doble eje (cardioide), lo que hace que un campo de gravedad (G) variable actúe sobre la columna durante cada rotación. Este movimiento hace que la columna experimente un paso de partición por revolución y los componentes de la muestra se separen en la columna debido a su coeficiente de partición entre las dos fases líquidas inmiscibles utilizadas. Hay muchos tipos de CCC disponibles en la actualidad. Estos incluyen HSCCC (CCC de alta velocidad) y HPCCC (CCC de alto rendimiento). HPCCC es la versión más reciente y de mejor rendimiento de la instrumentación disponible actualmente.
En el instrumento CPC (cromatografía de partición centrífuga o cromatografía hidrostática en contracorriente), la columna consta de una serie de celdas interconectadas por conductos unidos a un rotor. Este rotor gira sobre su eje central creando el campo centrífugo necesario para mantener la fase estacionaria en su lugar. El proceso de separación en CPC está regido únicamente por la partición de solutos entre las fases estacionaria y móvil, cuyo mecanismo se puede describir fácilmente utilizando los coeficientes de partición ( K D ) de solutos. Los instrumentos CPC están disponibles comercialmente para separaciones a escala de laboratorio, piloto e industrial con diferentes tamaños de columnas que van desde unos 10 mililitros hasta 10 litros de volumen.
A diferencia de la cromatografía de contracorriente (ver arriba), la cromatografía periódica de contracorriente (PCC) utiliza una fase estacionaria sólida y solo una fase móvil líquida. Por lo tanto, es mucho más similar a la cromatografía de afinidad convencional que a la cromatografía de contracorriente. La PCC utiliza múltiples columnas, que durante la fase de carga están conectadas en línea. Este modo permite sobrecargar la primera columna de esta serie sin perder producto, que ya atraviesa la columna antes de que la resina esté completamente saturada. El producto que se rompe se captura en la(s) columna(s) siguiente(s). En un paso siguiente, las columnas se desconectan entre sí. La primera columna se lava y se eluye, mientras que las otras columnas aún se están cargando. Una vez que la (inicialmente) primera columna se vuelve a equilibrar, se vuelve a introducir en la corriente de carga, pero como última columna. Luego, el proceso continúa de manera cíclica.
La cromatografía quiral implica la separación de estereoisómeros . En el caso de los enantiómeros, estos no tienen diferencias químicas ni físicas aparte de ser imágenes especulares tridimensionales. Para que se produzcan las separaciones quirales, tanto la fase móvil como la estacionaria deben hacerse quirales, lo que da lugar a diferentes afinidades entre los analitos. Las columnas de cromatografía quiral HPLC (con una fase estacionaria quiral) tanto en fase normal como en fase reversa están disponibles comercialmente.
La cromatografía convencional no es capaz de separar mezclas racémicas de enantiómeros. Sin embargo, en algunos casos, las mezclas no racémicas de enantiómeros pueden separarse inesperadamente mediante cromatografía líquida convencional (por ejemplo, HPLC sin fase móvil o fase estacionaria quiral). [44] [45]
La cromatografía acuosa en fase normal (ANP) se caracteriza por el comportamiento de elución del modo de fase normal clásico (es decir, donde la fase móvil es significativamente menos polar que la fase estacionaria) en el que el agua es uno de los componentes del sistema de disolventes de la fase móvil. Se distingue de la cromatografía líquida de interacción hidrofílica (HILIC) en que el mecanismo de retención se debe a la adsorción en lugar de a la partición. [46]
La cromatografía se utiliza en muchos campos, incluida la industria farmacéutica , la industria de alimentos y bebidas , la industria química , la ciencia forense , el análisis ambiental y los hospitales . [47]