
Un elemento químico es una sustancia química que no se puede descomponer en otras sustancias mediante reacciones químicas . La partícula básica que constituye un elemento químico es el átomo . Los elementos se identifican por el número de protones en su núcleo, [1] conocido como el número atómico del elemento . [2] Por ejemplo, el oxígeno tiene un número atómico de 8, lo que significa que cada átomo de oxígeno tiene 8 protones en su núcleo. Los átomos del mismo elemento pueden tener diferentes números de neutrones en sus núcleos, conocidos como isótopos del elemento. Dos o más átomos pueden combinarse para formar moléculas . Los compuestos químicos son moléculas hechas de átomos de diferentes elementos, mientras que las mezclas contienen átomos de diferentes elementos no necesariamente combinados como moléculas. Los átomos pueden transformarse en diferentes elementos en reacciones nucleares , que cambian el número atómico de un átomo.
Casi toda la materia bariónica del universo está compuesta de elementos (entre las raras excepciones se encuentran las estrellas de neutrones ). Cuando diferentes elementos experimentan reacciones químicas, los átomos se reorganizan en nuevos compuestos que se mantienen unidos por enlaces químicos . Solo unos pocos elementos, como la plata y el oro , se encuentran sin combinar como minerales elementales nativos relativamente puros . Casi todos los demás elementos naturales se encuentran en la Tierra como compuestos o mezclas. El aire es principalmente una mezcla de nitrógeno molecular y oxígeno , aunque contiene compuestos que incluyen dióxido de carbono y agua , así como argón atómico , un gas noble que es químicamente inerte y, por lo tanto, no experimenta reacciones químicas.
La historia del descubrimiento y uso de los elementos comenzó con las primeras sociedades humanas que descubrieron minerales nativos como el carbono , el azufre , el cobre y el oro (aunque el concepto moderno de elemento aún no se entendía). Los intentos de clasificar materiales como estos dieron como resultado los conceptos de elementos clásicos , alquimia y teorías similares a lo largo de la historia. Gran parte de la comprensión moderna de los elementos se desarrolló a partir del trabajo de Dmitri Mendeleev , un químico ruso que publicó la primera tabla periódica reconocible en 1869. Esta tabla organiza los elementos aumentando el número atómico en filas (" períodos ") en las que las columnas (" grupos ") comparten propiedades físicas y químicas recurrentes ("periódicas") . La tabla periódica resume varias propiedades de los elementos, lo que permite a los químicos derivar relaciones entre ellos y hacer predicciones sobre elementos aún no descubiertos y posibles nuevos compuestos.
En noviembre de 2016, la Unión Internacional de Química Pura y Aplicada (IUPAC) había reconocido un total de 118 elementos. Los primeros 94 se encuentran de forma natural en la Tierra y los 24 restantes son elementos sintéticos producidos en reacciones nucleares. A excepción de los elementos radiactivos inestables (radioelementos) que se desintegran rápidamente, casi todos los elementos están disponibles industrialmente en cantidades variables. El descubrimiento y la síntesis de nuevos elementos es un área de estudio científico en curso.
Los elementos más ligeros son el hidrógeno y el helio , ambos creados por la nucleosíntesis del Big Bang en los primeros 20 minutos del universo [3] en una proporción de alrededor de 3:1 en masa (o 12:1 en número de átomos), [4] [5] junto con pequeños rastros de los siguientes dos elementos, litio y berilio . Casi todos los demás elementos encontrados en la naturaleza se crearon mediante varios métodos naturales de nucleosíntesis . [6] En la Tierra, pequeñas cantidades de nuevos átomos se producen naturalmente en reacciones nucleogénicas o en procesos cosmogénicos , como la espalación de rayos cósmicos . También se producen naturalmente nuevos átomos en la Tierra como isótopos hijos radiogénicos de procesos de desintegración radiactiva en curso, como la desintegración alfa , la desintegración beta , la fisión espontánea , la desintegración en cúmulos y otros modos de desintegración más raros.
De los 94 elementos naturales, aquellos con números atómicos del 1 al 82 tienen cada uno al menos un isótopo estable (excepto el tecnecio , elemento 43 y el prometio , elemento 61, que no tienen isótopos estables). Los isótopos considerados estables son aquellos para los que aún no se ha observado desintegración radiactiva. Los elementos con números atómicos del 83 al 94 son inestables hasta el punto de que se puede detectar la desintegración radiactiva de todos los isótopos. Algunos de estos elementos, en particular el bismuto (número atómico 83), el torio (número atómico 90) y el uranio (número atómico 92), tienen uno o más isótopos con vidas medias lo suficientemente largas como para sobrevivir como restos de la nucleosíntesis estelar explosiva que produjo los metales pesados antes de la formación de nuestro Sistema Solar . Con más de 1,9 × 10Con 19 años, más de mil millones de veces más que la edad estimada del universo, el bismuto-209 tiene la vida media de desintegración alfa más larga conocida de cualquier isótopo, y casi siempre se considera a la par de los 80 elementos estables. [7] [8] Los elementos más pesados (aquellos más allá del plutonio, elemento 94) sufren desintegración radiactiva con vidas medias tan cortas que no se encuentran en la naturaleza y deben sintetizarse .
En la actualidad se conocen 118 elementos. En este contexto, "conocido" significa observado lo suficientemente bien, incluso a partir de unos pocos productos de desintegración, como para haber sido diferenciado de otros elementos. [9] [10] Más recientemente, la síntesis del elemento 118 (desde entonces llamado oganesón ) se informó en octubre de 2006, y la síntesis del elemento 117 ( tennessina ) se informó en abril de 2010. [11] [12] De estos 118 elementos, 94 se producen de forma natural en la Tierra. Seis de ellos se encuentran en cantidades traza extremas: tecnecio , número atómico 43; prometio , número 61; astato , número 85; francio , número 87; neptunio , número 93; y plutonio , número 94. Estos 94 elementos se han detectado en el universo en general, en los espectros de estrellas y también en supernovas, donde se están creando nuevos elementos radiactivos de vida corta. Los primeros 94 elementos han sido detectados directamente en la Tierra como nucleidos primordiales presentes desde la formación del Sistema Solar , o como productos naturales de fisión o transmutación de uranio y torio.
Los 24 elementos más pesados restantes, que no se encuentran hoy en día ni en la Tierra ni en los espectros astronómicos, se han producido artificialmente: todos son radiactivos, con vidas medias cortas; si alguno de estos elementos estaba presente en la formación de la Tierra, es seguro que se desintegró por completo, y si está presente en las novas, está en cantidades demasiado pequeñas para haber sido detectadas. El tecnecio fue el primer elemento supuestamente no natural sintetizado, en 1937, aunque desde entonces se han encontrado trazas de tecnecio en la naturaleza (y también es posible que el elemento haya sido descubierto de forma natural en 1925). [13] Este patrón de producción artificial y posterior descubrimiento natural se ha repetido con varios otros elementos raros radiactivos de origen natural. [14]
La lista de elementos está disponible por nombre, número atómico, densidad, punto de fusión, punto de ebullición y símbolo químico , así como por energía de ionización . Los nucleidos de elementos estables y radiactivos también están disponibles como una lista de nucleidos , ordenados por longitud de vida media para aquellos que son inestables. Una de las presentaciones más convenientes, y ciertamente la más tradicional de los elementos, es en forma de tabla periódica, que agrupa elementos con propiedades químicas similares (y generalmente también estructuras electrónicas similares).
El número atómico de un elemento es igual al número de protones en cada átomo y define el elemento. [15] Por ejemplo, todos los átomos de carbono contienen 6 protones en su núcleo atómico ; por lo que el número atómico del carbono es 6. [16] Los átomos de carbono pueden tener diferentes números de neutrones; los átomos del mismo elemento que tienen diferentes números de neutrones se conocen como isótopos del elemento. [17]
El número de protones en el núcleo también determina su carga eléctrica , que a su vez determina el número de electrones del átomo en su estado no ionizado . Los electrones se colocan en orbitales atómicos que determinan las propiedades químicas del átomo . El número de neutrones en un núcleo generalmente tiene muy poco efecto en las propiedades químicas de un elemento; excepto para el hidrógeno (para el cual el efecto isotópico cinético es significativo). Por lo tanto, todos los isótopos de carbono tienen propiedades químicas casi idénticas porque todos tienen seis electrones, aunque puedan tener de 6 a 8 neutrones. Es por eso que el número atómico, en lugar del número másico o el peso atómico , se considera la característica identificativa de un elemento.
El símbolo del número atómico es Z.
Los isótopos son átomos de un mismo elemento (es decir, con el mismo número de protones en su núcleo), pero que tienen diferente número de neutrones . Así, por ejemplo, hay tres isótopos principales del carbono. Todos los átomos de carbono tienen 6 protones, pero pueden tener indistintamente 6, 7 u 8 neutrones. Como los números másicos de estos son 12, 13 y 14 respectivamente, dichos tres isótopos se conocen como carbono-12 , carbono-13 y carbono-14 ( 12 C, 13 C y 14 C). El carbono natural es una mezcla de 12 C (alrededor del 98,9 %), 13 C (alrededor del 1,1 %) y aproximadamente 1 átomo por billón de 14 C.
La mayoría de los elementos naturales (66 de 94) tienen más de un isótopo estable. A excepción de los isótopos del hidrógeno (que difieren mucho entre sí en masa relativa, lo suficiente como para causar efectos químicos), los isótopos de un elemento determinado son químicamente casi indistinguibles.
Todos los elementos tienen isótopos radiactivos (radioisótopos); la mayoría de estos radioisótopos no se producen de forma natural. Los radioisótopos suelen desintegrarse en otros elementos mediante desintegración alfa , desintegración beta o desintegración beta inversa ; algunos isótopos de los elementos más pesados también sufren fisión espontánea . Los isótopos que no son radiactivos se denominan isótopos "estables". Todos los isótopos estables conocidos se producen de forma natural (véase nucleido primordial ). Los numerosos radioisótopos que no se encuentran en la naturaleza se han caracterizado tras ser producidos artificialmente. Ciertos elementos no tienen isótopos estables y están compuestos únicamente de radioisótopos: en concreto, los elementos sin ningún isótopo estable son el tecnecio (número atómico 43), el prometio (número atómico 61) y todos los elementos observados con número atómico superior a 82.
De los 80 elementos con al menos un isótopo estable, 26 tienen solo un isótopo estable. El número medio de isótopos estables para los 80 elementos estables es de 3,1 isótopos estables por elemento. El mayor número de isótopos estables para un solo elemento es 10 (para el estaño , elemento 50).
El número másico de un elemento, A , es el número de nucleones (protones y neutrones) en el núcleo atómico. Los diferentes isótopos de un elemento determinado se distinguen por su número másico, que se escribe como un superíndice en el lado izquierdo del símbolo químico (por ejemplo, 238 U). El número másico es siempre un número entero y tiene unidades de "nucleones". Por lo tanto, el magnesio-24 (24 es el número másico) es un átomo con 24 nucleones (12 protones y 12 neutrones).
Mientras que el número másico simplemente cuenta el número total de neutrones y protones y, por lo tanto, es un número entero, la masa atómica de un isótopo particular (o "nucleido") del elemento es la masa de un solo átomo de ese isótopo, y generalmente se expresa en daltons (símbolo: Da), o unidades de masa atómica universal (símbolo: u). Su masa atómica relativa es un número adimensional igual a la masa atómica dividida por la constante de masa atómica , que es igual a 1 Da. En general, el número másico de un nucleido dado difiere en valor ligeramente de su masa atómica relativa, ya que la masa de cada protón y neutrón no es exactamente 1 Da; ya que los electrones contribuyen en menor medida a la masa atómica a medida que el número de neutrones excede al número de protones; y debido a la energía de enlace nuclear y la energía de enlace de electrones. Por ejemplo, la masa atómica del cloro-35 con cinco dígitos significativos es 34,969 Da y la del cloro-37 es 36,966 Da. Sin embargo, la masa atómica relativa de cada isótopo es bastante cercana a su número másico (siempre dentro del 1%). El único isótopo cuya masa atómica es exactamente un número natural es el 12 C, que tiene una masa de 12 Da; porque el dalton se define como 1/12 de la masa de un átomo de carbono-12 libre y neutro en el estado fundamental.
El peso atómico estándar (comúnmente llamado "peso atómico") de un elemento es el promedio de las masas atómicas de todos los isótopos del elemento químico que se encuentran en un entorno particular, ponderados por la abundancia isotópica, en relación con la unidad de masa atómica. Este número puede ser una fracción que no se acerque a un número entero. Por ejemplo, la masa atómica relativa del cloro es 35,453 u, que difiere mucho de un número entero, ya que es un promedio de aproximadamente 76% de cloro-35 y 24% de cloro-37. Siempre que un valor de masa atómica relativa difiere en más de ~1% de un número entero, se debe a este efecto de promediado, ya que cantidades significativas de más de un isótopo están presentes de forma natural en una muestra de ese elemento.
Los químicos y los científicos nucleares tienen definiciones diferentes de un elemento puro . En química, un elemento puro significa una sustancia cuyos átomos, todos (o en la práctica casi todos) tienen el mismo número atómico o número de protones . Los científicos nucleares, sin embargo, definen un elemento puro como uno que consiste en un solo isótopo. [18]
Por ejemplo, un alambre de cobre es químicamente puro al 99,99% si el 99,99% de sus átomos son de cobre, con 29 protones cada uno. Sin embargo, no es isotópicamente puro, ya que el cobre ordinario consta de dos isótopos estables, 69% 63 Cu y 31% 65 Cu, con diferentes números de neutrones. Sin embargo, el oro puro sería tanto química como isotópicamente puro, ya que el oro ordinario consta solo de un isótopo, 197 Au.
Los átomos de elementos químicamente puros pueden unirse entre sí químicamente de más de una manera, lo que permite que el elemento puro exista en múltiples estructuras químicas ( disposiciones espaciales de átomos ), conocidas como alótropos , que difieren en sus propiedades. Por ejemplo, el carbono se puede encontrar como diamante , que tiene una estructura tetraédrica alrededor de cada átomo de carbono; grafito , que tiene capas de átomos de carbono con una estructura hexagonal apiladas una sobre otra; grafeno , que es una sola capa de grafito que es muy fuerte; fulerenos , que tienen formas casi esféricas; y nanotubos de carbono , que son tubos con una estructura hexagonal (incluso estos pueden diferir entre sí en propiedades eléctricas). La capacidad de un elemento de existir en una de muchas formas estructurales se conoce como 'alotropía'.
El estado de referencia de un elemento se define por convención, generalmente como el alótropo termodinámicamente más estable y el estado físico a una presión de 1 bar y una temperatura dada (normalmente a 298,15 K). Sin embargo, para el fósforo, el estado de referencia es el fósforo blanco aunque no sea el alótropo más estable, y el estado de referencia para el carbono es el grafito, porque la estructura del grafito es más estable que la de los otros alótropos. En termoquímica , se define que un elemento tiene una entalpía de formación de cero en su estado de referencia.
Se pueden aplicar ampliamente varios tipos de categorizaciones descriptivas a los elementos, incluida la consideración de sus propiedades físicas y químicas generales, sus estados de la materia en condiciones familiares, sus puntos de fusión y ebullición, sus densidades, sus estructuras cristalinas como sólidos y sus orígenes.
Se utilizan varios términos para caracterizar las propiedades físicas y químicas generales de los elementos químicos. Una primera distinción es entre metales , que conducen fácilmente la electricidad , no metales , que no lo hacen, y un pequeño grupo (los metaloides ), que tienen propiedades intermedias y a menudo se comportan como semiconductores .
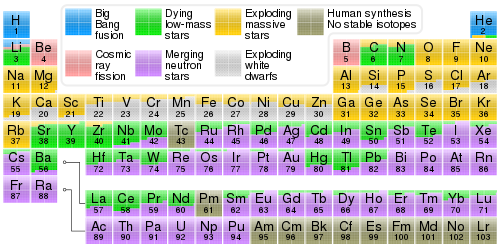
Una clasificación más refinada se muestra a menudo en presentaciones en color de la tabla periódica. Este sistema restringe los términos "metal" y "no metal" a solo algunos de los metales y no metales definidos de manera más amplia, agregando términos adicionales para ciertos conjuntos de metales y no metales considerados de manera más amplia. La versión de esta clasificación utilizada en las tablas periódicas presentadas aquí incluye: actínidos , metales alcalinos , metales alcalinotérreos , halógenos , lantánidos , metales de transición , metales post-transición , metaloides , no metales reactivos y gases nobles . En este sistema, los metales alcalinos, los metales alcalinotérreos y los metales de transición, así como los lantánidos y los actínidos, son grupos especiales de los metales vistos en un sentido más amplio. De manera similar, los no metales reactivos y los gases nobles son no metales vistos en un sentido más amplio. En algunas presentaciones, los halógenos no se distinguen, y el astato se identifica como un metaloide y los demás como no metales.
Otra distinción básica que se utiliza con frecuencia entre los elementos es su estado de materia (fase), ya sea sólido , líquido o gaseoso , a temperatura y presión estándar (STP). La mayoría de los elementos son sólidos a STP, mientras que varios son gases. Solo el bromo y el mercurio son líquidos a 0 grados Celsius (32 grados Fahrenheit) y 1 atmósfera de presión; el cesio y el galio son sólidos a esa temperatura, pero se funden a 28,4 °C (83,2 °F) y 29,8 °C (85,6 °F), respectivamente.
Los puntos de fusión y ebullición , expresados normalmente en grados Celsius a una presión de una atmósfera, se utilizan habitualmente para caracterizar los distintos elementos. Si bien se conocen para la mayoría de los elementos, una o ambas de estas medidas aún no se han determinado para algunos de los elementos radiactivos disponibles solo en cantidades minúsculas. Dado que el helio sigue siendo líquido incluso en el cero absoluto a presión atmosférica, solo tiene un punto de ebullición, y no un punto de fusión, en las presentaciones convencionales.
La densidad a una determinada temperatura y presión estándar (STP) se utiliza a menudo para caracterizar los elementos. La densidad suele expresarse en gramos por centímetro cúbico (g/cm3 ) . Dado que varios elementos son gases a temperaturas que se encuentran habitualmente, sus densidades suelen indicarse para sus formas gaseosas; cuando se licúan o solidifican, los elementos gaseosos tienen densidades similares a las de los demás elementos.
Cuando un elemento tiene alótropos con diferentes densidades, normalmente se selecciona un alótropo representativo en las presentaciones resumidas, mientras que las densidades de cada alótropo se pueden indicar cuando se proporcionan más detalles. Por ejemplo, los tres alótropos conocidos del carbono ( carbono amorfo , grafito y diamante ) tienen densidades de 1,8–2,1, 2,267 y 3,515 g/cm 3 , respectivamente.
Los elementos estudiados hasta la fecha como muestras sólidas tienen ocho tipos de estructuras cristalinas : cúbica , cúbica centrada en el cuerpo , cúbica centrada en las caras, hexagonal , monoclínica , ortorrómbica , romboédrica y tetragonal . En el caso de algunos de los elementos transuránicos producidos sintéticamente, las muestras disponibles han sido demasiado pequeñas para determinar las estructuras cristalinas.
Los elementos químicos también pueden clasificarse por su origen en la Tierra: los primeros 94 se consideran naturales, mientras que aquellos con números atómicos superiores a 94 solo se han producido artificialmente mediante reacciones nucleares provocadas por el hombre.
De los 94 elementos naturales, 83 se consideran primordiales y estables o débilmente radiactivos. Los isótopos de vida más larga de los 11 elementos restantes tienen vidas medias demasiado cortas para que hayan estado presentes al comienzo del Sistema Solar y, por lo tanto, se consideran elementos transitorios. De estos 11 elementos transitorios, cinco ( polonio , radón , radio , actinio y protactinio ) son productos de desintegración relativamente comunes del torio y el uranio . Los seis elementos transitorios restantes (tecnecio, prometio, astato, francio , neptunio y plutonio ) aparecen solo raramente, como productos de modos de desintegración raros o procesos de reacción nuclear que involucran uranio u otros elementos pesados.
Los elementos con números atómicos del 1 al 82, excepto el 43 (tecnecio) y el 61 (prometio), tienen cada uno al menos un isótopo para el cual no se ha observado desintegración radiactiva. Sin embargo, se predice que los isótopos observacionalmente estables de algunos elementos (como el tungsteno y el plomo ) son ligeramente radiactivos con vidas medias muy largas: [19] por ejemplo, las vidas medias predichas para los isótopos observacionalmente estables del plomo varían de 10 35 a 10 189 años. Los elementos con números atómicos 43, 61 y 83 a 94 son lo suficientemente inestables como para que se pueda detectar su desintegración radiactiva. Tres de estos elementos, el bismuto (elemento 83), el torio (90) y el uranio (92) tienen uno o más isótopos con vidas medias lo suficientemente largas como para sobrevivir como restos de la nucleosíntesis estelar explosiva que produjo los elementos pesados antes de la formación del Sistema Solar. Por ejemplo, con más de 1,9 × 10Con 19 años, más de mil millones de veces más que la edad estimada del universo, el bismuto-209 tiene lavida media de desintegración alfa más larga conocida de todos los isótopos. [7] [8] Los últimos 24 elementos (aquellos más allá del plutonio, elemento 94) sufren desintegración radiactiva con vidas medias cortas y no pueden producirse como hijos de elementos de vida más larga, por lo que no se sabe que existan en la naturaleza.
Las propiedades de los elementos suelen resumirse mediante la tabla periódica, que organiza de forma elegante y potente los elementos en filas ( «períodos» ) de orden creciente según su número atómico, en las que las columnas ( «grupos» ) comparten propiedades físicas y químicas recurrentes («periódicas»). La tabla contiene 118 elementos confirmados a fecha de 2021.
Aunque existen precursores anteriores de esta presentación, su invención se atribuye generalmente al químico ruso Dmitri Mendeleev en 1869, quien pretendía que la tabla ilustrara tendencias recurrentes en las propiedades de los elementos. El diseño de la tabla se ha ido perfeccionando y ampliando con el tiempo a medida que se han descubierto nuevos elementos y se han desarrollado nuevos modelos teóricos para explicar el comportamiento químico.
El uso de la tabla periódica es ahora omnipresente en la química, y proporciona un marco extremadamente útil para clasificar, sistematizar y comparar todas las diferentes formas de comportamiento químico. La tabla también ha encontrado una amplia aplicación en física , geología , biología , ciencia de los materiales , ingeniería , agricultura , medicina , nutrición , salud ambiental y astronomía . Sus principios son especialmente importantes en ingeniería química .
Los diversos elementos químicos se identifican formalmente por sus números atómicos únicos, sus nombres aceptados y sus símbolos químicos .
Los elementos conocidos tienen números atómicos del 1 al 118, que se presentan convencionalmente como números arábigos . Dado que los elementos se pueden ordenar de forma única por número atómico, convencionalmente del más bajo al más alto (como en una tabla periódica), los conjuntos de elementos a veces se especifican mediante notaciones como "a través de", "más allá de" o "desde... a través de", como en "a través del hierro", "más allá del uranio" o "desde el lantano hasta el lutecio". Los términos "ligero" y "pesado" a veces también se usan informalmente para indicar números atómicos relativos (no densidades), como en "más ligero que el carbono" o "más pesado que el plomo", aunque las masas atómicas de los elementos (sus pesos atómicos o masas atómicas) no siempre aumentan monótonamente con sus números atómicos.
La denominación de las diversas sustancias que hoy conocemos como elementos precede a la teoría atómica de la materia, ya que las distintas culturas daban nombres a los minerales, metales, compuestos, aleaciones, mezclas y otros materiales, aunque en aquella época no se sabía qué sustancias químicas eran elementos y cuáles compuestos. Como se identificaban como elementos, en la mayoría de los países se mantuvieron los nombres existentes para los elementos conocidos antiguamente (por ejemplo, oro, mercurio, hierro). Las diferencias nacionales surgieron en torno a los nombres de los elementos, ya sea por conveniencia, por sutilezas lingüísticas o por nacionalismo. Por ejemplo, los hablantes de alemán utilizan "Wasserstoff" (sustancia acuosa) para "hidrógeno", "Sauerstoff" (sustancia ácida) para "oxígeno" y "Stickstoff" (sustancia asfixiante) para "nitrógeno"; el inglés y algunos otros idiomas utilizan "sodium" para "natrium" y "potassium" para "kalium"; y los franceses, italianos, griegos, portugueses y polacos prefieren "azote/azot/azoto" (de raíces que significan "sin vida") para "nitrógeno".
Para fines de comunicación y comercio internacional, los nombres oficiales de los elementos químicos, tanto antiguos como reconocidos más recientemente, son decididos por la Unión Internacional de Química Pura y Aplicada (IUPAC), que ha decidido utilizar una especie de idioma inglés internacional, recurriendo a los nombres ingleses tradicionales incluso cuando el símbolo químico de un elemento se basa en una palabra latina u otra palabra tradicional, por ejemplo, adoptando "gold" en lugar de "aurum" como nombre para el elemento 79 (Au). La IUPAC prefiere las grafías británicas " aluminum " y "caesium" a las grafías estadounidenses "aluminum" y "cesium", y la grafía estadounidense "sulfur" a la británica "sulphur". Sin embargo, los elementos que son prácticos para vender a granel en muchos países a menudo todavía tienen nombres nacionales utilizados localmente, y los países cuyo idioma nacional no utiliza el alfabeto latino probablemente utilicen los nombres de elementos de la IUPAC.
Según la IUPAC, los nombres de los elementos no son nombres propios; por lo tanto, el nombre completo de un elemento no se escribe con mayúscula en inglés, incluso si se deriva de un nombre propio , como en californio y einstenio . Los nombres de los isótopos también se escriben con mayúscula si se escriben con todas las letras, por ejemplo, carbono-12 o uranio-235 . Los símbolos de los elementos químicos (como Cf para el californio y Es para el einstenio) siempre se escriben con mayúscula (ver a continuación).
En la segunda mitad del siglo XX, los laboratorios de física pudieron producir elementos con vidas medias demasiado cortas para que existiera una cantidad apreciable de ellos en cualquier momento. Estos elementos también reciben su nombre de la IUPAC, que generalmente adopta el nombre elegido por el descubridor. Esta práctica puede llevar a la controvertida pregunta de qué grupo de investigación descubrió realmente un elemento, una pregunta que retrasó la denominación de elementos con número atómico de 104 y superior durante una cantidad considerable de tiempo. (Véase controversia sobre la denominación de elementos ).
Los precursores de tales controversias fueron los nombres nacionalistas de los elementos a finales del siglo XIX. Por ejemplo, el lutecio recibió su nombre en referencia a París, Francia. Los alemanes se mostraron reacios a ceder el derecho a nombrarlo a los franceses, por lo que a menudo lo llamaban casiopeio . De manera similar, el descubridor británico del niobio lo llamó originalmente columbio , en referencia al Nuevo Mundo . Se utilizó ampliamente como tal en las publicaciones estadounidenses antes de la estandarización internacional (en 1950).
Antes de que la química se convirtiera en una ciencia , los alquimistas diseñaron símbolos arcanos tanto para los metales como para los compuestos comunes. Sin embargo, estos se utilizaban como abreviaturas en diagramas o procedimientos; no existía el concepto de átomos que se combinaban para formar moléculas . Con sus avances en la teoría atómica de la materia, John Dalton ideó sus propios símbolos más simples, basados en círculos, para representar moléculas.
El sistema actual de notación química fue inventado por Jöns Jacob Berzelius en 1814. En este sistema, los símbolos químicos no son simples abreviaturas (aunque cada uno de ellos consta de letras del alfabeto latino ), sino que están pensados como símbolos universales para personas de todos los idiomas y alfabetos.
Como el latín era el idioma común de la ciencia en la época de Berzelius, sus símbolos eran abreviaturas basadas en los nombres latinos de los elementos (pueden ser nombres en latín clásico de elementos conocidos desde la antigüedad o acuñaciones neolatinas para elementos posteriores). Los símbolos no van seguidos de un punto como en el caso de las abreviaturas. En la mayoría de los casos, los nombres latinos de los elementos utilizados por Berzelius tienen las mismas raíces que el nombre en inglés moderno. Por ejemplo, hidrógeno tiene el símbolo "H" del neolatín hidrogenium , que tiene las mismas raíces griegas que el inglés hidrógeno . Sin embargo, en once casos, los nombres de elementos en latín (tal como los utiliza Berzelius) e inglés tienen raíces diferentes. Ocho de ellos son los siete metales de la antigüedad y un metaloide también conocido desde la antigüedad: "Fe" (latín ferrum ) para el hierro , "Hg" (latín hydrargyrum ) para el mercurio , "Sn" (latín stannum ) para el estaño , "Au" (latín aurum ) para el oro, "Ag" (latín argentum ) para la plata , "Pb" (latín plumbum ) para el plomo , "Cu" (latín cuprum ) para el cobre y "Sb" (latín stibium ) para el antimonio . Los otros tres desajustes entre el neolatín (tal como lo usa Berzelius) y los nombres ingleses son "Na" (neolatín natrium ) para el sodio , "K" (neolatín kalium ) para el potasio y "W" (neolatín wolframium ) para el tungsteno . Estos desajustes se debieron a diferentes propuestas de denominación de los elementos en la era moderna . Inicialmente, Berzelius había sugerido "So" y "Po" para el sodio y el potasio, pero más tarde ese mismo año cambió los símbolos a "Na" y "K".
Los elementos descubiertos después de 1814 también recibieron símbolos químicos únicos, basados en el nombre del elemento. El uso del latín como lengua universal de la ciencia estaba desapareciendo, pero los nombres químicos de los elementos recién descubiertos comenzaron a tomarse prestados de una lengua a otra con pocas o ninguna modificación. Los símbolos de los elementos descubiertos después de 1814 coinciden con sus nombres en inglés, francés (ignorando el acento agudo en ⟨é⟩ ) y alemán (aunque el alemán a menudo permite grafías alternativas con ⟨k⟩ o ⟨z⟩ en lugar de ⟨c⟩ : por ejemplo, el nombre del calcio puede escribirse Calcium o Kalzium en alemán, pero su símbolo siempre es "Ca"). Otros idiomas a veces modifican la ortografía de los nombres de los elementos: en español iterbio (yterbio), en italiano afnio (hafnio), en sueco moskovium (moscovio); pero esas modificaciones no afectan a los símbolos químicos: Yb, Hf, Mc.
Los símbolos químicos se entienden a nivel internacional cuando los nombres de los elementos pueden requerir traducción. Ha habido algunas diferencias en el pasado. Por ejemplo, en el pasado los alemanes usaban "J" (para el nombre Jod ) para el yodo, pero ahora usan "I" y Iod .
La primera letra de un símbolo químico siempre se escribe en mayúscula, como en los ejemplos anteriores, y las letras posteriores, si las hay, siempre se escriben en minúscula. Así, los símbolos del californio y el einstenio son Cf y Es.
También hay símbolos en las ecuaciones químicas para grupos de elementos, por ejemplo en fórmulas comparativas. Estos suelen ser una sola letra mayúscula, y las letras se reservan y no se usan para nombres de elementos específicos. Por ejemplo, " X " indica un grupo variable (generalmente un halógeno) en una clase de compuestos, mientras que " R " es un radical , lo que significa una estructura compuesta como una cadena de hidrocarburos. La letra " Q " se reserva para "calor" en una reacción química. " Y " también se usa a menudo como un símbolo químico general, aunque también es el símbolo del itrio . " Z " también se usa a menudo como un grupo variable general. " E " se usa en química orgánica para denotar un grupo aceptor de electrones o un electrófilo ; de manera similar, " Nu " denota un nucleófilo . " L " se usa para representar un ligando general en química inorgánica y organometálica . " M " también se usa a menudo en lugar de un metal general.
Al menos otros dos símbolos químicos genéricos de dos letras también se utilizan de manera informal: " Ln " para cualquier lantánido y " An " para cualquier actínido . " Rg " se usaba anteriormente para cualquier elemento de gas raro , pero el grupo de gases raros ahora ha sido renombrado como gases nobles y " Rg " ahora se refiere al roentgenio .
Los isótopos de un elemento se distinguen por su número másico (total de protones y neutrones), y este número se combina con el símbolo del elemento. La IUPAC prefiere que los símbolos de los isótopos se escriban en notación superíndice cuando sea posible, por ejemplo, 12 C y 235 U. Sin embargo, también se utilizan otras notaciones, como carbono-12 y uranio-235, o C-12 y U-235.
Como caso especial, los tres isótopos naturales del hidrógeno suelen especificarse como H para 1 H ( protio ), D para 2 H ( deuterio ) y T para 3 H ( tritio ). Esta convención es más fácil de usar en ecuaciones químicas, ya que reemplaza la necesidad de escribir el número másico cada vez. Por lo tanto, la fórmula para el agua pesada puede escribirse D 2 O en lugar de 2 H 2 O.

Solo alrededor del 4% de la masa total del universo está formada por átomos o iones , y por lo tanto está representada por elementos. Esta fracción es alrededor del 15% de la materia total, y el resto de la materia (85%) es materia oscura . La naturaleza de la materia oscura es desconocida, pero no está compuesta por átomos de elementos porque no contiene protones, neutrones ni electrones. (La parte restante de la masa del universo que no es materia está compuesta por la aún menos comprendida energía oscura ).
Los 94 elementos naturales se produjeron mediante al menos cuatro clases de procesos astrofísicos. La mayor parte del hidrógeno, el helio y una cantidad muy pequeña de litio se produjeron en los primeros minutos del Big Bang . Esta nucleosíntesis del Big Bang ocurrió solo una vez; los otros procesos están en curso. La fusión nuclear dentro de las estrellas produce elementos a través de la nucleosíntesis estelar, incluidos todos los elementos desde el carbono hasta el hierro en número atómico. Los elementos con un número atómico más alto que el hierro, incluidos los elementos pesados como el uranio y el plutonio, se producen mediante varias formas de nucleosíntesis explosiva en supernovas y fusiones de estrellas de neutrones . Los elementos ligeros litio , berilio y boro se producen principalmente a través de la espalación de rayos cósmicos (fragmentación inducida por rayos cósmicos ) de carbono, nitrógeno y oxígeno.
En las primeras fases del Big Bang, la nucleosíntesis de hidrógeno dio como resultado la producción de hidrógeno-1 (protio, 1 H) y helio-4 ( 4 He), así como una cantidad menor de deuterio ( 2 H) y cantidades minúsculas (del orden de 10 −10 ) de litio y berilio. Es posible que se hayan producido cantidades incluso más pequeñas de boro en el Big Bang, ya que se ha observado en algunas estrellas muy antiguas, mientras que el carbono no. [22] No se produjeron elementos más pesados que el boro en el Big Bang. Como resultado, la abundancia primordial de átomos (o iones) consistió en ~75% 1 H, 25% 4 He y 0,01% deuterio, con solo pequeños rastros de litio, berilio y quizás boro. [23] El enriquecimiento posterior de los halos galácticos se produjo debido a la nucleosíntesis estelar y la nucleosíntesis de supernovas . [24] Sin embargo, la abundancia de elementos en el espacio intergaláctico todavía puede parecerse mucho a las condiciones primordiales, a menos que se haya enriquecido por algún medio.
En la Tierra (y en otros lugares), se siguen produciendo trazas de varios elementos a partir de otros elementos como productos de procesos de transmutación nuclear . Estos incluyen algunos producidos por rayos cósmicos u otras reacciones nucleares (ver nucleidos cosmogénicos y nucleogénicos ), y otros producidos como productos de desintegración de nucleidos primordiales de larga duración. [25] Por ejemplo, trazas (pero detectables) de carbono-14 ( 14 C) se producen continuamente en el aire por los rayos cósmicos que impactan los átomos de nitrógeno, y argón-40 ( 40 Ar) se produce continuamente por la desintegración de potasio-40 ( 40 K) de origen primordial pero inestable. Además, tres actínidos de origen primordial pero radiactivos, el torio, el uranio y el plutonio, se desintegran a través de una serie de elementos de producción recurrente pero inestable, como el radio y el radón , que están presentes transitoriamente en cualquier muestra que contenga estos metales. Otros tres elementos radiactivos, el tecnecio, el prometio y el neptunio, aparecen sólo de manera incidental en materiales naturales, producidos como átomos individuales por fisión nuclear de los núcleos de varios elementos pesados o en otros procesos nucleares raros.
Además de los 94 elementos que se encuentran en la naturaleza, se han producido varios elementos artificiales mediante la tecnología de la física nuclear . En 2016, estos experimentos habían producido todos los elementos hasta el número atómico 118.
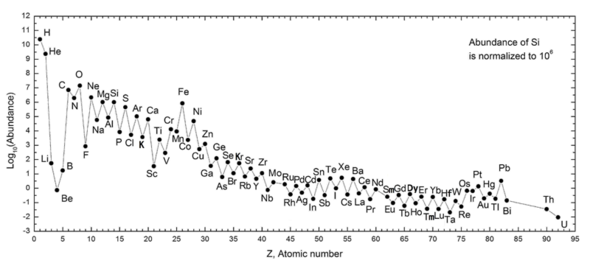
El siguiente gráfico (nótese la escala logarítmica) muestra la abundancia de elementos en nuestro Sistema Solar. La tabla muestra los 12 elementos más comunes en nuestra galaxia (estimados espectroscópicamente), medidos en partes por millón en masa . [26] Las galaxias cercanas que han evolucionado de manera similar tienen un enriquecimiento correspondiente de elementos más pesados que el hidrógeno y el helio. Las galaxias más distantes se están viendo tal como aparecieron en el pasado, por lo que sus abundancias de elementos parecen más cercanas a la mezcla primordial. Sin embargo, como las leyes y los procesos físicos parecen comunes en todo el universo visible , los científicos esperan que estas galaxias hayan desarrollado elementos en abundancia similar.
La abundancia de elementos en el Sistema Solar está en consonancia con su origen a partir de la nucleosíntesis en el Big Bang y una serie de estrellas supernova progenitoras. El hidrógeno y el helio, muy abundantes, son productos del Big Bang, pero los tres elementos siguientes son raros, ya que tuvieron poco tiempo para formarse en el Big Bang y no se producen en las estrellas (sin embargo, se producen en pequeñas cantidades por la ruptura de elementos más pesados en el polvo interestelar, como resultado del impacto de los rayos cósmicos). Comenzando con el carbono, los elementos se producen en las estrellas por acumulación a partir de partículas alfa (núcleos de helio), lo que resulta en una abundancia alternativamente mayor de elementos con números atómicos pares (estos también son más estables). En general, estos elementos hasta el hierro se producen en estrellas grandes en el proceso de convertirse en supernovas . El hierro-56 es particularmente común, ya que es el nucleido más estable que se puede formar fácilmente a partir de partículas alfa (siendo un producto de la desintegración del níquel-56 radiactivo, finalmente formado a partir de 14 núcleos de helio). Los elementos más pesados que el hierro se forman mediante procesos de absorción de energía en grandes estrellas, y su abundancia en el universo (y en la Tierra) generalmente disminuye con su número atómico.
La abundancia de elementos químicos en la Tierra varía según se encuentre en el aire, la corteza terrestre, el océano y en los distintos tipos de vida. La abundancia de elementos en la corteza terrestre difiere de la del Sistema Solar (como se observa en el Sol y en planetas masivos como Júpiter) principalmente en la pérdida selectiva de los elementos más ligeros (hidrógeno y helio) y también de neón, carbono (como hidrocarburos), nitrógeno y azufre volátiles, como resultado del calentamiento solar en la formación temprana del Sistema Solar. El oxígeno, el elemento terrestre más abundante en masa, se retiene en la Tierra por combinación con silicio. El aluminio en un 8% en masa es más común en la corteza terrestre que en el universo y el sistema solar, pero la composición del manto mucho más voluminoso, que tiene magnesio y hierro en lugar de aluminio (que solo se encuentra allí en un 2% de la masa) refleja más de cerca la composición elemental del sistema solar, salvo por la pérdida señalada de elementos volátiles al espacio y la pérdida de hierro que ha migrado al núcleo de la Tierra.
La composición del cuerpo humano , en cambio, se asemeja más a la del agua de mar , salvo que el cuerpo humano tiene reservas adicionales de carbono y nitrógeno necesarias para formar las proteínas y los ácidos nucleicos , junto con fósforo en los ácidos nucleicos y la molécula de transferencia de energía trifosfato de adenosina (ATP) que se produce en las células de todos los organismos vivos. Ciertos tipos de organismos requieren elementos adicionales particulares, por ejemplo, el magnesio en la clorofila de las plantas verdes, el calcio en las conchas de los moluscos o el hierro en la hemoglobina de los glóbulos rojos de los vertebrados .
El concepto de "elemento" como sustancia indivisible se ha desarrollado a través de tres fases históricas principales: definiciones clásicas (como las de los antiguos griegos), definiciones químicas y definiciones atómicas.
La filosofía antigua postuló un conjunto de elementos clásicos para explicar los patrones observados en la naturaleza . Estos elementos originalmente se referían a la tierra , el agua , el aire y el fuego, en lugar de a los elementos químicos de la ciencia moderna.
El término «elementos» ( stoicheia ) fue utilizado por primera vez por el filósofo griego Platón alrededor del año 360 a. C. en su diálogo Timeo , que incluye una discusión sobre la composición de los cuerpos inorgánicos y orgánicos y es un tratado especulativo sobre química. Platón creía que los elementos introducidos un siglo antes por Empédocles estaban compuestos de pequeñas formas poliédricas : tetraedro (fuego), octaedro (aire), icosaedro (agua) y cubo (tierra). [33] [34]
Aristóteles , alrededor del 350 a. C. , también utilizó el término stoicheia y añadió un quinto elemento, el éter , que formaba los cielos. Aristóteles definió un elemento como:
Elemento – uno de aquellos cuerpos en los cuales otros cuerpos pueden descomponerse, y que a su vez no es capaz de ser dividido en otros. [35]
.jpg/440px-Portret_van_Robert_Boyle,_RP-P-OB-4578_(cropped).jpg)
.jpg/440px-Sceptical_chymist_1661_Boyle_Title_page_AQ18_(3).jpg)
En 1661, en El químico escéptico , Robert Boyle propuso su teoría del corpuscularismo, que favorecía el análisis de la materia como constituida por unidades irreducibles de materia (átomos); y, al optar por no alinearse ni con la visión de Aristóteles de los cuatro elementos ni con la visión de Paracelso de los tres elementos fundamentales, dejó abierta la cuestión del número de elementos. Boyle argumentó en contra de un número predeterminado de elementos, directamente contra los tres principios de Paracelso (azufre, mercurio y sal), indirectamente contra los elementos "aristotélicos" (tierra, agua, aire y fuego), ya que Boyle creía que los argumentos contra los primeros eran al menos tan válidos contra los segundos.
Mucho de lo que voy a exponer... puede aplicarse indistintamente a los cuatro elementos peripatéticos y a los tres principios químicos... la hipótesis química parece estar mucho más respaldada por la experiencia que la otra, será conveniente insistir principalmente en refutar esa; especialmente porque la mayoría de los argumentos que se esgrimen en su contra pueden, mediante una pequeña variación, hacerse... al menos con la misma fuerza contra la doctrina aristotélica , menos plausible . [36]
Boyle expuso su punto de vista en cuatro proposiciones. En la primera y la segunda, sugiere que la materia está formada por partículas, pero que estas partículas pueden ser difíciles de separar. Boyle utilizó el concepto de "corpúsculos" (o "átomos", [37] como también los llamó) para explicar cómo un número limitado de elementos podía combinarse para formar una gran cantidad de compuestos.
Propos. I. ... En la primera producción de cuerpos mixtos, la materia universal de la que ... consistían, estaba realmente dividida en pequeñas partículas. [38] ... La generación ... y el desgaste de los cuerpos ... y ... las resoluciones químicas de los cuerpos mixtos, y ... las operaciones de ... los fuegos sobre ellos ... manifiestan su constitución de partes muy diminutas ... Epicuro ... como bien sabéis, supone ... que todos ... los cuerpos ... son producidos por ... átomos, moviéndose de un lado a otro ... en el ... vacío infinito . [39] ... Propos. II. ... Estas diminutas partículas ... estaban ... asociadas en diminutos ... racimos ... no fácilmente disipables en las partículas que las componían. [40] ... Si asignamos a los corpúsculos, de los que cada elemento consiste, un tamaño y una forma peculiares ... tales ... corpúsculos pueden mezclarse en proporciones tan diversas, y ... conectarse de tantas ... maneras, que un número casi increíble de ... concretos pueden estar compuestos de ellos. [41]
Boyle explicó que el oro reacciona con el agua regia y el mercurio con el ácido nítrico, el ácido sulfúrico y el azufre para producir diversos "compuestos", y que se podían recuperar a partir de esos compuestos, tal como se esperaría de los elementos. Sin embargo, Boyle no consideró que el oro, [42] el mercurio [43] o el plomo [42] fueran elementos, sino más bien —junto con el vino [44] — "cuerpos perfectamente mezclados".
El azogue... con agua fuerte se convertirá en un... polvo blanco... con azufre compondrá un... cinabrio rojo sangre. Y, sin embargo, de todos estos compuestos exóticos, podemos recuperar el mismo mercurio corriente. [45] ... Propos. III. ... De la mayoría de estos cuerpos mixtos... puede, con la ayuda del fuego, obtenerse realmente un número determinado (ya sean tres, cuatro o cinco, o menos o más) de sustancias... Los químicos suelen llamar a los ingredientes de los cuerpos mixtos, principios , como los aristotélicos los llaman elementos ... Principios ... como si no estuvieran compuestos de otros cuerpos primarios: y elementos , en cuanto que todos los cuerpos mixtos están compuestos de ellos. [46]
Aunque Boyle es considerado el primer químico moderno, El químico escéptico aún contiene viejas ideas sobre los elementos, ajenas a un punto de vista contemporáneo. El azufre, por ejemplo, no sólo es el familiar no metal amarillo sino también un "alcohol" inflamable. [44]

En 1724, en su libro Logick , el ministro y lógico inglés Isaac Watts enumeró los elementos que los químicos reconocían en aquel momento. La lista de elementos de Watts incluía dos de los principios de Paracelso (el azufre y la sal) y dos elementos clásicos (la tierra y el agua), además del "espíritu". Watts, sin embargo, advirtió una falta de consenso entre los químicos. [47]
Los elementos son sustancias que no pueden ser resueltas o reducidas a dos o más sustancias de diferentes clases... Los seguidores de Aristóteles hicieron que el fuego, el aire, la tierra y el agua fueran los cuatro elementos de los que estaban compuestas todas las cosas terrestres, y supusieron que los cielos eran una quintaesencia o quinta clase de cuerpo, distinto de todos estos; pero, desde que la filosofía experimental... se ha entendido mejor, esta doctrina ha sido abundantemente refutada. Los químicos hacen que el espíritu, la sal, el azufre, el agua y la tierra sean sus cinco elementos, porque pueden reducir todas las cosas terrestres a estos cinco... aunque no todos estén de acuerdo.

La primera lista moderna de elementos fue dada en Elementos de química de Antoine Lavoisier de 1789 , que contenía 33 elementos, incluidos el ligero y el calórico . [48] Para 1818, Jöns Jacob Berzelius había determinado los pesos atómicos de 45 de los 49 elementos aceptados entonces. Dmitri Mendeleev tenía 63 elementos en su tabla periódica de 1869.

Desde Boyle hasta principios del siglo XX, un elemento se definía como una sustancia pura que no se puede descomponer en ninguna sustancia más simple ni transformar en otros elementos mediante procesos químicos. En esa época, los elementos se distinguían generalmente por su peso atómico, una propiedad que se podía medir con bastante precisión mediante las técnicas analíticas disponibles.

El descubrimiento de 1913 por el físico inglés Henry Moseley de que la carga nuclear es la base física del número atómico, que se perfeccionó aún más cuando se comprendió la naturaleza de los protones y neutrones , finalmente condujo a la definición actual de un elemento basada en el número atómico (número de protones). El uso de números atómicos, en lugar de pesos atómicos, para distinguir elementos tiene un mayor valor predictivo (ya que estos números son números enteros) y también resuelve algunas ambigüedades en la visión basada en la química debido a las diferentes propiedades de los isótopos y alótropos dentro del mismo elemento. Actualmente, la IUPAC define que un elemento existe si tiene isótopos con una vida útil más larga que los 10 −14 segundos que tarda el núcleo en formar una nube electrónica. [49]
En 1914 se conocían ochenta y siete elementos, todos ellos de origen natural (véase Descubrimiento de los elementos químicos ). Los elementos naturales restantes se descubrieron o aislaron en décadas posteriores, y también se han producido varios elementos adicionales de forma sintética, siendo Glenn T. Seaborg el pionero de gran parte de ese trabajo . En 1955 se descubrió el elemento 101 y se lo denominó mendelevio en honor a DI Mendeleev, el primero en ordenar los elementos de forma periódica.
Actualmente se sabe que diez materiales que eran familiares para diversas culturas prehistóricas son elementos: carbono, cobre, oro , hierro, plomo, mercurio, plata, azufre, estaño y cinc . Tres materiales adicionales que ahora se aceptan como elementos, arsénico , antimonio y bismuto , fueron reconocidos como sustancias distintas antes de 1500 d. C. El fósforo , el cobalto y el platino fueron aislados antes de 1750.
La mayoría de los elementos naturales restantes fueron identificados y caracterizados en 1900, entre ellos:
Los elementos aislados o producidos desde 1900 incluyen:
El primer elemento transuránico (elemento con un número atómico mayor que 92) descubierto fue el neptunio en 1940. Desde 1999, el Grupo de Trabajo Conjunto IUPAC/IUPAP ha considerado las reclamaciones por el descubrimiento de nuevos elementos. A enero de 2016, la IUPAC ha confirmado el descubrimiento de los 118 elementos. El descubrimiento del elemento 112 fue reconocido en 2009, y se sugirió el nombre copernicio y el símbolo químico Cn para él. [50] El nombre y el símbolo fueron aprobados oficialmente por la IUPAC el 19 de febrero de 2010. [51] El elemento más pesado que se cree que ha sido sintetizado hasta la fecha es el elemento 118, oganesón , el 9 de octubre de 2006, por el Laboratorio Flerov de Reacciones Nucleares en Dubna , Rusia. [10] [52] El tenesino , elemento 117, fue el último elemento que se afirmó haber descubierto, en 2009. [53] El 28 de noviembre de 2016, los científicos de la IUPAC reconocieron oficialmente los nombres de los cuatro elementos más nuevos, con números atómicos 113, 115, 117 y 118. [54] [55]
La siguiente tabla ordenable muestra los 118 elementos conocidos.