Una cadena de transporte de electrones ( ETC [1] ) es una serie de complejos proteicos y otras moléculas que transfieren electrones desde donantes de electrones a aceptores de electrones a través de reacciones redox (tanto la reducción como la oxidación ocurren simultáneamente ) y acoplan esta transferencia de electrones con la transferencia de protones ( iones H + ) a través de una membrana . Muchas de las enzimas en la cadena de transporte de electrones están incrustadas dentro de la membrana .
El flujo de electrones a través de la cadena de transporte de electrones es un proceso exergónico . La energía de las reacciones redox crea un gradiente electroquímico de protones que impulsa la síntesis de trifosfato de adenosina (ATP). En la respiración aeróbica , el flujo de electrones termina con el oxígeno molecular como aceptor final de electrones. En la respiración anaeróbica , se utilizan otros aceptores de electrones, como el sulfato .
En una cadena de transporte de electrones, las reacciones redox son impulsadas por la diferencia en la energía libre de Gibbs de los reactivos y productos. La energía libre liberada cuando un donador y aceptor de electrones de mayor energía se convierten en productos de menor energía, mientras que los electrones se transfieren de un potencial redox menor a uno mayor , es utilizada por los complejos en la cadena de transporte de electrones para crear un gradiente electroquímico de iones. Es este gradiente electroquímico el que impulsa la síntesis de ATP a través del acoplamiento con la fosforilación oxidativa con la ATP sintasa . [2]
En los organismos eucariotas , la cadena de transporte de electrones, y sitio de fosforilación oxidativa , se encuentra en la membrana mitocondrial interna . La energía liberada por las reacciones de oxígeno y compuestos reducidos como el citocromo c e (indirectamente) NADH y FADH 2 es utilizada por la cadena de transporte de electrones para bombear protones al espacio intermembrana , generando el gradiente electroquímico sobre la membrana mitocondrial interna . En los eucariotas fotosintéticos , la cadena de transporte de electrones se encuentra en la membrana tilacoide . Aquí, la energía de la luz impulsa el transporte de electrones a través de una bomba de protones y el gradiente de protones resultante causa la síntesis posterior de ATP. En las bacterias , la cadena de transporte de electrones puede variar entre especies, pero siempre constituye un conjunto de reacciones redox que están acopladas a la síntesis de ATP a través de la generación de un gradiente electroquímico y la fosforilación oxidativa a través de la ATP sintasa. [3]

La mayoría de las células eucariotas tienen mitocondrias , que producen ATP a partir de reacciones de oxígeno con productos del ciclo del ácido cítrico , el metabolismo de los ácidos grasos y el metabolismo de los aminoácidos . En la membrana mitocondrial interna , los electrones del NADH y el FADH 2 pasan a través de la cadena de transporte de electrones al oxígeno, que proporciona la energía que impulsa el proceso a medida que se reduce a agua. [4] La cadena de transporte de electrones comprende una serie enzimática de donantes y aceptores de electrones. Cada donante de electrones pasará electrones a un aceptor de mayor potencial redox, que a su vez dona estos electrones a otro aceptor, un proceso que continúa a lo largo de la serie hasta que los electrones pasan al oxígeno, el aceptor terminal de electrones en la cadena. Cada reacción libera energía porque un donante y un aceptor de mayor energía se convierten en productos de menor energía. A través de los electrones transferidos, esta energía se utiliza para generar un gradiente de protones a través de la membrana mitocondrial al "bombear" protones al espacio intermembrana, lo que produce un estado de mayor energía libre que tiene el potencial de realizar trabajo. Todo este proceso se denomina fosforilación oxidativa , ya que el ADP se fosforila a ATP mediante el uso del gradiente electroquímico que las reacciones redox de la cadena de transporte de electrones han establecido impulsadas por reacciones de liberación de energía del oxígeno.
La energía asociada con la transferencia de electrones a lo largo de la cadena de transporte de electrones se utiliza para bombear protones desde la matriz mitocondrial al espacio intermembrana, creando un gradiente electroquímico de protones ( ΔpH ) a través de la membrana mitocondrial interna. Este gradiente de protones es en gran medida, pero no exclusivamente, responsable del potencial de membrana mitocondrial (ΔΨ M ). [5] Permite que la ATP sintasa utilice el flujo de H + a través de la enzima de vuelta a la matriz para generar ATP a partir de adenosina difosfato (ADP) y fosfato inorgánico . El complejo I (NADH coenzima Q reductasa; marcada como I) acepta electrones del transportador de electrones del ciclo de Krebs nicotinamida adenina dinucleótido (NADH) y los pasa a la coenzima Q ( ubiquinona ; marcada como Q), que también recibe electrones del complejo II ( succinato deshidrogenasa ; marcada como II). Q pasa electrones al complejo III ( complejo citocromo bc 1 ; marcado como III), que los pasa al citocromo c (cyt c ). El citocromo c pasa electrones al complejo IV ( citocromo c oxidasa ; marcado como IV).
Se han identificado cuatro complejos unidos a la membrana en las mitocondrias. Cada uno de ellos es una estructura transmembrana extremadamente compleja que está incrustada en la membrana interna. Tres de ellos son bombas de protones . Las estructuras están conectadas eléctricamente mediante transportadores de electrones solubles en lípidos y transportadores de electrones solubles en agua. La cadena de transporte de electrones general se puede resumir de la siguiente manera:
NADH, H + → Complejo I → Q → Complejo III → citocromo c → Complejo IV → H 2 O ↑ Complejo II ↑ Succinato
En el complejo I (NADH ubiquinona oxidorreductasa, NADH deshidrogenasa tipo I o complejo mitocondrial I; EC 1.6.5.3), se eliminan dos electrones del NADH y se transfieren a un transportador liposoluble, la ubiquinona (Q). El producto reducido, ubiquinol (QH 2 ), se difunde libremente dentro de la membrana y el complejo I transloca cuatro protones (H + ) a través de la membrana, produciendo así un gradiente de protones. El complejo I es uno de los principales sitios en los que se produce una fuga prematura de electrones al oxígeno, siendo así uno de los principales sitios de producción de superóxido . [6]
La trayectoria de los electrones es la siguiente:
El NADH se oxida a NAD + , reduciendo el mononucleótido de flavina a FMNH2 en un paso de dos electrones. Luego, el FMNH2 se oxida en dos pasos de un electrón, a través de un intermediario de semiquinona . De este modo, cada electrón se transfiere del FMNH2 a un grupo Fe–S , del grupo Fe-S a la ubiquinona (Q). La transferencia del primer electrón da como resultado la forma de radical libre ( semiquinona ) de Q, y la transferencia del segundo electrón reduce la forma de semiquinona a la forma de ubiquinol, QH2 . Durante este proceso, se translocan cuatro protones desde la matriz mitocondrial al espacio intermembrana. [7] A medida que los electrones se mueven a través del complejo, se produce una corriente de electrones a lo largo del ancho de 180 Angstroms del complejo dentro de la membrana. Esta corriente impulsa el transporte activo de cuatro protones al espacio intermembrana por cada dos electrones del NADH. [8]
En el complejo II ( succinato deshidrogenasa o succinato-CoQ reductasa; EC 1.3.5.1) se entregan electrones adicionales al grupo de quinonas (Q) que se originan a partir del succinato y se transfieren (a través del dinucleótido de flavina y adenina (FAD) ) a Q. El complejo II consta de cuatro subunidades proteicas: succinato deshidrogenasa (SDHA); succinato deshidrogenasa [ubiquinona] subunidad hierro-azufre mitocondrial (SDHB); subunidad C del complejo succinato deshidrogenasa (SDHC); y subunidad D del complejo succinato deshidrogenasa (SDHD). Otros donantes de electrones (p. ej., ácidos grasos y glicerol 3-fosfato) también dirigen electrones a Q (a través de FAD). El complejo II es una vía de transporte de electrones paralela al complejo I, pero a diferencia del complejo I, no se transportan protones al espacio intermembrana en esta vía. Por lo tanto, la vía a través del complejo II contribuye con menos energía al proceso general de la cadena de transporte de electrones.
En el complejo III ( complejo citocromo bc 1 o CoQH 2 -citocromo c reductasa; EC 1.10.2.2), el ciclo Q contribuye al gradiente de protones mediante una absorción/liberación asimétrica de protones. Se eliminan dos electrones de QH 2 en el sitio Q O y se transfieren secuencialmente a dos moléculas de citocromo c , un transportador de electrones soluble en agua ubicado dentro del espacio intermembrana. Los otros dos electrones pasan secuencialmente a través de la proteína hasta el sitio Q i donde la parte quinona de la ubiquinona se reduce a quinol. Se forma un gradiente de protones por la oxidación de un quinol ( ) en el sitio Q o para formar una quinona ( ) en el sitio Q i . (En total, se translocan cuatro protones: dos protones reducen la quinona a quinol y dos protones se liberan de dos moléculas de ubiquinol).
Cuando se reduce la transferencia de electrones (debido a un alto potencial de membrana o inhibidores respiratorios como la antimicina A), el Complejo III puede perder electrones hacia el oxígeno molecular, lo que resulta en la formación de superóxido.
Este complejo es inhibido por dimercaprol (British Anti-Lewisite, BAL), naftoquinona y antimicina.
En el complejo IV ( citocromo c oxidasa ; EC 1.9.3.1), a veces llamado citocromo AA3, se eliminan cuatro electrones de cuatro moléculas de citocromo c y se transfieren al oxígeno molecular (O 2 ) y cuatro protones, produciendo dos moléculas de agua. El complejo contiene iones de cobre coordinados y varios grupos hemo. Al mismo tiempo, se eliminan ocho protones de la matriz mitocondrial (aunque solo cuatro se translocan a través de la membrana), lo que contribuye al gradiente de protones. Los detalles exactos del bombeo de protones en el complejo IV aún están en estudio. [9] El cianuro es un inhibidor del complejo IV.
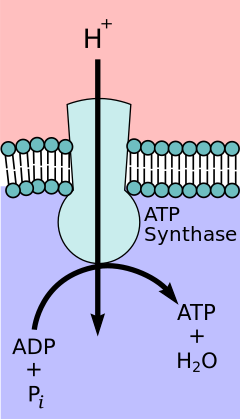
Según la hipótesis de acoplamiento quimiosmótico , propuesta por el premio Nobel de Química Peter D. Mitchell , la cadena de transporte de electrones y la fosforilación oxidativa están acopladas por un gradiente de protones a través de la membrana mitocondrial interna. El eflujo de protones desde la matriz mitocondrial crea un gradiente electroquímico (gradiente de protones). Este gradiente es utilizado por el complejo F O F 1 ATP sintasa para producir ATP a través de la fosforilación oxidativa. La ATP sintasa a veces se describe como el Complejo V de la cadena de transporte de electrones. [10] El componente F O de la ATP sintasa actúa como un canal iónico que proporciona un flujo de protones de regreso a la matriz mitocondrial. Está compuesto por las subunidades a, b y c. Los protones en el espacio intermembrana de las mitocondrias ingresan primero al complejo ATP sintasa a través de un canal de la subunidad a . Luego, los protones se mueven a las subunidades c. [11] El número de subunidades c determina cuántos protones se requieren para hacer que el F O gire una revolución completa. Por ejemplo, en los humanos, hay 8 subunidades c, por lo tanto, se requieren 8 protones. [12] Después de las subunidades c , los protones finalmente ingresan a la matriz a través de un canal de subunidad a que se abre hacia la matriz mitocondrial. [11] Este reflujo libera energía libre producida durante la generación de las formas oxidadas de los transportadores de electrones (NAD + y Q) con energía proporcionada por O 2 . La energía libre se utiliza para impulsar la síntesis de ATP, catalizada por el componente F 1 del complejo. [13]
El acoplamiento con la fosforilación oxidativa es un paso clave para la producción de ATP. Sin embargo, en casos específicos, desacoplar los dos procesos puede ser biológicamente útil. La proteína desacopladora, termogenina , presente en la membrana mitocondrial interna del tejido adiposo marrón , proporciona un flujo alternativo de protones de regreso a la matriz mitocondrial interna. La tiroxina también es un desacoplador natural. Este flujo alternativo da lugar a la termogénesis en lugar de a la producción de ATP. [14]
El flujo inverso de electrones es la transferencia de electrones a través de la cadena de transporte de electrones mediante reacciones redox inversas. Por lo general, se requiere el uso de una cantidad significativa de energía, lo que puede reducir las formas oxidadas de los donantes de electrones. Por ejemplo, el NAD + puede reducirse a NADH mediante el complejo I. [15] Hay varios factores que se ha demostrado que inducen el flujo inverso de electrones. Sin embargo, es necesario realizar más investigaciones para confirmarlo. Un ejemplo es el bloqueo de la ATP sintasa, que da como resultado una acumulación de protones y, por lo tanto, una mayor fuerza protón-motriz , lo que induce el flujo inverso de electrones . [16]
En los eucariotas, el NADH es el donador de electrones más importante. La cadena de transporte de electrones asociada es NADH → Complejo I → Q → Complejo III → citocromo c → Complejo IV → O 2 donde los complejos I, III y IV son bombas de protones, mientras que Q y el citocromo c son transportadores móviles de electrones. El aceptor de electrones para este proceso es el oxígeno molecular.
En los procariotas ( bacterias y arqueas ) la situación es más complicada, porque hay varios donantes de electrones diferentes y varios aceptores de electrones diferentes. La cadena de transporte de electrones generalizada en las bacterias es:
Donante Donante Donante ↓ ↓ ↓ deshidrogenasa → quinona → bc 1 → citocromo ↓ ↓ oxidasa(reductasa) oxidasa(reductasa) ↓ ↓ Aceptador Aceptador
Los electrones pueden entrar en la cadena en tres niveles: a nivel de una deshidrogenasa , a nivel del pool de quinonas o a nivel de un transportador de electrones móvil del citocromo . Estos niveles corresponden a potenciales redox sucesivamente más positivos o a diferencias de potencial sucesivamente menores en relación con el aceptor terminal de electrones. En otras palabras, corresponden a cambios de energía libre de Gibbs sucesivamente menores para la reacción redox global.
Las bacterias individuales utilizan múltiples cadenas de transporte de electrones, a menudo de forma simultánea. Las bacterias pueden utilizar varios donantes de electrones, varias deshidrogenasas, varias oxidasas y reductasas diferentes y varios aceptores de electrones diferentes. Por ejemplo, E. coli (cuando crece aeróbicamente utilizando glucosa y oxígeno como fuente de energía) utiliza dos NADH deshidrogenasas diferentes y dos quinol oxidasas diferentes, lo que da un total de cuatro cadenas de transporte de electrones diferentes que funcionan simultáneamente.
Una característica común de todas las cadenas de transporte de electrones es la presencia de una bomba de protones para crear un gradiente electroquímico sobre una membrana. Las cadenas de transporte de electrones bacterianas pueden contener hasta tres bombas de protones, como las mitocondrias, o pueden contener dos o al menos una.
En la biosfera actual, los donantes de electrones más comunes son las moléculas orgánicas. Los organismos que utilizan moléculas orgánicas como fuente de electrones se denominan organótrofos . Los quimioorganótrofos (animales, hongos, protistas) y los fotolitotrofos (plantas y algas) constituyen la gran mayoría de todas las formas de vida conocidas.
Algunos procariotas pueden utilizar materia inorgánica como fuente de electrones. Este tipo de organismo se denomina (quimio)litotrofo ("devorador de rocas"). Los donantes de electrones inorgánicos incluyen hidrógeno , monóxido de carbono , amoníaco , nitrito , azufre , sulfuro , óxido de manganeso y hierro ferroso . Se han encontrado litótrofos creciendo en formaciones rocosas a miles de metros por debajo de la superficie de la Tierra. Debido a su volumen de distribución, los litótrofos pueden superar en número a los organótrofos y fotótrofos en nuestra biosfera .
El uso de donantes de electrones inorgánicos como el hidrógeno como fuente de energía es de particular interés para el estudio de la evolución . Este tipo de metabolismo debe haber precedido lógicamente al uso de moléculas orgánicas y oxígeno como fuente de energía.
Las bacterias pueden utilizar varios donantes de electrones diferentes. Cuando la materia orgánica es la fuente de electrones, el donante puede ser NADH o succinato, en cuyo caso los electrones entran en la cadena de transporte de electrones a través de la NADH deshidrogenasa (similar al Complejo I en las mitocondrias) o la succinato deshidrogenasa (similar al Complejo II ). Se pueden utilizar otras deshidrogenasas para procesar diferentes fuentes de energía: formiato deshidrogenasa, lactato deshidrogenasa, gliceraldehído-3-fosfato deshidrogenasa, H 2 deshidrogenasa ( hidrogenasa ), cadena de transporte de electrones. Algunas deshidrogenasas también son bombas de protones, mientras que otras canalizan electrones hacia el depósito de quinonas. La mayoría de las deshidrogenasas muestran una expresión inducida en la célula bacteriana en respuesta a las necesidades metabólicas desencadenadas por el entorno en el que crecen las células. En el caso de la lactato deshidrogenasa en E. coli , la enzima se utiliza aeróbicamente y en combinación con otras deshidrogenasas. Es inducible y se expresa cuando la concentración de DL-lactato en la célula es alta. [ cita requerida ]
Las quinonas son transportadores móviles solubles en lípidos que transportan electrones (y protones) entre complejos macromoleculares grandes y relativamente inmóviles incrustados en la membrana. Las bacterias utilizan ubiquinona (coenzima Q, la misma quinona que utilizan las mitocondrias) y quinonas relacionadas, como la menaquinona (vitamina K 2 ). Las arqueas del género Sulfolobus utilizan caldariellaquinona. [17] El uso de diferentes quinonas se debe a ligeros cambios en los potenciales redox causados por cambios en la estructura. El cambio en los potenciales redox de estas quinonas puede deberse a cambios en los aceptores de electrones o variaciones de los potenciales redox en los complejos bacterianos. [18]
Una bomba de protones es cualquier proceso que crea un gradiente de protones a través de una membrana. Los protones pueden moverse físicamente a través de una membrana, como se ve en los complejos mitocondriales I y IV . El mismo efecto puede producirse moviendo electrones en la dirección opuesta. El resultado es la desaparición de un protón del citoplasma y la aparición de un protón en el periplasma. El complejo mitocondrial III es este segundo tipo de bomba de protones, que está mediada por una quinona (el ciclo Q ).
Algunas deshidrogenasas son bombas de protones, mientras que otras no. La mayoría de las oxidasas y reductasas son bombas de protones, pero algunas no lo son. El citocromo bc 1 es una bomba de protones que se encuentra en muchas bacterias, pero no en todas (no en E. coli ). Como su nombre lo indica, el bc 1 bacteriano es similar al bc 1 mitocondrial ( complejo III ).
Los citocromos son proteínas que contienen hierro y se encuentran en dos ambientes muy diferentes.
Algunos citocromos son transportadores solubles en agua que transportan electrones hacia y desde grandes estructuras macromoleculares inmóviles incrustadas en la membrana. El transportador de electrones móvil del citocromo en las mitocondrias es el citocromo c . Las bacterias utilizan varios transportadores de electrones móviles del citocromo diferentes.
Otros citocromos se encuentran dentro de macromoléculas como el complejo III y el complejo IV . También funcionan como transportadores de electrones, pero en un entorno intramolecular y de estado sólido muy diferente.
Los electrones pueden ingresar a una cadena de transporte de electrones a nivel de un citocromo móvil o de un transportador de quinona. Por ejemplo, los electrones provenientes de donantes de electrones inorgánicos (nitrito, hierro ferroso, cadena de transporte de electrones) ingresan a la cadena de transporte de electrones a nivel del citocromo. Cuando los electrones ingresan a un nivel redox mayor que el NADH, la cadena de transporte de electrones debe operar en sentido inverso para producir esta molécula necesaria de mayor energía.
Como hay varios donantes de electrones diferentes (materia orgánica en los organótrofos, materia inorgánica en los litótrofos), hay varios aceptores de electrones diferentes, tanto orgánicos como inorgánicos. Al igual que en otros pasos de la cadena de transporte de electrones, se necesita una enzima para ayudar en el proceso.
Si hay oxígeno disponible, se utiliza con mayor frecuencia como aceptor terminal de electrones en bacterias aeróbicas y anaerobios facultativos. Una oxidasa reduce el O2 a agua mientras oxida algo más. En las mitocondrias, el complejo de membrana terminal ( Complejo IV ) es la citocromo oxidasa, que oxida el citocromo. Las bacterias aeróbicas utilizan varias oxidasas terminales diferentes. Por ejemplo, E. coli (un anaerobio facultativo ) no tiene una citocromo oxidasa ni un complejo bc 1. En condiciones aeróbicas, utiliza dos quinol oxidasas terminales diferentes (ambas bombas de protones) para reducir el oxígeno a agua.
Las oxidasas terminales bacterianas se pueden dividir en clases según las moléculas que actúan como aceptores terminales de electrones. Las oxidasas de clase I son citocromo oxidasas y utilizan el oxígeno como aceptor terminal de electrones. Las oxidasas de clase II son quinol oxidasas y pueden utilizar una variedad de aceptores terminales de electrones. Ambas clases se pueden subdividir en categorías según los componentes redox-activos que contienen. Por ejemplo, las oxidasas terminales de clase 1 de hemo aa3 son mucho más eficientes que las oxidasas terminales de clase 2. [2]
En la mayoría de los ambientes anaeróbicos se utilizan diferentes aceptores de electrones, entre ellos nitrato, nitrito, hierro férrico, sulfato, dióxido de carbono y pequeñas moléculas orgánicas como el fumarato. Cuando las bacterias crecen en ambientes anaeróbicos , el aceptor terminal de electrones se reduce mediante una enzima llamada reductasa. E. coli puede utilizar fumarato reductasa, nitrato reductasa, nitrito reductasa, DMSO reductasa o trimetilamina-N-óxido reductasa, según la disponibilidad de estos aceptores en el ambiente.
La mayoría de las oxidasas y reductasas terminales son inducibles . El organismo las sintetiza según sus necesidades, en respuesta a condiciones ambientales específicas.
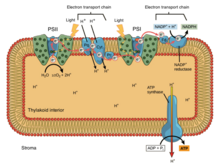
En la fosforilación oxidativa , los electrones se transfieren desde un donador de electrones como el NADH a un aceptor como el O 2 a través de una cadena de transporte de electrones, liberando energía. En la fotofosforilación , la energía de la luz solar se utiliza para crear un donador de electrones de alta energía que posteriormente puede reducir los componentes oxidados y acoplarse a la síntesis de ATP a través de la translocación de protones por la cadena de transporte de electrones. [9]
Las cadenas de transporte de electrones fotosintéticos, al igual que la cadena mitocondrial, pueden considerarse un caso especial de los sistemas bacterianos. Utilizan transportadores móviles de quinona solubles en lípidos ( filoquinona y plastoquinona ) y transportadores móviles solubles en agua ( citocromos ). También contienen una bomba de protones . La bomba de protones en todas las cadenas fotosintéticas se asemeja al complejo III mitocondrial . La teoría comúnmente aceptada de la simbiogénesis propone que ambos orgánulos descienden de bacterias.
{{cite journal}}: Requiere citar revista |journal=( ayuda ){{cite book}}: |journal=ignorado ( ayuda )