
La hipoxia se refiere a condiciones de bajo oxígeno . Para los organismos que respiran aire, la hipoxia es problemática, pero para muchos organismos anaeróbicos, la hipoxia es esencial. La hipoxia se aplica a muchas situaciones, pero generalmente se refiere a la atmósfera y las aguas naturales. [3]
La hipoxia atmosférica ocurre naturalmente en altitudes elevadas . La presión atmosférica total disminuye a medida que aumenta la altitud, lo que provoca una presión parcial de oxígeno más baja, lo que se define como hipoxia hipobárica . El oxígeno permanece en el 20,9% de la mezcla total de gases, a diferencia de la hipoxia hipóxica , donde el porcentaje de oxígeno en el aire (o en la sangre) disminuye. Esto es común en las madrigueras selladas de algunos animales subterráneos, como los blesmols . [4] La hipoxia atmosférica es también la base del entrenamiento en altitud , que es una parte estándar del entrenamiento para los atletas de élite. Varias empresas imitan la hipoxia utilizando una atmósfera artificial normobárica .
Un sistema acuático que carece de oxígeno disuelto (0% de saturación) se denomina anaeróbico, reductor o anóxico .
En el agua, los niveles de oxígeno son aproximadamente 7 ppm o 0,0007% en agua de buena calidad, pero fluctúan. [5] Muchos organismos requieren condiciones hipóxicas. El oxígeno es venenoso, por ejemplo, para las bacterias anaeróbicas . [3]
El agotamiento de oxígeno generalmente se expresa como un porcentaje del oxígeno que se disolvería en el agua a la temperatura y salinidad predominantes. Un sistema con baja concentración—en el rango entre 1 y 30% de saturación—se llama hipóxico o disóxico . La mayoría de los peces no pueden vivir por debajo del 30% de saturación, ya que dependen del oxígeno para obtener energía de sus nutrientes. La hipoxia conduce a una reproducción deficiente de los peces restantes debido a una alteración endocrina . [6] Un ambiente acuático "saludable" rara vez debería experimentar menos del 80% de saturación. La zona exaeróbica se encuentra en el límite de las zonas anóxica e hipóxica.
La hipoxia puede ocurrir en toda la columna de agua y también en altitudes elevadas, así como cerca de los sedimentos en el fondo. Por lo general, se extiende a lo largo del 20-50% de la columna de agua, pero depende de la profundidad del agua y la ubicación de las picnoclinas (cambios rápidos en la densidad del agua con la profundidad). Puede ocurrir en el 10-80% de la columna de agua. Por ejemplo, en una columna de agua de 10 metros, puede llegar hasta 2 metros bajo la superficie. En una columna de agua de 20 metros, puede extenderse hasta 8 metros bajo la superficie. [7]
El agotamiento del oxígeno hipolimnético puede provocar "muertes" tanto en verano como en invierno. Durante la estratificación del verano , los aportes de materia orgánica y la sedimentación de los productores primarios pueden aumentar las tasas de respiración en el hipolimnio . Si el agotamiento del oxígeno llega a ser extremo, los organismos aeróbicos, como los peces, pueden morir, lo que se conoce como "muerte de verano". [8] Los mismos fenómenos pueden ocurrir en invierno, pero por diferentes razones. Durante el invierno, la capa de hielo y nieve puede atenuar la luz y, por lo tanto, reducir las tasas de fotosíntesis. La congelación de un lago también impide las interacciones aire-agua que permiten el intercambio de oxígeno. Esto crea una falta de oxígeno mientras continúa la respiración. Cuando el oxígeno se agota mucho, los organismos anaeróbicos pueden morir, lo que provoca una "muerte invernal". [8]

El agotamiento del oxígeno puede deberse a una serie de factores naturales, pero suele ser una preocupación como consecuencia de la contaminación y la eutrofización , en la que los nutrientes de las plantas ingresan a un río, lago u océano y se fomenta la proliferación de fitoplancton . Mientras que el fitoplancton, a través de la fotosíntesis , aumentará la saturación de OD durante las horas del día, la densa población de una floración reduce la saturación de OD durante la noche mediante la respiración . Cuando las células del fitoplancton mueren, se hunden hacia el fondo y son descompuestas por bacterias , proceso que reduce aún más el OD en la columna de agua. Si el agotamiento del oxígeno progresa hasta convertirse en hipoxia, pueden morir peces y también pueden morir invertebrados como gusanos y almejas en el fondo.

La hipoxia también puede ocurrir en ausencia de contaminantes. En los estuarios, por ejemplo, debido a que el agua dulce que fluye de un río al mar es menos densa que el agua salada, puede producirse una estratificación en la columna de agua. Por lo tanto, se reduce la mezcla vertical entre las masas de agua, lo que restringe el suministro de oxígeno desde las aguas superficiales a las aguas más salinas del fondo. La concentración de oxígeno en la capa inferior puede entonces llegar a ser lo suficientemente baja como para que se produzca hipoxia. Las áreas particularmente propensas a esto incluyen aguas poco profundas de cuerpos de agua semicerrados como el Waddenzee o el Golfo de México , donde la escorrentía terrestre es sustancial. En estas zonas se puede crear la llamada " zona muerta ". Las condiciones de bajo oxígeno disuelto suelen ser estacionales, como es el caso en Hood Canal y áreas de Puget Sound , en el estado de Washington. [9] El Instituto de Recursos Mundiales ha identificado 375 zonas costeras hipóxicas en todo el mundo, concentradas en zonas costeras de Europa occidental, las costas oriental y meridional de Estados Unidos y Asia oriental, particularmente en Japón. [10]

La hipoxia también puede ser la explicación de fenómenos periódicos como el jubileo de Mobile Bay , donde la vida acuática repentinamente se precipita hacia las aguas poco profundas, tal vez tratando de escapar del agua sin oxígeno. La reciente matanza generalizada de mariscos cerca de las costas de Oregón y Washington también se atribuye a la ecología de las zonas muertas cíclicas . [11]
El fitoplancton está formado principalmente por lignina y celulosa, que se descomponen mediante mecanismos oxidativos, que consumen oxígeno. [12]
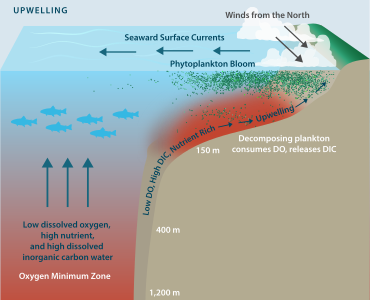
La descomposición del fitoplancton en el medio ambiente depende de la presencia de oxígeno, y una vez que ya no hay oxígeno en los cuerpos de agua, las ligninperoxidasas no pueden continuar descomponiendo la lignina. Cuando no hay oxígeno en el agua, el tiempo necesario para la descomposición del fitoplancton cambia de 10,7 días a un total de 160 días.
La tasa de descomposición del fitoplancton se puede representar mediante esta ecuación:
En esta ecuación, G(t) es la cantidad total de partículas de carbono orgánico (POC) en un momento dado, t. G(0) es la concentración de POC antes de que se produzca la descomposición. k es una tasa constante en el año-1 y t es el tiempo en años. Para la mayoría de los POC del fitoplancton, el k es de alrededor de 12,8 años-1, o alrededor de 28 días para que casi el 96% del carbono se descomponga en estos sistemas. Mientras que para los sistemas anóxicos, la descomposición del POC tarda 125 días, más de cuatro veces más. [15] Se necesita aproximadamente 1 mg de oxígeno para descomponer 1 mg de POC en el medio ambiente y, por lo tanto, la hipoxia se produce rápidamente ya que el oxígeno se utiliza rápidamente para digerir el POC. Alrededor del 9% del POC del fitoplancton se puede descomponer en un solo día a 18 °C. Por lo tanto, se necesitan unos once días para descomponer completamente el fitoplancton. [dieciséis]
Una vez que se descompone el POC, estas partículas se pueden convertir en otro carbono disuelto, como dióxido de carbono, iones bicarbonato y carbonato. Hasta el 30% del fitoplancton se puede descomponer en carbono disuelto. Cuando estas partículas de carbono orgánico interactúan con la luz ultravioleta de 350 nm, se forma carbono inorgánico disuelto, eliminando aún más oxígeno del medio ambiente en forma de dióxido de carbono, iones de bicarbonato y carbonato. El carbono inorgánico disuelto se produce a razón de 2,3 a 6,5 mg/(m 3 ⋅día). [17]
A medida que el fitoplancton se descompone, el fósforo y el nitrógeno libres quedan disponibles en el medio ambiente, lo que también fomenta condiciones hipóxicas. A medida que se produce la descomposición de este fitoplancton, más fósforo se convierte en fosfatos y nitrógeno en nitratos. Esto agota aún más el oxígeno en el medio ambiente, creando aún más zonas hipóxicas en mayores cantidades. A medida que se desplazan más minerales como el fósforo y el nitrógeno a estos sistemas acuáticos, el crecimiento del fitoplancton aumenta considerablemente y, tras su muerte, se forman zonas hipóxicas. [18]
{{cite journal}}: CS1 maint: multiple names: authors list (link)